
Tomchuk_POSІB_VET_BІOHІMІJa
.pdfпроцес їх приєднання. Тому ступінь окиснення атома зростає при окисненні і зменшується при відновленні.
Робочими розчинами в оксидиметрії є розчин окисників (КМnО4, І2, К2Сг2О7, КВrО3 та ін.) і відновників (Na2S2O3, SnCl2, NaAsO2 та ін).
Усі методи оксидиметрії класифікують залежно від окисника або відновника, які використовуються в робочому розчині. Наприклад, якщо метод базується на окисненні перманганатом, його називають перманганатометрією, на окисненні йодом – йодомет-
рією, на окисненні хроматом – хроматометрією та ін.
Йодометрія. Вільний йод здатен забирати електрони від речовин, які легко їх віддають (відновники), і тому є окисником. Іони I− під виливом речовин, які здатні приєднувати електрони – окисників, легко віддають їх і виступають таким чином як відновники.
Виходячи з цього, можна констатувати, що метод йодометрії ґрунтується на окисно-відновних процесах, які пов’язані з перетворенням елементарного) йоду на іони I− , або навпаки. Речовини, які окиснюються, можна визначати за кількістю вільного йоду, який вступає в реакцію з ними. Відновлюючі речовини визначаються за кількістю виділеного при реакції з ними вільного йоду. Таким чином, визначаючи кількість йоду до і після реакції можна обчислити кількість окисненої або відновленої речовини.
Як робочий розчин застосовують розчин натрію тіосульфат Na2S2O3 та йоду, а індикатором служить крохмаль.
3. Методи осадження. Методами осадження називають методи об’ємного аналізу, які ґрунтуються на використанні реакцій, що супроводжуються випадінням осаду.
Реакції осадження належать до оборотних іонообмінних реакцій. Вони відбуваються в тому випадку, коли протилежно заряджені іони двох розчинних речовин-електролітів утворюють малорозчинну речовину.
Але як відомо, випадінням осаду супроводжується досить велика кількість хімічних реакцій, проте далеко не всі з них можуть бути використані для об’ємно-аналітичних визначень. Багато подібних реакцій не відповідають певним вимогам щодо характеру осаду, повноти осадження, можливості підбору відповідного індикатора.
Необхідною умовою придатності реакцій осадження для об’ємних визначень, як і у випадку інших об’ємно-аналітичних
21

методів, є можливість точного спостереження моменту закінчення реакції (точки еквівалентності).
Найпоширенішими методами осадження є аргентометрія, роданідометрія та меркуриметрія.
4. Метод комплексометрії. Комплексонометричний метод аналізу ґрунтується на використанні реакцій, які супроводжуються утворенням комплексних сполук катіонів з комплексонами – органічними речовинами, які відносяться до класу амінополікарбонових кислот. У комплексонометрії використовують такі комплексоутворювачі – нітрилотриоцтова кислота (комплексон І) N(CH2COOH)3, етилендіамінтетраоцтова кислота (комплексон ІІ, ЕДТА) (HOOCCH2)2N(CH2)2N(CH2COOH)2, двонатрієва сіль етилендіамінтетраоцтової кислоти (комплексон ІІІ, трилон Б, ЕДТА-Nа). У біохімічній практиці найбільш використовується останній комплексон – трилон Б, структурна формула якого має такий вигляд:
HOOCH2C |
|
CH2COOH |
||||
N |
|
CH2 |
|
CH2 |
|
N |
|
|
|
||||
NaOOCH2C |
|
CH2COONa |
||||
Ця сполука містить як карбокисльні групи (-СООН), так і амінний азот (N−), тому вона водночас проявляє властивості кислоти, яка здатна утворювати солі з різними катіонами, і властивості комплексоутворюючої речовини.
ЕДТА-Nа (ЕДТА) утворює комплексні сполуки (внутрішньо комплексні солі) практично з усіма іонами металів, включаючи лужноземельні та лужні метали. Подібні внутрішньо комплексні солі утворюються, з одного боку, за рахунок заміщення іонами метала-комплексоутворювача активних атомів Гідрогену карбоксильних груп, з якими він сполучається за допомогою головних валентностей, а з іншого – взаємодії з атомами Нітрогену, які здатні поєднуватися з даним іоном метала-комплексоутворювача за допомогою побічної (координаційної валентності).
Робочими розчинами в комплексонометрії є розчини ком лексонів. До аналізованого розчину при титруванні додається буферний розчин для створення потрібного значення рН та індикатор. Для встановлення точки еквівалентності застосовують спеціальні мета-
22
лоіндикатори органічної природи – мурексид, еріохром чорний Т (хромоген спеціальний ЕТОО), кислотний хром темно-синій та деякі інші. Їхній колір різко відрізняється від кольору розчину самого індикатора. Поблизу точки еквівалентності, коли майже всі катіони, що визначаються, зв’язуються з комлексонами в комплекс, тобто концентрація іонів, що визначаються, різко зменшується, забарвлення розчину змінюється.
Методично комлексонометричні визначення можна проводити прямим або зворотнім титруванням. При прямому визначенні титрування проводять за певного значення рН стандартним (робочим) розчином ЕДТА. Точку еквівалентності встановлюють за допомогою металоіндикаторів, де початковий колір комплексної сполуки, яка утворена індикатором з катіоном, що визначається, зникає і з’являється забарвлення, яке властиве вільному індикатору. При зворотному титруванні до аналізованого розчину додають виміряний об’єм стандартного розчину ЕДТА, надлишок якого відтитровують стандартним розчином солі цинку. Користуючись
методами комплексоутворення можна кількісно визначати катіони (Ag+, Нg2+, АІ3+ та ін.) та аніони (CN-, F-, Сl- та ін.), які здатні всту-
пати в реакцію комплексоутворення.
23
1.2. ЕЛЕКТРОХІМІЧНІ МЕТОДИ АНАЛІЗУ
Електрохімічні методи аналізу (ЕХМА) – група методів кількісного хімічного аналізу, в основі яких лежать електрохімічні процеси. Для них характерні висока чутливість і селективність, швидкість відгуку на зміну складу аналізованого об’єкта, легкість автоматизації та можливість дистанційного управління. І, нарешті, вони не вимагають дорогого аналітичного устаткування і можуть застосовуватися в лабораторних і виробничих умовах.
Електрохімічні методи аналізу засновані на дослідженні процесів, що протікають на поверхні електрода або в навколоелектродному просторі. Аналітичним сигналом служить електрич-ний параметр (електричний потенціал, сила струму, опір та ін.), який піддається вимірюванню. За вимірюваним електричним параметром системи, ЕХМА поділяють на потенціометрію (вимірюють Е, В при І = 0 А), вольтамперометрію (вимірюють І, А як функцію від накладеного ззовні Е, В), кулонометрію (вимірюють Q, Кл при І = const або Е = const), кондуктометрію (вимірюють W, См або Ом-1).
Деякі електрохімічні методи використовуються для визначення кінцевої точки титрування (амперметричне титрування, кондуктометричне титрування, кулонометричне титрування).
1.2.1. Вольтамперометрія
Вольтамперометрія – це електрохімічний метод якісного та кількісного аналізу, який ґрунтується на реєстрації вольт-амперних кривих (вольтамперограм) – залежності між силою електричного струму І у ланцюзі і напругою Е при електролізі розчину досліджуваної речовини. У розчин занурюють індикаторний мікроелектрод, на якому досліджувана електрохімічно активна (електроак-
тивна) речовина – |
деполяризатор відновлюється чи окиснюється, |
і неполяризований |
допоміжний електрод порівняння, потенціал |
якого залишається практично незмінним при електролізі.
Залежно від типу індикаторного електрода розрізняють полярографію (ртутний капаючий мікроелектрод, а спеціальний прилад
– полярограф) та вольтамперометрію (будь-який мікроелектрод,
крім капаючого ртутного). Вольтамперометричні методи, залежно від способу проведення аналізу, поділяють на прямі та непрямі (амперметричне титрування). Зміна електричного потенціалу мікро-
24
електрода під дією прикладеної напруги спричиняє виникнення струму у ланцюзі. Вольтамперометрію застосовують: для кількісного аналізу неорганічних і органічних речовин у дуже широкому інтервалі – від 10-10 до десятків %.
З метою зменшення електричного опору розчину до нього додають надлишок індиферентного електроліту (фонового), іони якого не відновлюються і не окиснюються в умовах електролізу. Фоновий електроліт також дозволяє усунути міграційний струм, який виникає за рахунок міграції частинок деполяризатора під дією електричного поля.
1.2.2. Кондуктометрія
Кондуктометричні методи аналізу засновані на вимірюванні електропровідності досліджуваних розчинів і застосовуються для визначення концентрації солей, кислот, лугів і т. д. Електропровідність – здатність речовини проводити електричний струм. Обернена їй величина називається електричним опором. Електропровідність (іонна провідність) розчину (W) обернена величині опору (R):
W=1/R.
Одиниця виміру електропровідності – сіменс (См) або Ом-1. Більшість рідин не мають вільних носіїв заряду і є діелектрик-
ками. Виняток становлять електроліти, наприклад вода чи розчини солей у воді. В електролітах частина нейтральних молекул дисоціює, утворюючи негативно та позитивно заряджені іони. Електропровідність електролітів зумовлена рухом цих іонів до аноду і катоду, відповідно. Електропровідність електроліта є адитивною величиною, тобто визначається властивостями всіх іонів, які присутні в розчині. Електропровідність залежить від кількості носіїв заряду в одиниці об’єму розчину (концентрації), їх складу та рухомості. Отже, електропровідність розчину є показником концентрації розчиненої речовини, а вимірювання електропровідності розчинів може бути використане для кількісного визначення хімічного складу розчину (кондуктометрія).
В аналітичній хімії користуються питомою електропровідністю (χ) – здатністю розчину електроліту проводити електричний струм – величина, яка обернена питомому опору розчину (ρ).
25
χ= 1/ρ.
УМіжнародній системі одиниць СІ питома електропровідність вимірюється в сименсах на метр (См·м−1) чи в Ом−1·м−1.
Величина питомої електропровідності електроліту залежить від ряду факторів: природи електроліту, температури, концентрації розчину.
Для виключення впливу концентрації на величину електропровідності введено поняття молярної електропровідності:
Λ = χ/C.
Молярна електропровідність (Λ) – це електропровідність молярного розчину вміщеного між двома електродами площею 1 м2, які знаходяться на відстані 1 м один від одного. Одиницею виміру Λ в системі одиниць СІ є Ом–1.м2·моль–1. Якщо кількість речовини виражають в моль-екв, то величину Λ називають еквівалентною електропровідністю і виражають в Ом–1·м2·моль-екв–1. Молярна електропровідність збільшується зі зменшенням концентрації електроліту і, за нескінченного розбавлення, коли взаємний вплив іонів майже відсутній, вона досягає максимального (граничного) значення:
Λ = Λ0 + B·√C ,
де Λ0 – гранична молярна електропровідність, Ом–1·м2·моль–1; B – емпіричний коефіцієнт.
Увага! При розрахунках в кондуктометрії поряд з одиницями СІ застосовують позасистемні одиниці виміру: відстань між електродами вимірюють в см, еквівалентну електропровідність – в Ом-1·см2·моль-1 тощо. Тому, під час розв’язування задач, слід ретельно слідкувати за розмірностями всіх величин і за необхідності вводити в розрахункові формули відповідні коефіцієнти.
Залежність електропровідності розчинів електролітів від концентрації та природи заряджених частинок, що їх складають покладено в основу кондуктометричних методів аналізу.
Пряма кондуктометрія – метод, що дозволяє безпосередньо визначати концентрацію електроліту шляхом вимірювання електропровідності розчину з відомим якісним складом.
26
Враховуючи лінійний характер залежності питомої електропровідності розчинів від концентрації електролітів для практичного використання рекомендується цілий ряд експрес методів, заснованих на даному електрохімічному ефекті. Наприклад, на основі кондуктометрії розроблена методика визначення масової частки кухонної солі в сичужним сирі. При цьому в якості аналізованого об’єкта використовувалася водна витяжка сичужного сиру.
Кондуктометричне титрування – метод аналізу, заснований на визначенні вмісту речовини в процесі титрування аналізованого розчину порціями відомого реагенту до перегину кривої титрування. Криву будують за вимірюваннями питомої електропровідності аналізованого розчину, яка змінюється в результаті хімічних реакцій в процесі титрування.
Точність кондуктометричного титрування становить 1 %, але якщо вжити заходів щодо термостатування аналізованого розчину, то точність визначення можна в кілька разів збільшити. Точка еквівалентності на графіку обумовлюється перетином двох прямих. Одна пряма (до точки еквівалентності) відображає зміну концентрації аналізованого іона та іонів титранту, а інша (після точки еквівалентності) є наслідком збільшення концентрації іонів титранту.
Хронокондуктометричне титрування – засноване на визна-
ченні вмісту речовини за витраченим на титрування часу, яке автоматично фіксується на діаграмній стрічці реєстратора кривої титрування.
Прилад, який використовується для вимірювання електропровідності електролітів (розчинів, колоїдних систем, розплавів), нази-
вається кондуктометр (рис. 1.3).
27
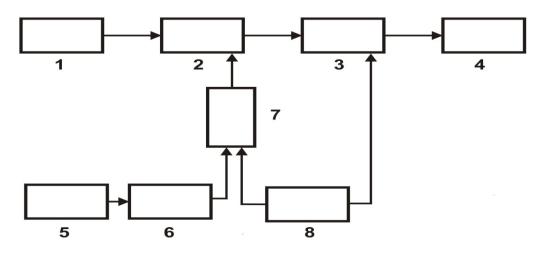
Рис. 1.3. Блок-схема кондуктометра АК-215: 1 – датчик електропровідності; 2 – перетворювач; 3 – синхронний детектор; 4 – нормуючий перетворювач 0–5 мА; 5 – датчик температур; 6 – нормуючий посилювач; 7 – електронний комутатор; 8 – генератор
Особливості кондуктометричних методів аналізу:
1.Можливість проводити визначення не тільки у прозорих, але і в забарвлених і каламутних розчинах, а також у присутності окислювачів, відновників органічних речовин.
2.Висока чутливість методу, що дозволяє працювати з розведеними розчинами.
3.Аналіз водних та органічних розчинів.
4.Можливість автоматизації процесу (хронокондуктометрія).
5.У багатьох випадках відсутність необхідності проводити
попередню пробопідготовки.
6.Простота визначення кінцевої точки титрування.
7.Можливість проведення диференційованого титрування сумішей електролітів, що неможливо при титруванні з візуальною
індикацією кінцевої точки титрування.
1.2.3. Потенціометрія
Потенціометричний метод – базується на залежності рівновісного потенціалу електрода від активності (концентрації) досліджуваного іона. Для реєстрації потенціалу необхідно скласти гальванічний елемент (ГЕ) з індикаторного електрода та електрода порівняння (потенціал якого не залежить від складу досліджуваного розчину) (рис. 1.4).
28
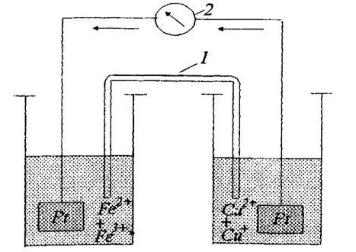
Рис. 1.4. Схема гальванічного елементу: 1 – соляний місток; 2 – мілівольтметр
Електрорушійна сила (ЕРС) гальванічного елемента визначається рівнянням:
ЕРС = Ek – Ea,
де Еk – потенціал катода (позитивний електрод ГЕ, на якому відбуваються процеси відновлення);
Еа – потенціал анода (негативний електрод ГЕ, на якому відбуваються процеси окиснення).
Схематично ГЕ, як і будь-яку електрохімічну комірку, записують наступним чином:
A| розчинА || розчин К | К,
де А та К – матеріал, з якого виготовлено анод та катод, відповідно; розчин А – склад розчину, в який занурено відповідний електрод; знак || застосовують якщо катодний і анодний простори розділені повністю (дифузійний потенціал елімінований за допомогою сольового містка), знак | застосовують у випадку розділення катодного і анодного просторів напівпроникною мембраною.
Виміряти потенціал одного електрода не можливо, але можна виміряти різницю потенціалів індикаторного електроду та електроду порівняння – ЕРС редокс-пари.
При постійній величині потенціалу одного електроду за значенням електрорушійної сили можна визначити потенціал другого електроду редокс-пари. Електрод, потенціал якого порівнюється з
29

другим електродом у гальванічному елементі і умовно приймається рівним нулю називається електрод порівняння (стандартний електрод). У якості електродів порівняння використовують кало - мельні та хлорсрібні електроди.
Каломельний електрод складається з металевої ртуті і розчину калію хлориду, насиченому відносно ртуті хлористої (каломелі).
Хлорсрібний електрод складається із срібного дроту, покритого рівномірним шаром срібла хлориду в розчині, що містить калію хлорид до насичення. Потенціал цих електродів характеризується стійкістю під час проведення потенціометричного вимірювання, а зміна електрорушійної сили електродної пари буде залежати від потенціалу другого електроду пари.
Індикаторний електрод – це електрод, потенціал якого змінюється в залежності від концентрації іонів. Електроди поділяються наступним чином:
 електроди на основі рідких катіонів, наприклад, калій-, нат- рій-, кальцій-селективні електроди;
електроди на основі рідких катіонів, наприклад, калій-, нат- рій-, кальцій-селективні електроди;
 електроди на основі рідких аніонів, наприклад, нітрат-, фос- фат-, карбонат-селективні електроди;
електроди на основі рідких аніонів, наприклад, нітрат-, фос- фат-, карбонат-селективні електроди;
 електроди з твердими мембранами, наприклад, фторидів лантану, берилію, бору, сульфідота галогенідо-селективні електроди;
електроди з твердими мембранами, наприклад, фторидів лантану, берилію, бору, сульфідота галогенідо-селективні електроди;
скляні електроди; газові електроди, що містять мембрану, яка проникна для
газів, наприклад, О2, СО2, Н2S; ензимні (ферментні); напівпровідникові.
Взагалі для кожної реакції, як правило підбирається відповідний індикаторний електрод. Цей вибір залежить від типу реакції, інтервалу змін рН, часу вимірювання тощо, наприклад: хінгідриновий, скляний – для реакцій нейтралізації; срібний і ртутний – для реакцій осадження і комплексоутворення; індиферентні метали (платина, паладій, золото) – для окисно-відновного титрування.
Рівновісний потенціал індикаторного електроду зв’язаний з активністю (у наближені концентрації) іонів, які приймають участь в електродному процесі за рівнянням Нернста:
Е = Е° + R·T/(n·F) ln (аокис/авіднов),
де R – універсальна газова стала (8,31 Дж/(моль.К);
30
