
- •1. Предмет и задачи биохимии. Теоретическая и практическая значимость биохимии, связь с другими естественными науками. Объекты исследования
- •2. Аминокислоты, их классификация. Химическая структура и физико-химические свойства аминокислот.
- •3. Заменимые и незаменимые аминокислоты. Реакционная способность аминокислот. Характеристика пептидной связи.
- •4. Белки, их распространение в природе, разнообразие, биологическая роль. Физико-химические свойства белков. Денатурация и ренатурация белков.
- •5. Методы очистки и идентификации белков.
- •6. Принципы структурно-функциональной организации белков. Методы изучения структуры белков.
- •7. Первичная структура белков. Гидролиз белков, определение аминокислотного состава. Анализ n- и с-концевых аминокислот.
- •8. Вторичная структура белков: элементы вторичной структуры. Строение и функциональная роль доменов.
- •9. Третичная структура. Фолдинг белков. Шапероны. Глобулярные и фибриллярные белки.
- •10. Четвертичная структура белков. Надмолекулярные белковые комплексы. Характеристика связей, стабилизирующих структуру белков.
- •11. Классификация белков. Простые и сложные белки. Строение, свойства и биологическая роль сложных белков.
- •12. Особенности биокаталитических процессов. Сходство и различие химических и биологических катализаторов. Принципы структурной организации ферментов. Активные и регуляторные центры.
- •13. Роль коферментов и простетических групп в биокатализе. Коферментные формы витаминов. Участие металлов в ферментативных процессах.
- •14. Механизм действия ферментов. Кинетика ферментативных реакций. Кинетические параметры ферментативных реакций. Единицы ферментативной активности.
- •15. Зависимость скорости ферментативных реакций от концентрации субстрата, фермента, рН и температуры. Активация и ингибирование ферментов.
- •16. Изоферменты и множественные формы ферментов. Принципы регуляции ферментативных реакций.
- •17. Классификация и номенклатура ферментов. Использование ферментов в медицине, промышленности и сельском хозяйстве. Инженерная энзимология.
- •18. Нуклеиновые кислоты, их виды, распространение и локализация в биообъектах, химический состав, физико-химические свойства, биологическая роль.
- •19. Химический состав нуклеиновых кислот. Правила Чаргаффа. Химическое строение, функции и использование природных и синтетических нуклеозидов и нуклеотидов.
- •20. Структурная организация олигонуклеотидов, полинуклеотидов (нуклеиновых кислот). Характеристика первичной структуры днк.
- •21. Вторичная структура днк, формы двойной спирали. Связи, стабилизирующие структуру днк. Принцип комплементарности. Третичная структура днк.
- •22. Структура, свойства и функции матричных, рибосомальных и транспортных рнк.
- •23. Классификация и номенклатура углеводов. Биологическая роль и распространение в природе. Практическая значимость моносахаридов и их производных.
- •24. Особенности строения, изомерии, конформации и биохимических свойств моносахаридов.
- •25. Производные моносахаридов: кислоты, гликозиды, аминосахара, фосфосахара.
- •26. Олигосахариды. Строение, свойства и биологическая роль основных природных дисахаридов.
- •27. Полисахариды: гомо- и гетерогликаны. Строение, свойства и значение крахмала, гликогена, целлюлозы, хитина. Гетерогликаны. Классификация, распространение и биологическая роль.
- •28. Протеогликаны. Гликозаминогликаны. Практическое использование олиго- и полисахаридов.
- •29. Строение, физико-химические свойства и биологическая роль липидов. Классификация и номенклатура жирных кислот.
- •30. Строение и физико-химические свойства природных жирных кислот (насыщенных; моно- и полиеновых).
- •31. Простые липиды, их строение, свойства, биологическое значение.
- •32. Фосфолипиды: особенности строения и свойств глицерофосфолипидов и сфингомиелинов.
- •33. Строение и свойства гликолипидов.
- •34. Стероиды: структура, свойства важнейших представителей.
- •35. Общая характеристика витаминов, их классификация, биологическая роль. Провитамины. Антивитамины.
- •36. Структура, свойства, роль в обмене веществ и использование отдельных жирорастворимых витаминов.
- •38. Превращение и всасывание углеводов в пищеварительном тракте. Принципы метаболизма олиго- и полисахаридов. Синтез и распад гликогена.
- •39. Анаэробный распад глюкозы, последовательность реакций, энергетический баланс. Гликогенолиз.
- •40. Глюконеогенез. Особенности метаболизма фруктозы и галактозы.
- •41. Окислительное декарбоксилирование пирувата. Цикл трикарбоновых кислот. Энергетический баланс окислительного расщепления пирувата.
- •43. Пентозофосфатный путь обмена углеводов, его окислительные и неокислительные звенья, биологическая роль.
- •44. Субстратное фосфорилирование.
- •45. Путь Энтнера-Дудорова. Глиоксилатный цикл.
- •46. Расщепление и всасывание липидов в желудочно-кишечном тракте. Роль желчи. Транспорт жирных кислот в крови и лимфе, трансмембранный перенос.
- •47. Пути окисления жирных кислот. Β-окисление жирных кислот: механизм, пластическая и энергетическая роль.
- •48. Окисление непредельных жирных кислот и жирных кислот с нечетным числом атомов углерода.
- •49. Синтез жирных кислот. Синтетаза жирных кислот.
- •50. Биосинтез триглицеридов и фосфолипидов.
- •51. Образование и метаболизм кетоновых тел.
- •52. Общая характеристика обмена холестерина: биосинтез холестерина, пути его превращений.
- •53. Расщепление нуклеиновых кислот, нуклеотидов и нуклеозидов.
- •54. Образование и распад пуриновых оснований.
- •55. Образование и распад пиримидиновых оснований.
- •56. Репликация днк: биохимия процесса и биологическая роль.
- •57. Транскрипция: биохимия процесса и биологическая роль.
- •58. Расщепление белков в пищеварительном тракте и тканях. Всасывание аминокислот. Протеиназы. Тотальный и ограниченный протеолиз, их значение.
- •59. Азотистый баланс. Типы азотистого обмена.
- •60. Общие пути распада аминокислот. Виды дезаминирования.
- •61. Переаминирование и декарбоксилирование аминокислот, их механизм и биологическая роль.
- •62. Пути нейтрализации аммиака. Орнитиновый цикл.
- •63. Трансляция. Локализация процесса, стадии, необходимые условия. Активация аминокислот.
- •64. Инициация синтеза полипептидной цепи. Сущность и локализация процесса, условия.
- •65. Элонгация синтеза полипептидной цепи. Сущность и локализация процесса, условия.
- •66. Терминация синтеза полипептидной цепи. Сущность и локализация процесса, условия. Постсинтетическая модификация белков.
- •67. Энергетический обмен. Основные понятия биохимической термодинамики. Макроэргические соединения.
- •68. Принципы структурно-функциональной организации электрон-транспортной (дыхательной) цепи митохондрий.
- •69. Сопряжение окисления и фосфорилирования в дыхательной цепи. Трансмембранный потенциал протонов и работа атф-синтетазы.
- •70. Классификация реакций биологического окисления. Пути потребления кислорода в ферментативных реакциях.
- •71. Микросомальное, свободнорадикальное окисление.
- •72. Активные формы кислорода. Перекисное окисление липидов. Их биологическая роль. Антиоксидантная система организма.
- •73. Уровни регуляции метаболизма. Гуморальная регуляция. Общие представления о гормонах, их классификация.
- •74. Гормоны гипоталамуса и гипофиза. Строение, пути образования, биологическая роль.
- •75. Гормоны щитовидной и паращитовидных желез. Химическая природа, образование, биологическая роль.
- •76. Инсулин и глюкагон. Место биосинтеза, химическая природа, биологическая роль.
- •77. Гормоны коркового слоя надпочечников. Химическая природа, образование, биологическая роль.
- •78. Гормоны мозгового слоя надпочечников. Химическая природа, образование, биологическая роль.
- •79. Женские половые гормоны. Химическая природа, образование, биологическая роль. Особенности синтеза.
- •80. Мужские половые гормоны. Химическая природа, образование, биологическая роль.
- •81. Эйкозаноиды. Строение, образование, биологическая роль.
- •82. Механизмы биологического действия гормонов. Рецепторы, внутриклеточные посредники.
- •83. Внутриклеточная топография биохимических процессов. Понятие о компартментализации, ее роль в регуляции внутриклеточного метаболизма.
- •85. Общая характеристика, строение и функции биологических мембран.
- •86. Способы трансмембранного транспорта.
- •87. Обмен фенилаланина и тирозина.
- •88. Обмен глицина.
- •89. Реакции обмена серосодержащих аминокислот.
- •90. Роль воды в организме. Экзогенная и эндогенная вода. Водный баланс организма. Биохимические механизмы регуляции водного баланса.
- •91. Биологическое значение минеральных элементов для организма человека. Минеральный обмен и его регуляция.
62. Пути нейтрализации аммиака. Орнитиновый цикл.
В клетках происходитит связывание аммиака с образазованием нетоксичных соединений, кот-ые выводятся из организма с мочой (р-ции обезвреживания аммиака.). В разных тканях и органах обнаружено несколько типов таких р-ций.
1.Р-циея
связывания аммиака, протекающей во всех
тканях: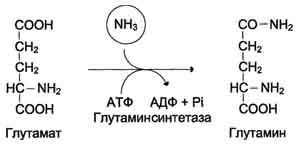 Глутамин
легко транспортируется через клеточные
мембраны путём облегчённой диффузии
и поступает из тканей в кровь, затем в
кишечник и почки. Основными
тканями-поставщикам глутамина служат
мышцы, мозг и печень.
Глутамин
легко транспортируется через клеточные
мембраны путём облегчённой диффузии
и поступает из тканей в кровь, затем в
кишечник и почки. Основными
тканями-поставщикам глутамина служат
мышцы, мозг и печень.
2. В клетках кишечника под действием фермента глутаминазы происходит гидролитическое освобождение амидного азота в виде аммиака
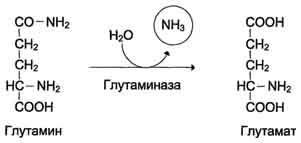
3.В почках также проис-ит гидролиз глутамина под дейс-ем глутаминазы с образ-ем аммиака. Глутаминаза почек значительно индуцируется при ацидозе, образ-щийся аммиак нейтрализует кислые продукты обмена и в виде аммонийных солей экскретируется .Эта р-ция защищает организм от излишней потери ионов Na+ и К+, которые также могут использоватся для выведения анионов и утрачиваются.
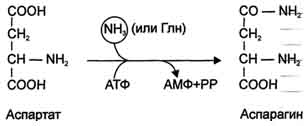
4. синтез аспарагина под действием аспарагинсинтетазы
5. Наиболее знач-ые кол-ва аммиака обезвреживается в печени путём синтеза мочевины.
Орнитиновый цикл(ОЦ)
ОЦ в печени выполняет 2 функции:
-превращение азота аминокислот в мочевину, которая экскретируется и предотвращает накопление токсичных продуктов( аммиака);
-синтез аргинина
Мочевина – осн-ой конечный продукт азотистого обмена, в составе кот-го из орг-зма выд-ся до 90% всего выводимого азота. Экскреция мочевины в норме сост-ет ∼25 г/сут.
Реакции синтеза мочевин:
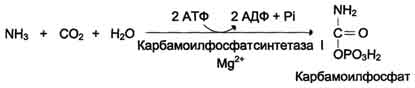
Связывание аммиака в печени с диоксидом углерода с образ-ем карбамоилфосфата под дейст-ем карбамоилфосфатсинтетазы I
2. Под действием орнитинкарбамоилтрансферазы карбамоильная группа карбамоилфосфата переносится на α-аминокислоту орнитин, и образуется другая α-аминокислота – цитруллин
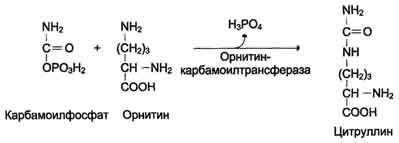
3. связывание цитруллин с аспартатом и образ-ие аргининосукцинат (аргининоянтарную к-ту)
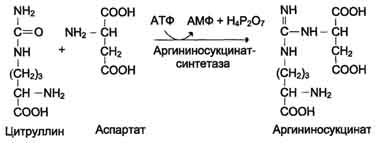
4. Далее фермент аргининосукцинатлиаза (аргининосукциназа) расщепляет аргининосукцинат на аргинин и фумарат
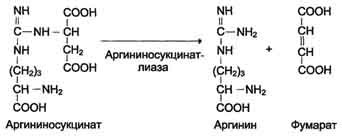
5. Аргинин подвергается гидролизу под действием аргиназы, при этом образуется орнитин и мочевина. Кофакторами аргиназы является ионы Са2+ или Мn2
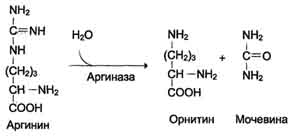
6. орнитин взаимодействует с новой молекулой карбамоилфосфата, и цикл замкнулся.
Суммарное уравнение синтеза мочевины:
СО2 + NH3 + Аспартат + 3 АТФ + 2 Н2О → Мочевина + Фумарат + 2 (АДФ + Н3Р04) + АМФ + H4P2O7.
63. Трансляция. Локализация процесса, стадии, необходимые условия. Активация аминокислот.
Трансляция - перевод генетического текста иРНК в последовательность АК в белке. Этапы трансляции:
1. Активация аминок-т;
2. инициация «начало»;
3. эллонгация «удлинение»;
4. терминация «прекращение»;
5. процессинг «созревание» и форм третичной структуры.
Место синтеза белка-рибосомы: прокариот:днк- 10^4, РНК-65%; эукариот – ДНК-10^5, РНК-50%. Прокариоты 70S→(Mg) 1) 50S:5S РНК, 28S РНК, 34S белка; 2) 30S: 15 РНК и 21 белок. Для каждой своя аминок-та: для серина, лейцина, аргенина-по 6Т-рнк, для аланина, треонина-по 4 Т-РНК. Т-рнк выполняет ф-цию адаптеров. Они акцепторным концом взаимодействуют с аминокислотами, а антикодоном - с кодоном мРНК. Аминоацил-тРНК синтетазы- катализирует р-цию специф связывания одной из 20 аминок-т с соответствующей тРНК. Ионы магния- Кофактор, стабилизир структуру рибосом. Белковые факторы инициации, элонгации, терминации-необхдля процесса трансляции (12 ф-ров инициации: elF; 2 ф-ра элонгации: eEFl, eEF2, и ф-ры терминации: eRF). Три последовательные химические р-ции приводят к включению аминок-ты в полипептидную цепь строящегося белка: 1 р-ция - активация аминок-ты за счет образ ангидридной связи между ее карбоксилом и фосфатом адениловой к-ты - и 2 р-ция - акцептирование аминоацильного остатка молекулой тРНК с образ сложноэфирной связи между карбоксилом аминок-ты и гидроксилом концевого рибозного остатка тРНК - происх внерибосомы, и обе р-ции катализируется ферментом аминоацил-тРНК-синтетазой. Синтез начинается с метионина у эукариот и формилметионина- у прокариот.
