
- •Неорганическая химия теория
- •1. Основные понятия химии: атом, хим. Элемент, молекула, эквивалент, молярная масса эквивалента, относительная атомная масса, моль, молярная масса.
- •2, Основные стехиометрические законы: закон сохранения массы и энергии, закон постоянства состава, закон кратных отношений, закон эквивалентов.
- •3. Основные газовые законы: закон объемных отношений, закон Гей-Люссака, объединенный газовый закон, уравнение Менделеева-Клапейрона.
- •4. Основные классы и номенклатура неорганических веществ: оксиды (солеобразующие и несолеобразующие, основные, кислотные, амфотерные), гидроксиды.
- •5. Основные классы и номенклатура неорганических веществ: кислоты и соли.
- •6. Диссоциация воды, константа диссоциации, pH, ионное произведение воды.
- •7. Развитие учения о строении атома (Модель Томсона, опыты Резерфорда, постулаты Бора), квантово- механическая теория.
- •8. Характеристика основных квантовых чисел: n, m, l, s; строение электронных оболочек атомов.
- •9. Периодическая система элементов, как форма отражения периодического закона.
- •10. Ковалентная химическая связь, способы образования ковалентной связи.
- •11. Геометрия структур с ковалентным типом связей (sp1-, sp2-, sp3- гибридизация).
- •12. Ионная и металлическая связь.
- •13. Водородная связь. Межмолекулярные взаимодействия (Ориентационное взаимодействие, индукционное взаимодействие, дисперсионное взаимодействие).
- •14. Метод валентных связей и метод молекулярных орбиталей.
- •15. Кристаллическое состояние веществ атомные и молекулярные кристаллические решетки. Примеры.
- •16. Химические реакции, скорость химических реакций.
- •17. Влияние температуры на скорость химической реакции, правило Вант-Гоффа.
- •18. Катализ, влияние катализатора на скорость химической реакции.
- •19. Химическое равновесие, принцип Ле-Шателье.
- •20. Внутренняя энергия, энтальпия, энтропия.
- •21. Законы Генри, законы Рауля, закон Дальтона.
- •22. Осмотическое давление, закон Вант-Гоффа.
- •23. Особенности растворов электролитов. Основные положения теории электролитической диссоциации.
- •24. Произведение растворимости, реакция обмена в растворах электролитов.
- •25. Теория овр, важнейшие окислители и восстановители, метод электронного баланса, метод полуреакции.
- •26. Электролиз. Электродный потенциал, водородный электрод.
- •27. Гидролиз солей. Количественные характеристики гидролиза.
- •28. Гальванический элемент и его э. Д. С. Влияние условий на протекание овр.
- •29. Номенклатура и классификация комплексных соединений.
- •30. Характеристика комплексных соединений, константа стойкости и константа неустойчивости.
- •31. Общая характеристика водорода. Физические и химические свойства. Окислительно-восстановительные свойства пероксида водорода.
- •32. Галогены, общая характеристика, свойства простых веществ.
- •33. Галогеноводороды, плавиковая и соляная кислоты.
- •34. Кислородсодержащие соединения галогенов. Оксиды и фторид оксигена.
- •35. Кислородсодержащие соединения галогенов. Гидроксиды и соли.
- •36. Общая характеристика халькогенов. Свойства простых веществ.
- •37. Гидриды халькогенов. Биологическое действие халькогеноводородов.
- •38. Оксиды халькогенов, диоксиды и триоксиды.
- •39. Сернистая, селенистая и теллуристая кислоты.
- •40. Серная, селеновая и теллуровые кислоты.
- •41. Промышленные способы получения серной кислоты.
- •42. Общая характеристика элементов vа группы. Соединения азота, фосфора, сурьмы и висмута в природе.
- •43. Химические свойства элементов vа группы, взаимодействие с простыми веществами. Взаимодействие с водой кислотами и щелочами.
- •44. Оксиды азота (n2o, no, n2o3, n2o5).
- •45. Азотистая кислота и ее соли.
- •46. Бинарные соединения элементов vа группы. Соединения с водородом.
- •47. Гидразин и гидроксиламин. Окислительно -восстановительные свойства.
- •48. Аммиак его получение и свойства. Соли аммония. Нашатырь.
- •49. Азотная кислота. Физические и химические свойства концентрированной и разбавленной азотной кислоты.
- •50. Промышленные способы получения азотной кислоты. Нитраты, разложение нитратов.
- •51. Кислородсодержащие соединения фосфора. Оксиды фосфора (lll и V).
- •52. Кислородсодержащие соединения мышьяка, сурьмы и висмута (lll и V).
- •53. Фосфорная, фосфористая и фосфорноватистые кислоты.
- •54. Гидролиз фосфатов. Показатель кислотности среды.
- •55. Гидроксиды мышьяка, сурьмы и висмута.
- •56. Общая характеристика элементов четвертой а группы. Аллотропные модификации углерода. Строение и свойства кремния.
- •57. Германий, олово, свинец, химические свойства.
- •58. Углерод и кремний, химические свойства.
- •59. Гидриды элементов четвертой а группы. Оксиды углерода.
- •60. Угольная кислота и ее соли. Жесткость воды и способы ее устранения. Карбонатное равновесие в природе.
- •61. Кислородсодержащие соединения кремния. Диоксид кремния.
- •62. Щелочные металлы. Общая характеристика оксидов, гидроксидов и солей. Калийные удобрения.
- •63. Щелочноземельные металлы. Общая характеристика оксидов, гидроксидов и солей. Известь и ее применение.
- •64. Характеристика vib подгруппы. Химические и физические свойства простых веществ. Способы получения хрома, молибдена и вольфрама.
- •65. Соединения трехвалентного хрома. Оксиды и гидроксиды. Применение.
- •66. Соединения шестивалентного хрома. Оксиды и гидроксиды. Применение.
- •67. Подгруппа марганца. Физические и химические свойства простых веществ.
- •68. Окислительно-восстановительные свойства соединений марганца.
67. Подгруппа марганца. Физические и химические свойства простых веществ.
Ответ. Для элементов VIIВ группы, как и для элементов других В групп, при переходе от Mn к Re увеличивается устойчивость соединений с высшей степенью окисления элементов и усиливается тенденция к образованию кислотных оксидов и кислот. Физические свойства. Марганец, технеций, рений – серебристо-белые твёрдые тугоплавкие металлы. Рений по тугоплавкости уступает только вольфраму. Получаемый обычными способами марганец хрупок. Однако очень чистый марганец можно прокатывать и штамповать. Возрастание температур плавления и температур кипения в ряду Mn–Tc–Re объясняется, вероятно, усилением доли ковалентной связи, образованной за счёт (n–1)d-орбиталей. Химические свойства. Химическая активность простых веществ в ряду Mn–Tc–Re понижается. Так, в ряду напряжений Mn располагается до водорода, а Tc и Re – после него (положительные значения стандартного электродного потенциала). Марганец сохраняет устойчивость при нагревании на воздухе благодаря образованию защитной плёнки Mn 2O3. При нагревании же технеция и рения в присутствии кислорода образуются летучие оксиды Tc2O7 и Re2O7, которые не защищают металл от дальнейшего окисления. С водой в интервале 0–100 °С эти металлы практически не реагируют. Марганец медленно реагирует с растворами кислот с выделением водорода и образованием соли Mn +2: Mn + 2HCl = MnCl2 + H2. Технеций и рений не восстанавливают ионы водорода из растворов кислот, так как имеют положительное значение стандартного окислительно-восстановительного потенциала. Технеций и рений можно перевести в раствор с помощью азотной кислоты: 3Э + 7HNO3 = 3HЭO4 + 7NO + 2H2O. Марганец более активно восстанавливает центральные атомы кислот-окислителей. При нагревании Mn, Тc и Re энергично взаимодействуют с галогенами, причём с фтором и хлором марганец образует MnF 3 и MnF4, MnCl2, а рений даёт ReF6 и ReCl 5.
68. Окислительно-восстановительные свойства соединений марганца.
Ответ.
Оксид марганца (IV) MnO2 — вещество черного
цвета. При обычных условиях это наиболее
устойчивый из всех оксидов. Является
сильным окислителем:
![]()
Оксид марганца (IV) — амфотерный оксид, однако и кислотные, и основные свойства у него выражены очень слабо. Соли марганца (IV) непрочные и проявляют окислительные свойства. Перманганат калия — наиболее известная соль марганцовой кислоты. Это кристаллическое вещество темно-фиолетового цвета, известное в быту как марганцовка. Эта соль применяется в лабораторном практикуме, промышленности, медицине и быту. Перманганат калия очень сильный окислитель и в зависимости от среды восстанавливается до соединений с разными степенями окисления
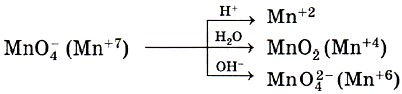
Я всё, смотрите Жерносекова.
Счастья.
Здоровья.
С Новым Годом.
