
- •Неорганическая химия теория
- •1. Основные понятия химии: атом, хим. Элемент, молекула, эквивалент, молярная масса эквивалента, относительная атомная масса, моль, молярная масса.
- •2, Основные стехиометрические законы: закон сохранения массы и энергии, закон постоянства состава, закон кратных отношений, закон эквивалентов.
- •3. Основные газовые законы: закон объемных отношений, закон Гей-Люссака, объединенный газовый закон, уравнение Менделеева-Клапейрона.
- •4. Основные классы и номенклатура неорганических веществ: оксиды (солеобразующие и несолеобразующие, основные, кислотные, амфотерные), гидроксиды.
- •5. Основные классы и номенклатура неорганических веществ: кислоты и соли.
- •6. Диссоциация воды, константа диссоциации, pH, ионное произведение воды.
- •7. Развитие учения о строении атома (Модель Томсона, опыты Резерфорда, постулаты Бора), квантово- механическая теория.
- •8. Характеристика основных квантовых чисел: n, m, l, s; строение электронных оболочек атомов.
- •9. Периодическая система элементов, как форма отражения периодического закона.
- •10. Ковалентная химическая связь, способы образования ковалентной связи.
- •11. Геометрия структур с ковалентным типом связей (sp1-, sp2-, sp3- гибридизация).
- •12. Ионная и металлическая связь.
- •13. Водородная связь. Межмолекулярные взаимодействия (Ориентационное взаимодействие, индукционное взаимодействие, дисперсионное взаимодействие).
- •14. Метод валентных связей и метод молекулярных орбиталей.
- •15. Кристаллическое состояние веществ атомные и молекулярные кристаллические решетки. Примеры.
- •16. Химические реакции, скорость химических реакций.
- •17. Влияние температуры на скорость химической реакции, правило Вант-Гоффа.
- •18. Катализ, влияние катализатора на скорость химической реакции.
- •19. Химическое равновесие, принцип Ле-Шателье.
- •20. Внутренняя энергия, энтальпия, энтропия.
- •21. Законы Генри, законы Рауля, закон Дальтона.
- •22. Осмотическое давление, закон Вант-Гоффа.
- •23. Особенности растворов электролитов. Основные положения теории электролитической диссоциации.
- •24. Произведение растворимости, реакция обмена в растворах электролитов.
- •25. Теория овр, важнейшие окислители и восстановители, метод электронного баланса, метод полуреакции.
- •26. Электролиз. Электродный потенциал, водородный электрод.
- •27. Гидролиз солей. Количественные характеристики гидролиза.
- •28. Гальванический элемент и его э. Д. С. Влияние условий на протекание овр.
- •29. Номенклатура и классификация комплексных соединений.
- •30. Характеристика комплексных соединений, константа стойкости и константа неустойчивости.
- •31. Общая характеристика водорода. Физические и химические свойства. Окислительно-восстановительные свойства пероксида водорода.
- •32. Галогены, общая характеристика, свойства простых веществ.
- •33. Галогеноводороды, плавиковая и соляная кислоты.
- •34. Кислородсодержащие соединения галогенов. Оксиды и фторид оксигена.
- •35. Кислородсодержащие соединения галогенов. Гидроксиды и соли.
- •36. Общая характеристика халькогенов. Свойства простых веществ.
- •37. Гидриды халькогенов. Биологическое действие халькогеноводородов.
- •38. Оксиды халькогенов, диоксиды и триоксиды.
- •39. Сернистая, селенистая и теллуристая кислоты.
- •40. Серная, селеновая и теллуровые кислоты.
- •41. Промышленные способы получения серной кислоты.
- •42. Общая характеристика элементов vа группы. Соединения азота, фосфора, сурьмы и висмута в природе.
- •43. Химические свойства элементов vа группы, взаимодействие с простыми веществами. Взаимодействие с водой кислотами и щелочами.
- •44. Оксиды азота (n2o, no, n2o3, n2o5).
- •45. Азотистая кислота и ее соли.
- •46. Бинарные соединения элементов vа группы. Соединения с водородом.
- •47. Гидразин и гидроксиламин. Окислительно -восстановительные свойства.
- •48. Аммиак его получение и свойства. Соли аммония. Нашатырь.
- •49. Азотная кислота. Физические и химические свойства концентрированной и разбавленной азотной кислоты.
- •50. Промышленные способы получения азотной кислоты. Нитраты, разложение нитратов.
- •51. Кислородсодержащие соединения фосфора. Оксиды фосфора (lll и V).
- •52. Кислородсодержащие соединения мышьяка, сурьмы и висмута (lll и V).
- •53. Фосфорная, фосфористая и фосфорноватистые кислоты.
- •54. Гидролиз фосфатов. Показатель кислотности среды.
- •55. Гидроксиды мышьяка, сурьмы и висмута.
- •56. Общая характеристика элементов четвертой а группы. Аллотропные модификации углерода. Строение и свойства кремния.
- •57. Германий, олово, свинец, химические свойства.
- •58. Углерод и кремний, химические свойства.
- •59. Гидриды элементов четвертой а группы. Оксиды углерода.
- •60. Угольная кислота и ее соли. Жесткость воды и способы ее устранения. Карбонатное равновесие в природе.
- •61. Кислородсодержащие соединения кремния. Диоксид кремния.
- •62. Щелочные металлы. Общая характеристика оксидов, гидроксидов и солей. Калийные удобрения.
- •63. Щелочноземельные металлы. Общая характеристика оксидов, гидроксидов и солей. Известь и ее применение.
- •64. Характеристика vib подгруппы. Химические и физические свойства простых веществ. Способы получения хрома, молибдена и вольфрама.
- •65. Соединения трехвалентного хрома. Оксиды и гидроксиды. Применение.
- •66. Соединения шестивалентного хрома. Оксиды и гидроксиды. Применение.
- •67. Подгруппа марганца. Физические и химические свойства простых веществ.
- •68. Окислительно-восстановительные свойства соединений марганца.
51. Кислородсодержащие соединения фосфора. Оксиды фосфора (lll и V).
Ответ. Оксид фосфора (III) P2O3 существует в виде нескольких модификаций, построенных из пирамидальных структурных единиц. Обычная форма Р2О3 имеет молекулярную решетку, образованную молекулами Р 4О6. Эта форма легкоплавка (Тпл = 23,8 °С, Т кип = 175,4 °С), незначительно растворима в сероуглероде. Молекула Р 4О6 состоит из четырех пирамид РО3, соединенных через атомы кислорода. Другие модификации Р 2О3 – полимерные соединения. Р2О3 образуется при медленном окислении белого фосфора кислородом: 4P + 3O2 → 2P2O3 (в недостатке кислорода). Оксид хорошо растворим в воде. P2O3 в холодной воде образует фосфористую кислоту, а в горячей воде диспропорционирует: P2O3 + 3Н2О = 2Н3PO3, 3P2O3 + P2O3 + 12H2O = 2PH3 + 6H 3PO4. По химической природе P2O3 является кислотным оксидом, о чем свидетельствует взаимодействие с основными соединениями: 4NaOH + P2O3 = 2Na2HPO3 + H2O. В обычных условиях РF5 – газ (Тпл = –93,7 °С, Ткип = 84,6 °С), РСl 5 (Т. возг. = 159 °С) и РBr5 (Т. пл. = 106 °С) – твердые вещества. Оксид фосфора (V) P2O5 – наиболее стабильный оксид фосфора. В парообразном состоянии имеет состав P4O10, 4 атома фосфора расположены в узлах тетраэдра. Характерен полиморфизм. Оксид P2O5 получают сжиганием фосфора. Технический продукт имеет вид белой снегообразной массы, обычно состоящей из смеси разных форм P2O5. В воде при различных условиях образуют разнообразные продукты: P2O5 + Н2О = 2НРО3 (на холоде), P2O5 + 3Н2О = 2Н3РО4 (при нагревании), 2Н3РО4 = Н4Р2О7 + Н2О (при дальнейшем нагревании), Н4Р2О7 = 2НРО3 + Н2О (термическое разложение). Оксид фосфора (V) используют для осушения газов и жидкостей. Он может отнимать воду у различных веществ, например, превращает НNO3 в N2O5. В качестве хорошего дегидратирующего средства оксид фосфора (V) широко используют в химическом синтезе. Производные P2O5 – оксофосфаты – весьма разнообразны. Большое многообразие оксофосфатов объясняется тем, что тетраэдрические структурные единицы РО4 могут объединяться с соседними единицами РО 4 посредством одной, двух или трех вершин. Простейшим представителем оксофосфатов (V) водорода является ортофосфорная кислота Н3РО4. Молекула имеет форму искаженного тетраэдра. В твердом и жидком состоянии молекулы объединяются за счет водородных связей. Этим обусловлена повышенная вязкость концентрированных растворов фосфорной кислоты. Соединения фосфора широко применяют в качестве удобрений, для борьбы с вредителями сельскохозяйственных культур и сорняками, в медицине, производстве пластмасс, моющих средств и других областях.
52. Кислородсодержащие соединения мышьяка, сурьмы и висмута (lll и V).
Ответ.
Висмут — металл, а мышьяк и сурьма
занимают промежуточное положение. Для
всех трех элементов характерны степени
окисления -3, 0, +3 и +5. Степень окисления
+5 наиболее характерна для Sb, менее для
As и неустойчива для Bi. Кислородсодержащие
соединения обычно проявляют кислотный
характер. Мышьяк, сурьма и висмут образуют
оксиды типа Э203 и Э203. Устойчивость
состояния с высшей степенью окисления
уменьшается с увеличением заряда ядра
в ряду As — Sb — Bi, при этом основные
свойства оксидов возрастают в ряду As —
Sb — Bi. Так, у As203 преобладают кислотные
свойства, у Sb203 — основные свойства, a
Bi203 обладает отчетливо выраженными
основными свойствами. Оксиды типа Э203
легко образуются при непосредственном
взаимодействии элементов с кислородом
по схеме
![]() .
As203 — белый мышьяк. Проявляет преимущественно
кислотные свойства. Он взаимодействует
с Н20, щелочами и галогеноводородными
кислотами:
.
As203 — белый мышьяк. Проявляет преимущественно
кислотные свойства. Он взаимодействует
с Н20, щелочами и галогеноводородными
кислотами:
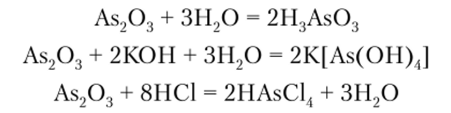 Sbv03
в воде практически нерастворим, но
взаимодействует с НС1 и щелочами.
Sbv03
в воде практически нерастворим, но
взаимодействует с НС1 и щелочами.
Взаимодействие
Аs203
и Sb203 со щелочами приводит к образованию
тетрагидроксоарсенатов(Ш) К[As(OH) 4]. Bi203
в воде не растворяется, со щелочами
практически не реагирует, но легко
взаимодействует с кислотами, образуя
соли:
![]() .
As(OH)3 амфотерен, с преобладанием кислотных
свойств. В свободном состоянии не
выделен, в водном растворе ведет себя
как слабая кислота H3As03, называемая
мышьяковистой кислотой. Соли этой
кислоты — арсениты. Sb(OH)3 также амфотерен,
но с преобладанием основных свойств.
Кислотно-основная ионизация у этих
гидроксидов выражена слабо. У Bi(OH)3 явно
преобладают основные свойства.
Следовательно, кислотные свойства в
ряду As(OH)3, Sb(OH)3 и Bi(OH)3 ослабевают, а
основные усиливаются. As(OH)3 может быть
получен взаимодействием As203 с водой.
Поскольку у As(OH)3 преобладают кислотные
свойства, то в водном растворе он ведет
себя как кислота H3As03:
.
As(OH)3 амфотерен, с преобладанием кислотных
свойств. В свободном состоянии не
выделен, в водном растворе ведет себя
как слабая кислота H3As03, называемая
мышьяковистой кислотой. Соли этой
кислоты — арсениты. Sb(OH)3 также амфотерен,
но с преобладанием основных свойств.
Кислотно-основная ионизация у этих
гидроксидов выражена слабо. У Bi(OH)3 явно
преобладают основные свойства.
Следовательно, кислотные свойства в
ряду As(OH)3, Sb(OH)3 и Bi(OH)3 ослабевают, а
основные усиливаются. As(OH)3 может быть
получен взаимодействием As203 с водой.
Поскольку у As(OH)3 преобладают кислотные
свойства, то в водном растворе он ведет
себя как кислота H3As03:
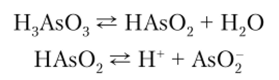 Равновесие
в первой из этих реакций сильно смещено
вправо. Гидроксиды Sb(OH)3 и Bi(OH)3 в воде
практически не растворяются. Их обычно
получают действием растворов щелочей
на соответствующие соли:
Равновесие
в первой из этих реакций сильно смещено
вправо. Гидроксиды Sb(OH)3 и Bi(OH)3 в воде
практически не растворяются. Их обычно
получают действием растворов щелочей
на соответствующие соли:
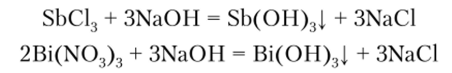 Соли
мышьяковистой кислоты называются
арсенитами и получаются при действии
щелочей на As203:
Соли
мышьяковистой кислоты называются
арсенитами и получаются при действии
щелочей на As203:
![]() Соли
Sb(III) и Bi(III) легко гидролизуются с
образованием основных солей, которые
в дальнейшем разлагаются до малорастворимых
в воде оксосолей:
Соли
Sb(III) и Bi(III) легко гидролизуются с
образованием основных солей, которые
в дальнейшем разлагаются до малорастворимых
в воде оксосолей:
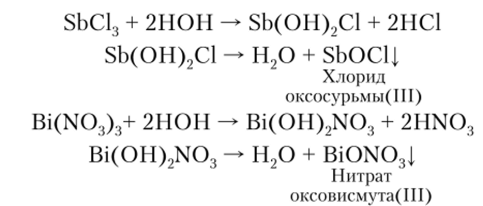 Соединения
As(III) являются восстановителями; при их
окислении получаются соединения As(V).
Так, в слабощелочной среде арсениты
могут быть окислены свободным иодом до
арсеиатов:
Соединения
As(III) являются восстановителями; при их
окислении получаются соединения As(V).
Так, в слабощелочной среде арсениты
могут быть окислены свободным иодом до
арсеиатов:
![]() Производные Sb(III) обладают меньшей
восстановительной способностью, а
окисление соединений Bi(III) возможно лишь
энергичными окислителями в сильнощелочной
среде:
Производные Sb(III) обладают меньшей
восстановительной способностью, а
окисление соединений Bi(III) возможно лишь
энергичными окислителями в сильнощелочной
среде:
![]() Оксид
мышьяка(У) As205 непосредственным окислением
мышьяка не образуется. Его получают
дегидратацией мышьяковой кислоты
H3As04:
Оксид
мышьяка(У) As205 непосредственным окислением
мышьяка не образуется. Его получают
дегидратацией мышьяковой кислоты
H3As04:
![]() Sb205
в чистом виде выделить трудно, поскольку
в процессе его получения происходят
частичная потеря кислорода и образование
Sb204. As2()- и Sb205 в обычных условиях — твердые
вещества. По своей структуре и свойствам
As7()- напоминает Р205. Так, легко растворяясь
в воде, As2Os образует мышьяковую кислоту
H3As04:
Sb205
в чистом виде выделить трудно, поскольку
в процессе его получения происходят
частичная потеря кислорода и образование
Sb204. As2()- и Sb205 в обычных условиях — твердые
вещества. По своей структуре и свойствам
As7()- напоминает Р205. Так, легко растворяясь
в воде, As2Os образует мышьяковую кислоту
H3As04:
![]() Sb205
в воде растворим мало, но легко растворяется
в щелочах с образованием
гексагидроксостибатов(У) типа Me[Sb(OH)6]:
Sb205
в воде растворим мало, но легко растворяется
в щелочах с образованием
гексагидроксостибатов(У) типа Me[Sb(OH)6]:
![]() При
сплавлении As20- и Sb205 со щелочами образуются
арсенаты и стибаты типа МеЭ03; МеЭ04 и
Ме2Э2От7, которые в своем большинстве
полимерны. Кристаллизацией из водных
растворов обычно получают арсенаты
типа Me3As04. Оксиду As203 соответствует
оксоарсенат водорода или мышьяковая
кислота H3As04, которая слабее фосфорной.
Как трехосновная кислота H3As04 образует
три типа солей — арсенаты Na3As04,
дигидроарсенаты NaH2As04 и гидроарсенаты
Na2HAs04. Оксиду Sb205 соответствует сурьмяная
кислота H3Sb04, однако она существует в
водных растворах в нескольких формах.
Попытка выделить сурьмяные кислоты
приводит к образованию осадков
неопределенного состава Sb205-«H20. Соли
сурьмяной кислоты (антимонаты)
соответствуют обычно гексаги-
дроксосурьмяной кислоте, формула которой
H[Sb(OH)G], отвечает гидратированной метаформе
HSb03-3H20. В свободном состоянии не получены
и висмутовые кислоты. Подобно фосфатам,
большинство арсенатов и антимонатов
труднорастворимы в воде.
При
сплавлении As20- и Sb205 со щелочами образуются
арсенаты и стибаты типа МеЭ03; МеЭ04 и
Ме2Э2От7, которые в своем большинстве
полимерны. Кристаллизацией из водных
растворов обычно получают арсенаты
типа Me3As04. Оксиду As203 соответствует
оксоарсенат водорода или мышьяковая
кислота H3As04, которая слабее фосфорной.
Как трехосновная кислота H3As04 образует
три типа солей — арсенаты Na3As04,
дигидроарсенаты NaH2As04 и гидроарсенаты
Na2HAs04. Оксиду Sb205 соответствует сурьмяная
кислота H3Sb04, однако она существует в
водных растворах в нескольких формах.
Попытка выделить сурьмяные кислоты
приводит к образованию осадков
неопределенного состава Sb205-«H20. Соли
сурьмяной кислоты (антимонаты)
соответствуют обычно гексаги-
дроксосурьмяной кислоте, формула которой
H[Sb(OH)G], отвечает гидратированной метаформе
HSb03-3H20. В свободном состоянии не получены
и висмутовые кислоты. Подобно фосфатам,
большинство арсенатов и антимонатов
труднорастворимы в воде.
