
- •Неорганическая химия теория
- •1. Основные понятия химии: атом, хим. Элемент, молекула, эквивалент, молярная масса эквивалента, относительная атомная масса, моль, молярная масса.
- •2, Основные стехиометрические законы: закон сохранения массы и энергии, закон постоянства состава, закон кратных отношений, закон эквивалентов.
- •3. Основные газовые законы: закон объемных отношений, закон Гей-Люссака, объединенный газовый закон, уравнение Менделеева-Клапейрона.
- •4. Основные классы и номенклатура неорганических веществ: оксиды (солеобразующие и несолеобразующие, основные, кислотные, амфотерные), гидроксиды.
- •5. Основные классы и номенклатура неорганических веществ: кислоты и соли.
- •6. Диссоциация воды, константа диссоциации, pH, ионное произведение воды.
- •7. Развитие учения о строении атома (Модель Томсона, опыты Резерфорда, постулаты Бора), квантово- механическая теория.
- •8. Характеристика основных квантовых чисел: n, m, l, s; строение электронных оболочек атомов.
- •9. Периодическая система элементов, как форма отражения периодического закона.
- •10. Ковалентная химическая связь, способы образования ковалентной связи.
- •11. Геометрия структур с ковалентным типом связей (sp1-, sp2-, sp3- гибридизация).
- •12. Ионная и металлическая связь.
- •13. Водородная связь. Межмолекулярные взаимодействия (Ориентационное взаимодействие, индукционное взаимодействие, дисперсионное взаимодействие).
- •14. Метод валентных связей и метод молекулярных орбиталей.
- •15. Кристаллическое состояние веществ атомные и молекулярные кристаллические решетки. Примеры.
- •16. Химические реакции, скорость химических реакций.
- •17. Влияние температуры на скорость химической реакции, правило Вант-Гоффа.
- •18. Катализ, влияние катализатора на скорость химической реакции.
- •19. Химическое равновесие, принцип Ле-Шателье.
- •20. Внутренняя энергия, энтальпия, энтропия.
- •21. Законы Генри, законы Рауля, закон Дальтона.
- •22. Осмотическое давление, закон Вант-Гоффа.
- •23. Особенности растворов электролитов. Основные положения теории электролитической диссоциации.
- •24. Произведение растворимости, реакция обмена в растворах электролитов.
- •25. Теория овр, важнейшие окислители и восстановители, метод электронного баланса, метод полуреакции.
- •26. Электролиз. Электродный потенциал, водородный электрод.
- •27. Гидролиз солей. Количественные характеристики гидролиза.
- •28. Гальванический элемент и его э. Д. С. Влияние условий на протекание овр.
- •29. Номенклатура и классификация комплексных соединений.
- •30. Характеристика комплексных соединений, константа стойкости и константа неустойчивости.
- •31. Общая характеристика водорода. Физические и химические свойства. Окислительно-восстановительные свойства пероксида водорода.
- •32. Галогены, общая характеристика, свойства простых веществ.
- •33. Галогеноводороды, плавиковая и соляная кислоты.
- •34. Кислородсодержащие соединения галогенов. Оксиды и фторид оксигена.
- •35. Кислородсодержащие соединения галогенов. Гидроксиды и соли.
- •36. Общая характеристика халькогенов. Свойства простых веществ.
- •37. Гидриды халькогенов. Биологическое действие халькогеноводородов.
- •38. Оксиды халькогенов, диоксиды и триоксиды.
- •39. Сернистая, селенистая и теллуристая кислоты.
- •40. Серная, селеновая и теллуровые кислоты.
- •41. Промышленные способы получения серной кислоты.
- •42. Общая характеристика элементов vа группы. Соединения азота, фосфора, сурьмы и висмута в природе.
- •43. Химические свойства элементов vа группы, взаимодействие с простыми веществами. Взаимодействие с водой кислотами и щелочами.
- •44. Оксиды азота (n2o, no, n2o3, n2o5).
- •45. Азотистая кислота и ее соли.
- •46. Бинарные соединения элементов vа группы. Соединения с водородом.
- •47. Гидразин и гидроксиламин. Окислительно -восстановительные свойства.
- •48. Аммиак его получение и свойства. Соли аммония. Нашатырь.
- •49. Азотная кислота. Физические и химические свойства концентрированной и разбавленной азотной кислоты.
- •50. Промышленные способы получения азотной кислоты. Нитраты, разложение нитратов.
- •51. Кислородсодержащие соединения фосфора. Оксиды фосфора (lll и V).
- •52. Кислородсодержащие соединения мышьяка, сурьмы и висмута (lll и V).
- •53. Фосфорная, фосфористая и фосфорноватистые кислоты.
- •54. Гидролиз фосфатов. Показатель кислотности среды.
- •55. Гидроксиды мышьяка, сурьмы и висмута.
- •56. Общая характеристика элементов четвертой а группы. Аллотропные модификации углерода. Строение и свойства кремния.
- •57. Германий, олово, свинец, химические свойства.
- •58. Углерод и кремний, химические свойства.
- •59. Гидриды элементов четвертой а группы. Оксиды углерода.
- •60. Угольная кислота и ее соли. Жесткость воды и способы ее устранения. Карбонатное равновесие в природе.
- •61. Кислородсодержащие соединения кремния. Диоксид кремния.
- •62. Щелочные металлы. Общая характеристика оксидов, гидроксидов и солей. Калийные удобрения.
- •63. Щелочноземельные металлы. Общая характеристика оксидов, гидроксидов и солей. Известь и ее применение.
- •64. Характеристика vib подгруппы. Химические и физические свойства простых веществ. Способы получения хрома, молибдена и вольфрама.
- •65. Соединения трехвалентного хрома. Оксиды и гидроксиды. Применение.
- •66. Соединения шестивалентного хрома. Оксиды и гидроксиды. Применение.
- •67. Подгруппа марганца. Физические и химические свойства простых веществ.
- •68. Окислительно-восстановительные свойства соединений марганца.
16. Химические реакции, скорость химических реакций.
Ответ.
Скорость
химической реакции –
число элементарных актов реакции,
происходящих за единицу времени, в
единице объема (гомогенная реакция) или
на единице поверхности (гетерогенная
реакция) раздела фаз. Мера скорости
химической реакции – количество
вещества, вступившего в реакцию или
образовавшегося при реакции за единицу
времени в единице объема системы или
на единице поверхности раздела фаз.
![]() ;
; ![]() , где
, где
![]() -
число молей какого-либо из получающихся
при реакции веществ; V – объем системы;
t – время; S – площадь поверхности фазы,
на которой протекает реакция;
-
число молей какого-либо из получающихся
при реакции веществ; V – объем системы;
t – время; S – площадь поверхности фазы,
на которой протекает реакция; ![]() –
молярная концентрация данного вещества.
Средняя скорость реакции при определенной
температуре равна изменению концентрации
одного из реагентов или одного из
продуктов за единицу времени.
–
молярная концентрация данного вещества.
Средняя скорость реакции при определенной
температуре равна изменению концентрации
одного из реагентов или одного из
продуктов за единицу времени.
![]() .
Элементарные
реакции
– протекают в одну стадию. Сложные
реакции
– протекают в несколько стадий. Закон
действующих масс: скорость химических
реакций пропорциональна концентрации
реагирующих веществ, возведенных в
степень их стехиометрических коэффициентов.
Для
гомогенных реакций:
.
Элементарные
реакции
– протекают в одну стадию. Сложные
реакции
– протекают в несколько стадий. Закон
действующих масс: скорость химических
реакций пропорциональна концентрации
реагирующих веществ, возведенных в
степень их стехиометрических коэффициентов.
Для
гомогенных реакций: ![]() ;
;
![]() ,
где k- константа скорости; [ ] – молярная
концентрация. Величина k зависит от
природы реагирующих веществ, от
температуры и присутствия катализатора,
но не зависит от концентрации
реагирующих веществ. Для гетерогенных
реакций в уравнении закона действующих
масс входят концентрации только тех
веществ, которые находятся в газовой
форме или в растворе. Концентрация
твердых веществ представляет собой
постоянную величину и поэтому входит
в константу скорости. Скорость любого
гетерогенного процесса возрастает при
увеличении поверхности контакта фаз
(измельчение).
,
где k- константа скорости; [ ] – молярная
концентрация. Величина k зависит от
природы реагирующих веществ, от
температуры и присутствия катализатора,
но не зависит от концентрации
реагирующих веществ. Для гетерогенных
реакций в уравнении закона действующих
масс входят концентрации только тех
веществ, которые находятся в газовой
форме или в растворе. Концентрация
твердых веществ представляет собой
постоянную величину и поэтому входит
в константу скорости. Скорость любого
гетерогенного процесса возрастает при
увеличении поверхности контакта фаз
(измельчение).
17. Влияние температуры на скорость химической реакции, правило Вант-Гоффа.
Ответ.
Правило
Ван-Гоффа:
скорость большинства химических реакций
увеличивается в 2-4 раза при повышении
температуры на 10 градусов.
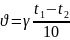 γ - температурный коэффициент. Ускорение
химической реакции с ростом температуры,
казалось бы, можно объяснить увеличением
числа столкновений реагирующих частиц.
Однако далеко не каждое столкновение
приводит к акту химической реакции. Для
того чтобы столкновение стало эффективным,
реагирующие частицы должны не только
обладать достаточной энергией, но и
иметь пространственное соответствие.
Количественной характеристикой
энергетического соответствия является
величина, называемая энергия активации
(Еа). Энергия
активации
(Еа) – это некоторое избыточное количество
энергии по сравнению со средней ее
величиной, которым должна обладать
молекула в момент столкновения, чтобы
произошла реакция. Энергия активации
расходуется на преодоление отталкивания
между частицами и на ослабление химических
связей у исходных веществ. Таким образом,
энергия активации косвенно характеризует
природу реагирующих веществ, так как
отражает прочность химической связи в
них. Влияние температуры и природы
реагирующих веществ на скорость
химической реакции описывается уравнением
Аррениуса,
которое связывает константу химической
реакции с энергией активации и
температурой:
γ - температурный коэффициент. Ускорение
химической реакции с ростом температуры,
казалось бы, можно объяснить увеличением
числа столкновений реагирующих частиц.
Однако далеко не каждое столкновение
приводит к акту химической реакции. Для
того чтобы столкновение стало эффективным,
реагирующие частицы должны не только
обладать достаточной энергией, но и
иметь пространственное соответствие.
Количественной характеристикой
энергетического соответствия является
величина, называемая энергия активации
(Еа). Энергия
активации
(Еа) – это некоторое избыточное количество
энергии по сравнению со средней ее
величиной, которым должна обладать
молекула в момент столкновения, чтобы
произошла реакция. Энергия активации
расходуется на преодоление отталкивания
между частицами и на ослабление химических
связей у исходных веществ. Таким образом,
энергия активации косвенно характеризует
природу реагирующих веществ, так как
отражает прочность химической связи в
них. Влияние температуры и природы
реагирующих веществ на скорость
химической реакции описывается уравнением
Аррениуса,
которое связывает константу химической
реакции с энергией активации и
температурой:
![]() где
Ао – предэкспоненциальный множитель;
Еа– энергия активации; R– универсальная
газовая постоянная (8,314 Дж/моль∙К); Т–
абсолютная температура. Из уравнения
Аррениуса следует, что при постоянной
температуре константа скорости
определяется величиной энергии активации.
Чем выше Еа, тем меньше в реакционной
смеси активных молекул, тем меньше
константа скорости и сама скорость
химической реакции.
где
Ао – предэкспоненциальный множитель;
Еа– энергия активации; R– универсальная
газовая постоянная (8,314 Дж/моль∙К); Т–
абсолютная температура. Из уравнения
Аррениуса следует, что при постоянной
температуре константа скорости
определяется величиной энергии активации.
Чем выше Еа, тем меньше в реакционной
смеси активных молекул, тем меньше
константа скорости и сама скорость
химической реакции.
