
- •Билет 1
- •Билет 2
- •Пути обезвреживания аммиака. Механизмы транспорта аммиака в организме: глутаминовый и глюкозо-аланиновый циклы.
- •Билет 3
- •1. Липопротеины очень низкой и низкой плотности: формирование, функции и метаболизм.
- •2. Особенности обмена аминокислот и белков в нервной ткани. Метаболический цикл глутаминовой кислоты.
- •Билет 4
- •Билет 5
- •Билет 6
- •Билет 7
- •1 Комплекс. Надн-КоQ-оксидоредуктаза
- •2 Комплекс. Фад-зависимые дегидрогеназы
- •3 Комплекс. КоQ-цитохром с-оксидоредуктаза
- •4 Комплекс. Цитохром с-кислород-оксидоредуктаза
- •Билет 8
- •Билет 9-1 ????
- •Метаболизм кетоновых тел при голодании
- •Билет 9
- •1. Цикл трикарбоновых кислот (цтк). Биологическая роль.
- •2. Особенности метаболизма в эритроцитах и лейкоцитах.
- •Билет 10
- •1 Схема-
- •2 Схема-
- •3 Этап оу – промежуточный обмен
- •1 Стадия облучения билирубина в коже с образованием люмирубина.
- •2 Стадия. Люмирубин попадает в кровь и выводится с жёлчью и мочой.
- •Билет 11
- •Билет 12
- •1. Этапы аэробного гликолиза
- •Билет 13
- •Билет 14
- •1. Липопротеины высокой плотности: формирование, функции и метаболизм.
- •2. Функции сосудистого эндотелия, субэндотелия и тромбоцитов. Сосудисто-тромбоцитарный гемостаз (первичный).
- •Билет 15
- •1. Переваривание белков в желудочно-кишечном тракте. Биологическое значение переваривания. Схема процесса. Характеристика пищеварительных ферментов.
- •2. Строение и состав мембран. Общие свойства мембран и их функции. Трансмембранный перенос малых молекул. Типы переноса веществ через мембрану. Трансмембранный перенос макромолекул и частиц.
- •Билет 16
- •1. Трансаминирование аминокислот, биологическое значение, субстраты, ферменты, роль витаминов в этом процессе.
- •2. Роль афк в механизме фагоцитоза. Кислородзависимые и кислороднезависимые механизмы фагоцитоза. Роль афк в антимикробной защите грудного молока.
- •Билет 17
- •1. Окислительное дезаминирование (прямое, непрямое) аминокислот. Схема процесса, стадии, ферменты, биологическое значение процесса.
- •2. Гормоны щитовидной железы: химическая природа и структура, этапы биосинтеза.
- •Билет 18
- •1. Декарбоксилирование аминокислот. Биологическое значение. Продукты и их судьба.
- •2. Альдостерон: химическая природа, механизм действия, органы-мишени, биологические эффекты.
- •Билет 19
- •1. Синтез мочевины: схема реакций, суммарное уравнение. Взаимосвязь с цтк. Клиническое значение определения концентрации мочевины в крови и моче, причины повышения и понижения концентрации мочевины.
- •Билет 19 – 2 ????
- •Билет 20
- •1. Катаболизм пуриновых нуклеотидов. Содержание мочевой кислоты в сыворотке крови в норме и причины его повышения. Подагра.
- •2. Инсулин: химическая природа, локализация биосинтеза, схема синтеза, механизм действия, органы-мишени, биологические эффекты.
- •Билет 21
- •1. Схема переваривания пищевых липидов в жкт: этапы, субстраты, ферменты, роль продуктов гидролиза, роль жёлчных кислот.
- •2. Особенности метаболизма и энергетического обмена в клетках поперечно-полосатой мускулатуры и миокарда.
- •Билет 22
- •1. Этапы катаболизма жирных кислот: реакции, ферменты. Энергетический эффект полного окисления с16:0. Регуляция процесса β-окисления вжк.
- •2. Активные формы кислорода (афк). Биологическое действие афк. Ферментативные и неферментативные системы, генерирующие афк.
- •Билет 23
- •1. Анаэробный распад глюкозы (анаэробный гликолиз). Судьба продуктов гликолиза в анаэробных условиях. Биологическое значение анаэробного распада глюкозы. Цикл Кори.
- •Билет 23-2 ???
- •Билет 24
- •1. Биологическое значение и структуры кетоновых тел. Синтез кетоновых тел в печени; регуляция синтеза. Представление о кетонемии, кетонурии и кетоацидозе.
- •2. Биохимические механизмы адаптации к голоданию, типы голодания. Фазы полного голодания. Изменение гормонального статуса и метаболизма при голодании.
- •1. Обмен углеводов
- •2. Обмен жиров
- •Билет 25
- •1. Схема синтеза глицеролфосфолипидов. Особенности строения глицерофосфолипидов в функционировании сурфактанта легкого.
- •2. Кальцитриол: химическая природа, этапы синтеза, механизм действия, органы-мишени, биологические эффекты. Представление о заболевании «рахит».
- •Билет 25-2 ???
- •Билет 26
- •2. Адреналин: химическая природа, механизм действия, органы-мишени, биологические эффекты екты.
- •Билет 27
- •1. Функции клеточного метаболизма. Понятие о процессах катаболизма и анаболизма. Стадии генерирования энергии по Кребсу.
- •2. Ферментативные системы антирадикальной защиты. Катализируемые реакции.
- •Билет 28
- •1. Синтез креатина, креатинфосфата, креатинина. Функции этих соединений в организме.
- •2. Типы переваривания. Функции жкт как пищеварительно-транспортного конвейера. Функции слюны. Функции желчных кислот.
- •Билет 29
- •1. Этапы биосинтеза жирных кислот: реакции, ферменты. Регуляция процесса биосинтеза вжк.
- •2. Гормоны щитовидной железы: химическая природа и структура, этапы биосинтеза.
- •Билет 30
- •1. 1. Пентозо-фосфатный путь (пфп) окисления глюкозы. Биологическое значение.
- •Билет 31
- •Билет 32
- •Билет 33
- •Билет 34 (не точно)-1
- •1. Распад гликогена в печени и скелетных мышцах. Регуляция этих процессов.
- •2. Повреждающее действие первичных и вторичных продуктов пероксидного окисления на мембраны и другие структуры клетки.
- •Билет 34 (не точно)-2
- •Билет 35
- •1. Классификация лп. Структура и состав липопротеидных частиц. Апобелки и их функции. Ферменты, участвующие в метаболизме лп. Индекс атерогенности.
- •2. Биологическая роль печени в регуляции углеводного обмена. Обмен фруктозы и галактозы.
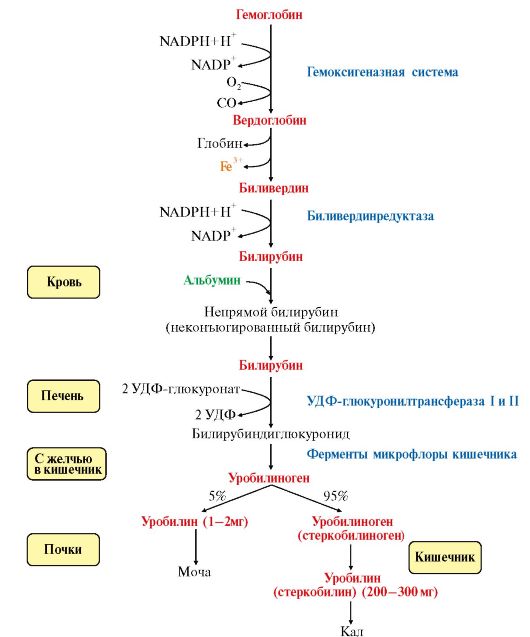
- •2. Роль печени в пигментном обмене. Виды желтух и причины их возникновения. Физиологическая желтуха новорожденных.
- •Билет 36
- •1. Структура и функции холестерина в организме человека. Фонд, пути использования в организме и выведения холестерина. Биосинтез холестерина, метаболическая и гормональная регуляция.
- •2. Предсердный натрийуретический фактор (пнф): химическая природа, механизм действия, органы-мишени, биологические эффекты.
- •Билет 37
- •1 Комплекс. Надн-КоQ-оксидоредуктаза
- •2 Комплекс. Фад-зависимые дегидрогеназы
- •3 Комплекс. КоQ-цитохром с-оксидоредуктаза
- •4 Комплекс. Цитохром с-кислород-оксидоредуктаза
- •1. Разобщители цпэ.
- •Билет 38
- •Билет 39
- •1. Этапы аэробного гликолиза
- •Билет 40
- •Билет 41 ???
- •Билет 42
Билет 12
1) Гликолиз: общая характеристика, стадии, реакции процесса, регулируемые ферменты, энергетический эффект. Судьба продуктов гликолиза в аэробных условиях: схема процесса, связь с синтезом АТФ.
Путь, по которому глюкоза окисляется до пировиноградной кислоты для получения энергии, называется гликолизом. В зависимости от дальнейшей судьбы пирувата различают аэробный и анаэробный гликолиз.
Гликолиз - специфический путь катаболизма глюкозы, в результате которого происходит расщепление глюкозы с образованием двух молекул пирувата - аэробный гликолиз или две молекулы лактата - анаэробный гликолиз
Аэробным гликолизом называют процесс окисления глюкозы до пировиноградной кислоты, протекающий в присутствии кислорода. Все ферменты, катализирующие реакции этого процесса, локализованы в цитозоле клетки.
ЭНЕРГЕТИЧЕСКИЙ эффект: в печени, сердце,почках-38 АТФ.В мозге, мышцах-36
1. Этапы аэробного гликолиза
В аэробном гликолизе можно выделить 2 этапа.
Подготовительный этап, в ходе которого глюкоза фосфорилируется и расщепляется на две молекулы фосфотриоз. Эта серия реакций протекает с использованием 2 молекул АТФ.
Этап, сопряжённый с синтезом АТФ. В результате этой серии реакций фосфотриозы превращаются в пируват. Энергия, высвобождающаяся на этом этапе, используется для синтеза 10 моль АТФ
Аэробный катаболизм глюкозы до СО2 и Н2О происходит во многих органах и тканях и служит основным, хотя и не единственным, источником энергии для жизнедеятельности.
Анаэробный гликолиз локализуется в цитозоле и включает 2 этапа из 11 ферментативных реакций
Первый этап – подготовительный, здесь происходит затрата энергии АТФ, активация глюкозы и образование из нее триозофосфатов.
Первая реакция гликолиза, строго говоря, к гликолизу не относится. Это гексокиназная реакция о которой ранее уже говорилось ("Метаболизм гликогена"). Ее роль сводится к превращению глюкозы в реакционно способное соединение за счет фосфорилирования 6го, невключенного в кольцо, атома углерода.
Для печени характерен изофермент гексокиназы – глюкокиназа. Низкое сродство этого фермента к глюкозе обеспечивает ее захват печенью только после приема пищи, когда создается высокая концентрация глюкозы в крови.
При обычных концентрациях глюкозы в крови печень ее не потребляет и та достается другим тканям.
Вторая реакция – реакция изомеризации – необходима для выведения еще одного атома углерода из кольца для его последующего фосфорилирования. В ней образуется фруктозо-6-фосфат.
Третья реакция – фосфорилирование фруктозо-6- фосфата с образованием почти симметричной молекулы фруктозо-1,6-дифосфата.
В четвертой реакции фруктозо1,6-дифосфат разрезается пополам с образование двух фосфорилированных триозизомеров, альдозы глицеральдегида (ГАФ) и кетозы диоксиацетона (ДАФ).
Пятая реакция подготовительного этапа – переход глицеральдегидфосфата и диоксиацетонфосфата друг в друга. Равновесие реакции сдвинуто в пользу диоксиацетонфосфата, его доля составляет 97%, доля глицеральдегидфосфата – 3%. Эта реакция, при всей ее простоте, является вершителем судьбы глюкозы:
при нехватке энергии в клетке и активации окисления глюкозы диоксиацетонфосфат превращается в глицеральдегидфосфат, который далее окисляется на втором этапе гликолиза;
при достаточном количестве АТФ, наоборот, глицеральдегидфосфат изомеризуется в диоксиацетонфосфат, и последний отправляется на синтез жиров (см "Синтез триацилглицеридов").
Второй этап гликолиза – это освобождение энергии, содержащейся в глицеральдегидфосфате, и запасание ее в форме АТФ.
Шестая реакция гликолиза – окисление глицеральдегидфосфата и присоединение к нему фосфорной кислоты приводит к образованию макроэргического соединения 1.3-дифосфоглицериновой кислоты.
В седьмой реакции энергия фосфоэфирной связи, заключенная в 1,3-дифосфоглицерате тратится на образование АТФ. Реакция получила дополнительное название –реакция субстратного фосфорилирования, что уточняет источник энергии для получения макроэргической связи в АТФ (субстрат) в отличие от окислительного фосфорилирования (электрохимический градиент ионов водорода на мембране митохондрий).
Подобных реакций в клетке всего три – 1) указанная реакция,
2) пируваткиназная реакция, десятая реакция гликолиза (см ниже),
3) тиокиназная реакция цикла трикарбоновых кислот.
Восьмая реакция – синтезированный в предыдущей реакции 3-фосфоглицерат изомеризуется в 2-фосфоглицерат.
Девятая реакция – отрыв молекулы воды от
2-фосфоглицериновой кислоты приводит к образованию еще одной макроэргической фосфоэфирной связи.
Еще одна реакция субстратного фосфорилирования – десятая реакция гликолиза – заключается в переносе макроэргического фосфата с фосфоенолпирувата на АДФ.
Последняя реакция, одиннадцатая, образование молочной кислоты из пирувата под действием лактатдегидрогеназы. Важно то, что эта реакция осуществляется только в анаэробных условиях. Эта реакция необходима клетке, так как НАДН, образующийся в 6-й реакции, в отсутствие кислорода не может поступать и окисляться в митохондриях.
При наличии кислорода пировиноградная кислота превращается в ацетил-SКоА.
При аэробном гликолизе из 1 молекулы глюкозы образуется 36 или 38 АТФ, выделяется 6 СО2 и 6 Н2О. 2) Гемоглобин, структура и функции. Типы гемоглобина человека, смена
типов в онтогенезе. Кооперативные свойства гемоглобина. Гемоглобинопатии. Железодефицитные анемии.
Гемоглобин (НЬ) - сложный олигомерный белок, состоящий из 4 протомеров двух типов (2α и 2β), включающих 574 аминокислотных остатка. Содержится в эритроцитах, на его долю приходится до 90% массы белков клетки. Гемоглобин обеспечивает перенос кислорода из легких в ткани и удаление диоксида углерода из тканей.
Гемоглобин является сложным белком класса гемопротеинов, то есть в качестве простетической группы здесь выступает гем — порфириновое ядро, содержащее железо. Гемоглобин человека является тетрамером, то есть состоит из 4 протомеров. У взрослого человека они представлены полипептидными цепями α1, α2, β1 и β2. Субъединицы соединены друг с другом по принципу изологического тетраэдра. Основной вклад во взаимодействие субъединиц вносят гидрофобные взаимодействия. И α-, и βцепи относятся к α-спиральному структурному классу, так как содержат исключительно α-спирали. Каждая цепь содержит восемь спиральных участков, обозначаемых буквами от A до H (от N-конца к C-концу). Гем представляет собой комплекс протопорфирина IX, относящегося к классу порфириновых соединений, с атомом железа(II).
Этот кофактор нековалентно связан с гидрофобной впадиной молекул гемоглобина и миоглобина.
Железо(II) характеризуется октаэдрической координацией, то есть связывается с шестью лигандами. Четыре из них представлены атомами азота порфиринового кольца, лежащими в одной плоскости. Две другие координационные позиции лежат на оси, перпендикулярной плоскости порфирина. Одна из них занята азотом остатка гистидина в 93-м положении полипептидной цепи (участок F). Связываемая гемоглобином молекула кислорода координируется к железу с обратной стороны и оказывается заключённой между атомом железа и азотом ещё одного остатка гистидина, располагающегося в 64-м положении цепи (участок E).
Всего в гемоглобине человека четыре участка связывания кислорода (по одному гему на каждую субъединицу), то есть одновременно может связываться четыре молекулы. Гемоглобин в лёгких при высоком парциальном давлении кислорода соединяется с ним, образуя оксигемоглобин. При этом кислород соединяется с гемом, присоединяясь к железу гема на 6-ю координационную связь. На эту же связь присоединяется и монооксид углерода, вступая с кислородом в «конкурентную борьбу» за связь с гемоглобином, образуя карбоксигемоглобин.
Связь гемоглобина с монооксидом углерода более прочная, чем с кислородом. Поэтому часть гемоглобина, образующая комплекс с монооксидом углерода, не участвует в транспорте кислорода. В норме у человека образуется 1,2 % карбоксигемоглобина. Повышение его уровня характерно для гемолитических процессов, в связи с этим уровень карбоксигемоглобина является показателем гемолиза.
Гемоглобины могут различаться по белковой части.
Различают физиологические и аномальные типы гемоглобинов.
Физиологические типы образуются на разных этапах нормального развития организма, а аномальные - вследствие нарушения последовательности аминокислот в белке глобине физиологических типов гемоглобина. Физиологические типы гемоглобинов отличаются друг от друга набором полипептидных цепей или субъединиц, образующихся на разных этапах развития организма человека – от эмбрионального до взрослого состояния.
Различаются следующие физиологические типы гемоглобинов:
а) примитивный НвР, появляется на самых ранних стадиях развития эмбриона (1 – 2 недели) Эмбриональный гемоглобин – тетрамер (2α ,2ε);
б) фетальный гемоглобин НвF НвF является главным типом гемоглобина плода и составляет к моменту рождения 70% всего гемоглобина – это тетрамер (2α, 2γ);
в) гемоглобин взрослого НвА, НвА2, НвА3 НвА появляется на более поздних стадиях развития плода, в крови взрослого человека примерно 95 – 96% НвА – это тетрамер (2α, 2β). Гемогловин А2 – тетрамер (2α, 2σ). Его содержание в эритроцитах взрослого человека равно 2%.
Гемоглобинопатии.
Гемоглобинопатии – наследственные изменения структуры какой-либо цепи нормального гемоглобина вследствие точечных мутаций генов. Известно около 300 вариантов HbA, имеющих в первичной структуре α- или β-цепи незначительные изменения. Некоторые из них практически не влияют на функции белка и здоровье человека, другие – вызывают значительные нарушения функции HbA и развитие заболеваний различной степени тяжести.
а) серповидноклеточная анемия – наследственное заболевание, обусловленное точечной мутацией гена, кодирующего структуру β-цепей гемоглобина. Поэтому в эритроцитах больных присутствует НЬS (в 6 положении вместо глутаминовой кислоты содержится валин).
б) талассемии – наследственное заболевание, обусловленное отсутствим или снижением синтеза α- и β-цепей гемоглобина. В ходе таких нарушений образуются тетрамеры гемоглобина, состоящие из одинаковых протомеров.
В аномальных гемоглобинах изменения могут затрагивать аминокислоты:
· находящиеся на поверхности белка;
· участвующие в формировании активного центра;
· аминокислоты, замена которых нарушает трехмерную конформацию молекулы;
· аминокислоты, замена которых изменяет четвертичную структуру белка и его регуляторные свойства.
Нарушение метаболизма железа
Клинические проявления дефицита железа многообразны и зависят от степени его выраженности и длительности существования.
Причины дефицита железа:
потеря крови (желудочно – кишечные кровотечения, менструации и т. д.); ● увеличение физиологического дефицита в железе возникает при росте, беременности, родах, лактации, голодании;
нарушение всасывания железа в кишечнике, нарушение кислото– и ферменто образующей функции желудка;
хронические инфекции, интоксикации, гиповитаминозы (особенно С - гиповитаминоз), опухолевые процесы;
элементарный дефицит железа;
прием некоторых лекарственных препаратов. Длительное применение нестеридных противовоспалительных препаратов аспирин, вольтарен связан с риском хронической кровопотери, через изъязвление слизистую желудка. Одним из самых распространенных заболеваний на земном шаре является
железодефицитная анемия (ЖДА).
При дефиците Fe страдает весь организм, как правило железодефицитные состояния встречаются у детей, молодых женщин, они сопровождают различные хронические заболевания. Клинические появления зависят от этиологии, выраженности и скорости развития анемии. Болезни сердца и легких усугубляют тяжесть анемии, как правило при уровне гемоглобина ниже 70 г/л появляются признаки тканевой гипоксии.
ЖДА развивается при недостатке поступления железа с пищей нарушение всасывания Fe из-за заболеваний ЖКТ, беременности в период роста
организма.
Хроническая кровопотеря – частая причина железодефицитной анемии у
взрослых (70% всех анемий). Ранних клинических симптомов дефицита Fe не существует, а симптомы дефицита Fe появляются только после истощения запасов Fe в организме. Недостаточное поступление Fe с пищей – распространенная причина дефицита Fe у нас в стране, которая зависит от низкой доли продуктов животного происхождения в рационах. Возникает отрицательный баланс Fe, т. е. потери превышают поступление с пищей. Это часто бывает у беременных, при кормлении
грудью, занятиях спортом. При ЖДА уменьшаетсяразмер эритроцитов и их пигментация (гипохромные эритроциты малых размеров). В эритроцитах уменьшается содержание гемоглобина
(гипохромная анемия), понижается степень насыщения железом, повышается
ОЖСС, в тканях и плазме крови снижается концентрация ферритина. Повышенное содержание железа в организме, превышающее объем ферритинового депо ведет к развитию гемохроматоза. Образующийся гемосидерин вследствие низкой растворимости в воде откладывается в виде гранул в печени, поджелудочной железе, селезенке. Ионы железа оказывают токсичное действие на ферменты окислительно - восстановительных систем клеток, индуцируют образование активных форм кислорода (регуляция фентона) и инициируют перекисное окисление липидов, избыток ферритина и гемосидерина лизосомы, и илзосомальные ферменты вызывают повреждение клеточных структур. В сыворотке выявляют: повышенный уровень Fe, снижение ОЖСС, повышение уровня ферритина.
Функции гемоглобина:
1.Транспорт О2 в виде оксигемоглобина (HHbO2). Одна молекула Нb присоединяет 4 молекулы кислорода. 1 г Нb связывает 1,34 мл О2.
2.Транспорт СО2.
3.Участвует в поддержании кислотно-щелочного состояния (гемоглобиновый буфер).
Гемоглобин взрослого организма (HbA, см. ниже) является тетрамером, состоящим из двух α- и двух β-субьединиц с молекулярными массами примерно 16 кДа. α- и β-цепи отличаются аминокислотной последовательностью, но имеют сходную конформацию. Примерно 80% аминокислотных остатков глобина образуют α-спирали, обозначенные буквами А-Н. Каждая субъединица несет группу гема с ионом двухвалентного железа в центре. При связывании O2 с атомом железа в геме (оксигенация Hb) и отщеплении O2 (дезоксигенация) степень окисления атома железа не меняется.
Соединения Нb:
1. Оксигемоглобин (НHbО2). Гемоглобин, присоединивший 4О2.
2. Карбогемоглобин (НHbСО2) ― соединение гемоглобина с СО2.
3. Метгемоглобин (MetHb). Образуется под влиянием сильных оки-слителей (перманганат калия, анилин, нитриты, пирогаллол и др).
4. Карбоксигемоглобин (НHbCО) ― соединение гемоглобина с угарным газом (СО).
HbA – гемоглобин взрослых, доля составляет 98%, содержит 2α- и 2β-цепи, у плода появляется через 3 месяца жизни и к рождению составляет 80% всего гемоглобина,
HbA2 – гемоглобин взрослых, доля составляет 2%, содержит 2α- и 2δ-цепи,
Кооперативный эффект – В ходе оксигенации процесс присоединения кислорода возрастает. Гемоглобинопатии - обусловленные присутствием в эритроцитах одного или нескольких аномальных гемоглобинов. Выделено свыше 50 патологических разновидностей гемоглобина. При аномалиях гемоглобина нарушаются физико-химические свойства эритроцитов, обменные процессы в них; эритроциты становятся менее устойчивыми к различным гемолизирующим факторам.
Железодефицитная анемия может наблюдаться при повторяющихся кровотечениях, беременности, частых родах, язвах и опухолях ЖКТ, после операций на ЖКТ. При железодефицитной анемии уменьшается размер эритроцитов. В эритроцитах уменьшается содержание гемоглобина, а в тканях и плазме крови снижается концентрация ферритина.
3) Синдром дыхательных расстройств
Задача
Холестерин легко встраивается в мембрану. Предложите механизмы удаления избытка холестерола из мембраны, исходя из строения молекулы данного вещества.
Холестерин – амфифильное вещество с преобладанием гидрофобных свойств. При его этерификации под действием фермента ацилхолестеролацилтрансфераза (АХАТ) образуется эфир, мене растворимый в липидном бислое. Кроме того, избыточный холестерин из мембран клеток эндотелия акцептируется ЛПВП.
