
- •Билет 1
- •Билет 2
- •Пути обезвреживания аммиака. Механизмы транспорта аммиака в организме: глутаминовый и глюкозо-аланиновый циклы.
- •Билет 3
- •1. Липопротеины очень низкой и низкой плотности: формирование, функции и метаболизм.
- •2. Особенности обмена аминокислот и белков в нервной ткани. Метаболический цикл глутаминовой кислоты.
- •Билет 4
- •Билет 5
- •Билет 6
- •Билет 7
- •1 Комплекс. Надн-КоQ-оксидоредуктаза
- •2 Комплекс. Фад-зависимые дегидрогеназы
- •3 Комплекс. КоQ-цитохром с-оксидоредуктаза
- •4 Комплекс. Цитохром с-кислород-оксидоредуктаза
- •Билет 8
- •Билет 9-1 ????
- •Метаболизм кетоновых тел при голодании
- •Билет 9
- •1. Цикл трикарбоновых кислот (цтк). Биологическая роль.
- •2. Особенности метаболизма в эритроцитах и лейкоцитах.
- •Билет 10
- •1 Схема-
- •2 Схема-
- •3 Этап оу – промежуточный обмен
- •1 Стадия облучения билирубина в коже с образованием люмирубина.
- •2 Стадия. Люмирубин попадает в кровь и выводится с жёлчью и мочой.
- •Билет 11
- •Билет 12
- •1. Этапы аэробного гликолиза
- •Билет 13
- •Билет 14
- •1. Липопротеины высокой плотности: формирование, функции и метаболизм.
- •2. Функции сосудистого эндотелия, субэндотелия и тромбоцитов. Сосудисто-тромбоцитарный гемостаз (первичный).
- •Билет 15
- •1. Переваривание белков в желудочно-кишечном тракте. Биологическое значение переваривания. Схема процесса. Характеристика пищеварительных ферментов.
- •2. Строение и состав мембран. Общие свойства мембран и их функции. Трансмембранный перенос малых молекул. Типы переноса веществ через мембрану. Трансмембранный перенос макромолекул и частиц.
- •Билет 16
- •1. Трансаминирование аминокислот, биологическое значение, субстраты, ферменты, роль витаминов в этом процессе.
- •2. Роль афк в механизме фагоцитоза. Кислородзависимые и кислороднезависимые механизмы фагоцитоза. Роль афк в антимикробной защите грудного молока.
- •Билет 17
- •1. Окислительное дезаминирование (прямое, непрямое) аминокислот. Схема процесса, стадии, ферменты, биологическое значение процесса.
- •2. Гормоны щитовидной железы: химическая природа и структура, этапы биосинтеза.
- •Билет 18
- •1. Декарбоксилирование аминокислот. Биологическое значение. Продукты и их судьба.
- •2. Альдостерон: химическая природа, механизм действия, органы-мишени, биологические эффекты.
- •Билет 19
- •1. Синтез мочевины: схема реакций, суммарное уравнение. Взаимосвязь с цтк. Клиническое значение определения концентрации мочевины в крови и моче, причины повышения и понижения концентрации мочевины.
- •Билет 19 – 2 ????
- •Билет 20
- •1. Катаболизм пуриновых нуклеотидов. Содержание мочевой кислоты в сыворотке крови в норме и причины его повышения. Подагра.
- •2. Инсулин: химическая природа, локализация биосинтеза, схема синтеза, механизм действия, органы-мишени, биологические эффекты.
- •Билет 21
- •1. Схема переваривания пищевых липидов в жкт: этапы, субстраты, ферменты, роль продуктов гидролиза, роль жёлчных кислот.
- •2. Особенности метаболизма и энергетического обмена в клетках поперечно-полосатой мускулатуры и миокарда.
- •Билет 22
- •1. Этапы катаболизма жирных кислот: реакции, ферменты. Энергетический эффект полного окисления с16:0. Регуляция процесса β-окисления вжк.
- •2. Активные формы кислорода (афк). Биологическое действие афк. Ферментативные и неферментативные системы, генерирующие афк.
- •Билет 23
- •1. Анаэробный распад глюкозы (анаэробный гликолиз). Судьба продуктов гликолиза в анаэробных условиях. Биологическое значение анаэробного распада глюкозы. Цикл Кори.
- •Билет 23-2 ???
- •Билет 24
- •1. Биологическое значение и структуры кетоновых тел. Синтез кетоновых тел в печени; регуляция синтеза. Представление о кетонемии, кетонурии и кетоацидозе.
- •2. Биохимические механизмы адаптации к голоданию, типы голодания. Фазы полного голодания. Изменение гормонального статуса и метаболизма при голодании.
- •1. Обмен углеводов
- •2. Обмен жиров
- •Билет 25
- •1. Схема синтеза глицеролфосфолипидов. Особенности строения глицерофосфолипидов в функционировании сурфактанта легкого.
- •2. Кальцитриол: химическая природа, этапы синтеза, механизм действия, органы-мишени, биологические эффекты. Представление о заболевании «рахит».
- •Билет 25-2 ???
- •Билет 26
- •2. Адреналин: химическая природа, механизм действия, органы-мишени, биологические эффекты екты.
- •Билет 27
- •1. Функции клеточного метаболизма. Понятие о процессах катаболизма и анаболизма. Стадии генерирования энергии по Кребсу.
- •2. Ферментативные системы антирадикальной защиты. Катализируемые реакции.
- •Билет 28
- •1. Синтез креатина, креатинфосфата, креатинина. Функции этих соединений в организме.
- •2. Типы переваривания. Функции жкт как пищеварительно-транспортного конвейера. Функции слюны. Функции желчных кислот.
- •Билет 29
- •1. Этапы биосинтеза жирных кислот: реакции, ферменты. Регуляция процесса биосинтеза вжк.
- •2. Гормоны щитовидной железы: химическая природа и структура, этапы биосинтеза.
- •Билет 30
- •1. 1. Пентозо-фосфатный путь (пфп) окисления глюкозы. Биологическое значение.
- •Билет 31
- •Билет 32
- •Билет 33
- •Билет 34 (не точно)-1
- •1. Распад гликогена в печени и скелетных мышцах. Регуляция этих процессов.
- •2. Повреждающее действие первичных и вторичных продуктов пероксидного окисления на мембраны и другие структуры клетки.
- •Билет 34 (не точно)-2
- •Билет 35
- •1. Классификация лп. Структура и состав липопротеидных частиц. Апобелки и их функции. Ферменты, участвующие в метаболизме лп. Индекс атерогенности.
- •2. Биологическая роль печени в регуляции углеводного обмена. Обмен фруктозы и галактозы.
- •2. Роль печени в пигментном обмене. Виды желтух и причины их возникновения. Физиологическая желтуха новорожденных.
- •Билет 36
- •1. Структура и функции холестерина в организме человека. Фонд, пути использования в организме и выведения холестерина. Биосинтез холестерина, метаболическая и гормональная регуляция.
- •2. Предсердный натрийуретический фактор (пнф): химическая природа, механизм действия, органы-мишени, биологические эффекты.
- •Билет 37
- •1 Комплекс. Надн-КоQ-оксидоредуктаза
- •2 Комплекс. Фад-зависимые дегидрогеназы
- •3 Комплекс. КоQ-цитохром с-оксидоредуктаза
- •4 Комплекс. Цитохром с-кислород-оксидоредуктаза
- •1. Разобщители цпэ.
- •Билет 38
- •Билет 39
- •1. Этапы аэробного гликолиза
- •Билет 40
- •Билет 41 ???
- •Билет 42
1 Стадия облучения билирубина в коже с образованием люмирубина.
2 Стадия. Люмирубин попадает в кровь и выводится с жёлчью и мочой.
3 стадия. В это время новый билирубин из крови поступает в кожу. В итоге цикличность поступления приводит к выравниванию уровня билирубина в крови.
3) эндотелиальный (или эпидермальный) фактор роста. Рецепторы
4) Ацетилсалициловая кислота (аспирин) широко применяется
как противовоспалительное и жаропонижающее средство. Как связан механизм действия аспирина с указанными эффектами?
Ацетилсалициловая кислота – неконкурентный, необратимый ингибитор фермента циклооксигеназы, контролирующего ключевой этап превращения полиеновых жирных кислот (в основном, арахидоновой [20:4, ω-6], в меньшем количестве эйкозапентаеновой [20:5, ω-3] и эйкозатриеновой [20:3, ω-6] кислот) в эйкозаноиды, многие из которых являются медиаторами воспаления.
Билет 11
1) Синтез гликогена в печени и скелетных мышцах. Регуляция процесса
Гликоген – резервный полисахарид животных тканей, в наибольшей мере содержится в печени и мышцах, Структурно он схож с амилопектином, но вопервых, длина веточек меньше – 11-18 остатков глюкозы, во-вторых, более разветвлен – через каждые 8-10 остатков. За счет этих особенностей гликоген более компактно уложен, что немаловажно для животной клетки
Синтез гликогена:
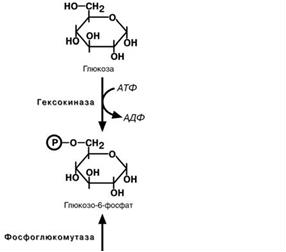
Синтез гликогена начинается с образования глюкозо -6 -фосфата под действием глюкокиназы в печени или других гексокиназ в остальных тканях. Как уже говорилось, глюкокиназа обладает низким сродством к глюкозе и в гепатоцитах глюкоза будет задерживаться только при высоких концентрациях ее в клетке.
Непосредственно же синтез гликогена осуществляют следующие ферменты:
Фосфоглюкомутаза – превращает глюкозо-6-фофат в глюкозо-1-фофат;
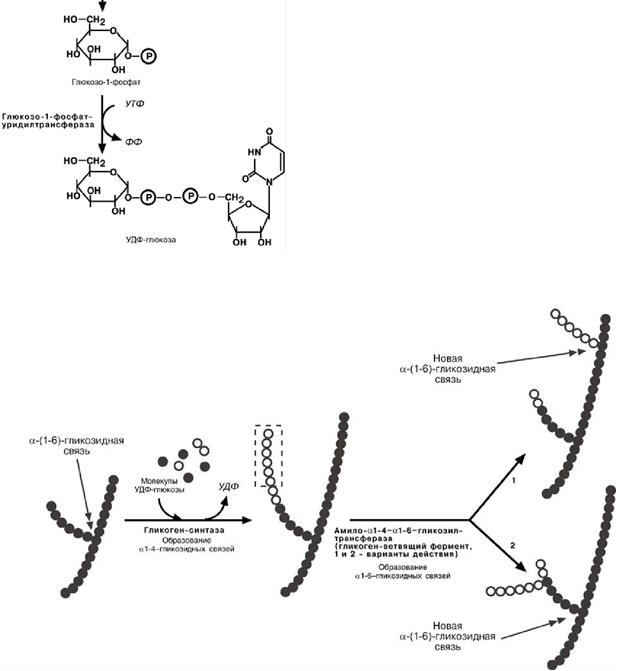
Глюкозо-1-фосфат-уридил-трансфераза – фермент,
осуществляющий ключе-вую реакцию синтеза.
Необратимость этой реакции обеспечивается гидролизом образующегося дифосфата;
Гликогенсинтаза – образует α-1-4-гликозидные связи;
Амило-α-1.4-α-1,6-гликозил-транс-фераза, гликогенветвящий фермент –
переносит фрагмент с минимальной длиной в 6 остатков глюкозы на эту же или соседнюю цепь с образованием α-1-6-гликозидной связи.
– Образование глюкозо-6-фосфата – в печени под действием глюкокиназы, а в других тканях под действием гексокиназы глюкоза фосфорилируется и превращается в глюкозо-6-фосфат (реакция необратимая).
– Превращение глюкозо-6-фосфата в глюкозо-1-фосфат Под действием фосфоглюкомутазы из глюкозо-6-фосфата образуется глюкозо-1-фосфат (реакция обратимая).
– Образование УДФ-глюкозы – глюкозо-1-фосфат взаимодействует с УТФ под действием УДФГ-пирофосфорилазы и образуется УДФ-глюкоза и пирофосфат (реакция обратимая)
– Удлинение цепи гликогена начинается с включения в работу фермента гликогенина: УДФ-глюкоза взаимодействует с ОН группой тирозина в составе фермента гликогенина (УДФ отщепляется и в дальнейшем при перефосфорилировании вновь дает УТФ). Затем гликозилированный гликогенин взаимодействует с гликогенсинтазой, под действием которой к первому остатку глюкозы через 1-4 связь присоединяется еще до 8 молекул УДФ-глюкозы. При этом УДФ отщепляется (реакции см. стр. 123 - Биохимия в схемах и рисунках, 2изд. – Н.Р. Аблаев).
- Ветвление молекулы гликогена – под действием амило(14)(16)трансглюкозидазы происходит образование альфа(16)-гликозидной связи (см. пленку, не списывать).
РЕГУЛЯЦИЯ ОБМЕНА ГЛИКОГЕНА
Ферменты метаболизма гликогена активны либо в фосфорилированной, либо в дефосфорилированной форме:
Фосфорилаза гликогена активируется после присоединения фосфатной группы (см выше),
синтаза гликогена после присоединения фосфата инактивируется.
Таким образом, осуществляется реципрокная
(взаимоисключающая) регуляция:
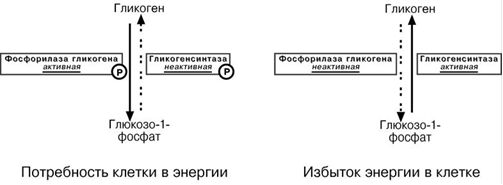
при работе клетки и/или гормональных влияниях активируется протеинкиназа и, как следствие, активируется фосфорилаза гликогена и ингибируется гликогенсинтаза. Идут реакции катаболизма глюкозы, и образуется энергия.
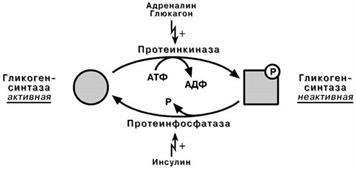
при отдыхе или в покое работают протеин-фосфатазы, которые освобождают ферменты от фосфорной кислоты: в результате гликогенфосфорилаза дефосфорилируется и становится не активной, активируется гликоген-синтаза. Начинается запасание глюкозы в виде гликогена.
2) Антисвёртывающая и фибринолитическая системы крови.
Существуют 2 противосвертывающие системы:
1. Естественные антикоагулянты, которые обеспечивают нейтрализацию небольшого избытка протромбина на местном уровне, без привлечения других систем организма. Сюда же входят клетки макрофаги, которые способны поглощать факторы свертывания.
2. Включается через рецепторные окончания, избытком тромбина в крови. Рефлекторно повышается выделение естественных антикоагулянтов и активаторов фибринолиза.
Сохранение крови в жидком состоянии определяется наличием в кровотоке естественных веществ, обладающих антикоагулянтной активностью, к ним относятся:
- антитромбин-3 (механизм его действия - блокада тромбина);
- гепарин (механизм его действия – снижение адгезии и агрегации тромбоцитов);
- 2 – Макроглобулин (прогрессивный ингибитор тромбина, плазмина и трипсина)
- Протеины С, S и другие антикоагулянты.
Фибринолиз - это гидролиз фибрина в составе тромба с образованием растворимых пептидов, которые удаляются из кровотока. Формирование фибринового тромба сопровождается осаждением на нем профермента плазминогена и его активаторов. Неактивный плазминоген синтезируется в печени и поступает в кровь. В крови он превращается в активный фермент плазмин частичным протеолизом.
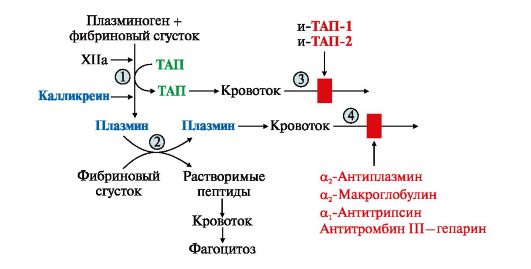
1 - плазминоген под действием активаторов (ТАП, калликреина, урокиназы, фактора XIIa) частичным протеолизом превращается в плазмин; 2 - плазмин гидролизует фибрин с образованием растворимых пептидов; 3 - ТАП поступает в кровоток и ингибируется специфическими ингибиторами I и II типа; 4 - плазмин ингибируют неспецифические ингибиторы сериновых протеаз
3) Маркеры заболеваний бронхолёгочной системы. Механизмы повреждающего действия полимеров α1-антитрипсина.
Задача. При генетическом дефекте пируваткиназы в эритроцитах у больных наблюдается гемолиз. Какое значение для эритроцитов имеет метаболический путь, в котором участвует пируваткиназа? Как связаны между собой дефект этого фермента и гемолиз?
Пируват-киназа – один из ключевых ферментов гликолиза – единственного метаболического пути, обеспечивающего эритроцит энергией. Энергодефицит приводит к нарушению активного транспорта электролитов, увеличивается проницаемость мембраны, и наступает осмотический гемолиз.
