
- •Часть 1
- •Поступательного движения:
- •Вращательного движения:
- •Вращательного движения:
- •Движениями
- •Вращательного движений
- •§ 1.3 Основы релятивистской механики
- •Гармонических колебаний
- •Одинаковой частоты
- •Раздел 2 «Молекулярная физика и термодинамика»
- •§ 2.2. Изопроцессы
- •§ 2.3. Основы термодинамики
§ 2.3. Основы термодинамики
Термодинамика (ТД)- раздел физики, изучающий свойства физических систем, находящихся в состоянии термодинамического равновесия, и процессы перехода между этими состояниями.
Термодинамическая система - совокупность макроскопических тел, которые могут взаимодействовать между собой и внешней средой посредством теплообмена.
Макроскопические параметры - величины, характеризующие состояние макроскопических тел без учета молекулярного строения тел (p, V,Т);
Теплообмен (теплопередача) - процесс передачи энергии от одного тела к другому без совершения работы. Энергия передается от более нагретых тел к менее нагретым.
Виды теплообмена: конвекция, теплопроводность, тепловое излучение.
● конвекция - перенос энергии потоками жидкости или газа;
● теплопроводность - непосредственный обмен энергией между хаотически движущимися частицами взаимодействующих тел или частей одного и того же тела;
● тепловое излучение - электромагнитное излучение, испускаемое веществом за счет расхода собственной внутренней энергии; тепловое излучение присуще газам, жидкостям и твердым телам;
Температура - физическая величина, которая характеризует степень нагретости тела;
● с точки зрения ТД - температура является величиной, характеризующей направление теплообмена;
● с точки зрения молекулярно-кинетической теории (МКТ) - температура есть величина, характеризующая среднюю кинетическую энергию поступательного движения молекул идеального газа.
Первый закон термодинамики - количество теплоты Q, сообщенное термодинамической системе, расходуется на изменение внутренней энергии ΔU системы и на совершение системой механической работы A
![]()
Изменение внутренней энергии - в ТД процессе изменение внутренней энергии идеального газа определяется только изменением его температуры и не зависит от характера этого процесса
![]()
|
Внутренняя энергия U [Дж] |
➨ сумма кинетической энергии теплового движения молекул (атомов) и потенциальной энергии их взаимодействия.
| |
|
● внутренняя энергия одноатомного идеального газа
|
➨ равна сумме средних кинетических энергий поступа-тельного движения молекул, составляющих газ:
( | |
|
● изменение внутренней энергии
|
|
➨ в ТД процессе изменение внутренней энергии идеаль-ного газа определяется только изменением его темпера-туры и не зависит от характера этого процесса.
|
|
● cпособы изменения внутренней энергии |
➨ 1) теплообмен (нагревание или охлаждение газа); 2) совершение работы ( сжатие или расширение газа). | |
|
Количество теплоты Q [Дж] |
➨ мера изменения внутренней энергии тел при теплообмене; ➨ калория – внесистемная единица количества теплоты: 1 кал = 4,1868 Дж; 1 ккал = 4186,8 Дж | |
|
● теплоемкость вещества
|
➨ физическая величина, численно равная количеству теплоты Q, которое необходимо сообщить телу для нагревания его на один градус (10С или 1 К). | |
|
● удельная теплоемкость вещества
|
➨ количество теплоты Q, подводимое к веществу массой 1 кг для изменения его температуры на один градус (10С или 1 К); ➨одно и то же вещество, находящееся в разных агрегат-ных состояниях, имеет разную удельную теплоемкость, например, сльда=2100 Дж/кг·К; своды=4200 Дж/кг·К | |
|
● теплота нагревания
|
► с – удельная теплоемкость вещества;
► формула справедлива в пределах одного агрегатного состояния вещества; | |
|
● молярная теплоемкость
|
➨ количество теплоты, подводимое к одному молю вещества для изменения его температуры на один градус(10С или 1 К); | |
|
● закон сохранения количества теплоты (уравнение
теплового баланса)
|
➨ в
процессе теплообмена количество
теплоты
| |
|
● пример уравнения теплового баланса
с1m1(T1- |
➨ описывает
состояние теплового равновесия двух
тел с удельной теплоемкостью, массой
и начальной температурой с1,m1,T1
и с2,m2,T2
соответственно и установившейся
промежуточной общей температурой
| |
|
Работа в термодинамике |
➨ находящийся
в сосуде газ оказывает на поршень
площадью S
давление р=F/S,
под действие которого поршень
перемещается на расстояние
| |
|
● знак
работы
|
| |
|
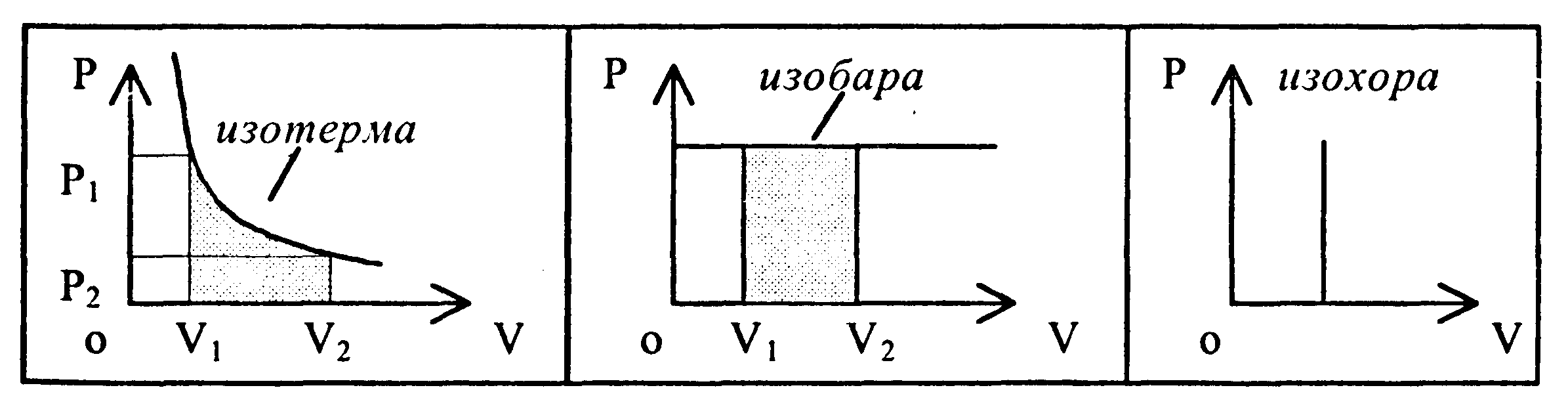
Работа в изопроцессах: | ||
|
● изотермический процесс
|
➨
| |
|
● изобарный процесс |
➨
| |
|
● изохорный процесс |
➨ А=0 | |
|
Графическое изображение работы |
| |
|
Закон сохранения энергии в тепловых процессах |
➨ во всех процессах, происходящих в природе, энергия не исчезает и не создается, а переходит от одного тела к другому и превращается из одного вида в другой в эквивалентных количествах. | |
|
Первый закон термодинамики
|
➨ количество теплоты Q, сообщенное термодинамической системе, расходуется на изменение внутренней энергии ΔU системы и на совершение системой механической работы A. | |
|
● вечный двигатель первого рода |
➨ нельзя построить периодически действующий двига-тель, который совершал бы работу большую, чем та энер-гия, которая подводится к двигателю извне.
| |
|
Применение первого закона ТД к изопроцессам: | ||
|
● изотермический процесс
|
➨
| |
|
● изобарный процесс
|
➨
| |
|
● изохорный процесс
|
➨
| |
|
● адиабатный процесс
|
➨
| |
|
Необратимость тепловых процессов |
➨ необратимыми называются такие процессы, которые могут самопроизвольно протекать только в одном направ-лении – от горячего тела к холодному; в обратном направ-лении они могут протекать только как одно из звеньев более сложного процесса. Все реальные процессы – необратимые, протекают с невосполнимой потерей энер-гии на нагрев окружающей среды, преодоление сил трения.
| |
|
Второй закон термодинамики |
➨ исторически открытие второго закона ТД было связано с изучением вопроса о максимальном КПД тепловых машин, проведенным французским ученым С. Карно. Позднее Клаузиус и Кельвин предложили различные по виду, но эквивалентные формулировки второго закона ТД. | |
|
● формулировка Клаузиуса |
➨ невозможен круговой процесс, единственным результа-том которого является передача теплоты от менее нагре-того тела к более нагретому; | |
|
● формулировка Кельвина |
➨ невозможен круговой процесс, единственным результа- том которого является превращение теплоты, получен-ной от нагревателя, в эквивалентную ей работу. | |
|
● вечный двигатель второго рода |
➨ невозможно построить периодически действующую ма-шину, которая целиком превращала бы в работу теплоту, извлекаемую из окружающих тел (океана, атм. воздуха).
| |
|
Статистическое обоснование второго закона ТД |
➨ второй закон термодинамики является статистическим законом и описывает закономерности хаотического дви-жения большого числа частиц, составляющих замкнутую систему. | |
|
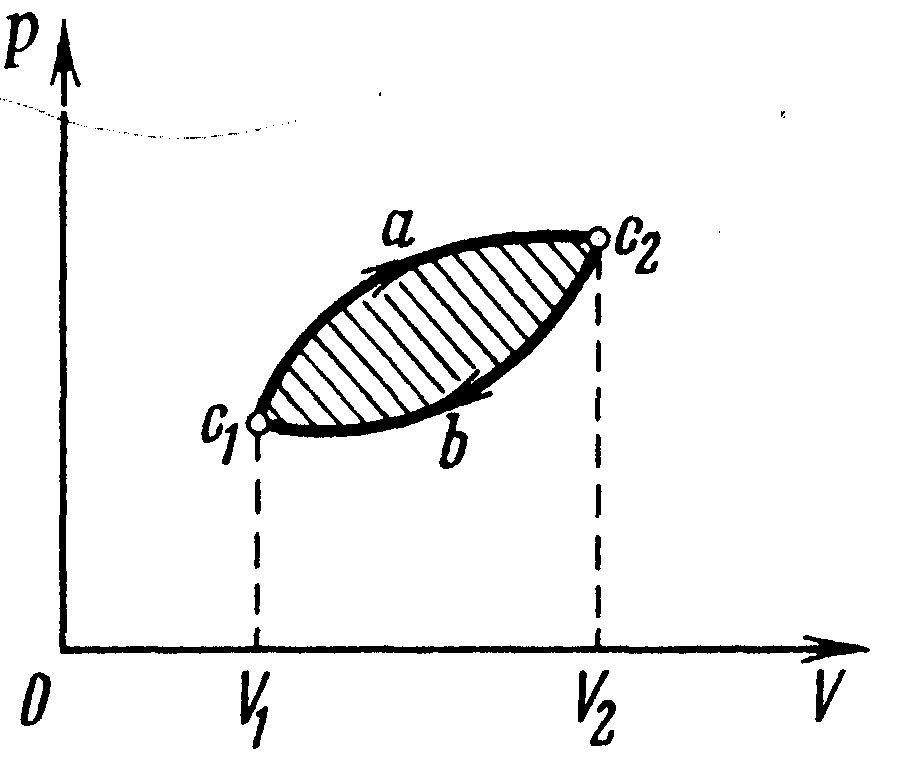
Круговой процесс (цикл)
|
➨ термодинамический процесс, в результате совершения которого рабочее тело возвращается в исходное состояние; ➨ на диаграммах состояния p-V, p-T и др. изображаются в виде замкнутых кривых; ➨ круговые процессы являются физической основой ра-боты тепловых двигателей; | |
|
● прямой цикл |
➨ круговой процесс, в котором рабочее тело совершает положительную работу за счет сообщенной ему теплоты; ➨ на
диаграмме
прямой цикл изображен замкнутой
кривой, которая обходится по часовой
стрелке ( | |
|
● обратный цикл |
➨ круговой процесс, в котором рабочее тело совершает отрицательную работу, т.е. над рабочим телом совершается и от него отводится равное количество теплоты; ➨на
диаграмме
обратный цикл изображен
замкнутой
кри-вой, которая обходится против
часовой стрелки ( | |
|
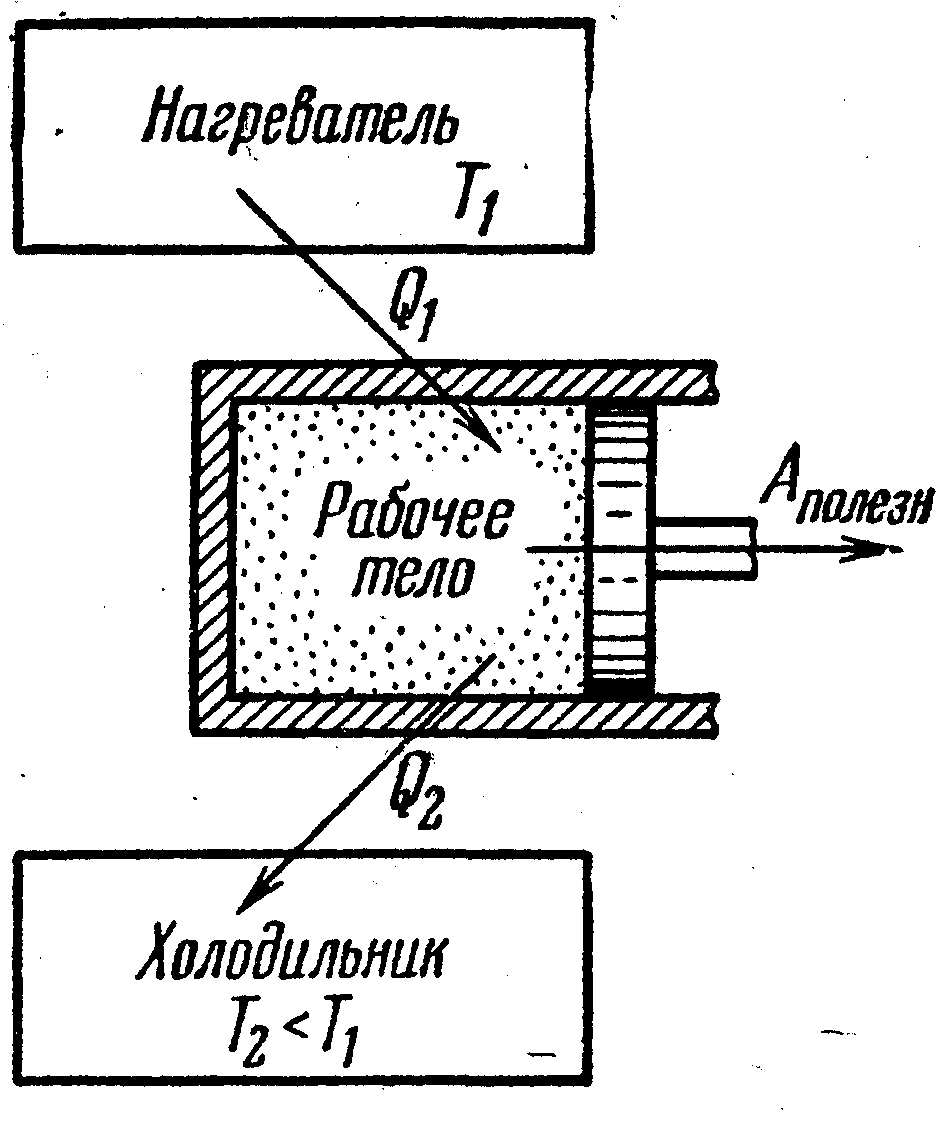
Тепловой двигатель . |
➨ периодически действующая машина, совершающая меха-ническую работу за счет получаемого извне количества теплоты; ➨ периодичность заключается в многократном повторе-нии одного и того же рабочего цикла – после расширения следует сжатие газа; ➨ реальные тепловые двигатели работают по разомкну-тому циклу: после расширения газ выбрасывается и сжи-мается новая порция; цикл может быть замкнутый, тогда расширяется и сжимается одна и та же порция газа; | |
|
● устройство теплового |
➨ Рабочее тело - газ или пар – при расширении совершает работу. Нагреватель имеет температуру Т1 и передает количество теплоты Q1 рабочему телу. При сжатии рабочее тело передает холодильнику количество теплоты Q2; температура холодильника Т2 меньше температуры нагревателя Т1; роль холодильника часто играет атмосфера. Из закона сохранения энергии следует, что работа, совершаемая тепловой машиной за один цикл, равна:
| |
|
● КПД теплового двигателя
|
➨ отношение работы А, совершенной тепловым двигателем, к количеству теплоты Q1, полученному от нагревателя. | |
|
● идеальный тепловой двигатель |
➨ двигатель, не имеющий потерь на механическое трение и работающий по особому круговому циклу, называемому циклом Карно. | |
|
Изотермы - 1-2; 3-4 Адиабаты - 2-3; 4-1 |
➨ представляет собой идеализацию цикла реальной теп-ловой машины; рабочим телом является идеальный газ; цикл является прямым обратимым круговым процессом, состоящим из двух изотерм и двух адиабат. ➨ ( ➨ ( ➨ при адиабатном расширении и сжатии, энергия извне к рабочему телу не поступает и эти процессы происходят за счет изменения его внутренней энергии. | |
|
КПД идеального теплового двигателя
|
➨ увеличение КПД зависит от разности между темпера-турами нагревателя Т1 и холодильника Т2 и не зависит от свойств рабочего тела и конструкции двигателя. | |
|
Основные виды тепловых двигателей |
➨ по способам получения механического движения под-разделяются на: | |
|
● поршневые
|
➨ паровые машины (КПД до 20%); ➨ двигатели внутреннего сгорания: ▪ карбюраторные (КПД- 18-24%) – создал в 1867г. Н. Отто, применяются в настоящее время; ▪ дизели (КПД - 30-39%) - создал в 1897г. Р.Дизель, применяются в настоящее время; | |
|
● ротационные
|
➨ паровая (КПД до 43% ); ➨ газовая турбина (КПД – до 34%); | |
|
● реактивные |
➨ ракетные двигатели, воздушно-реактивные (КПД до 42%); | |


 двигателя
двигателя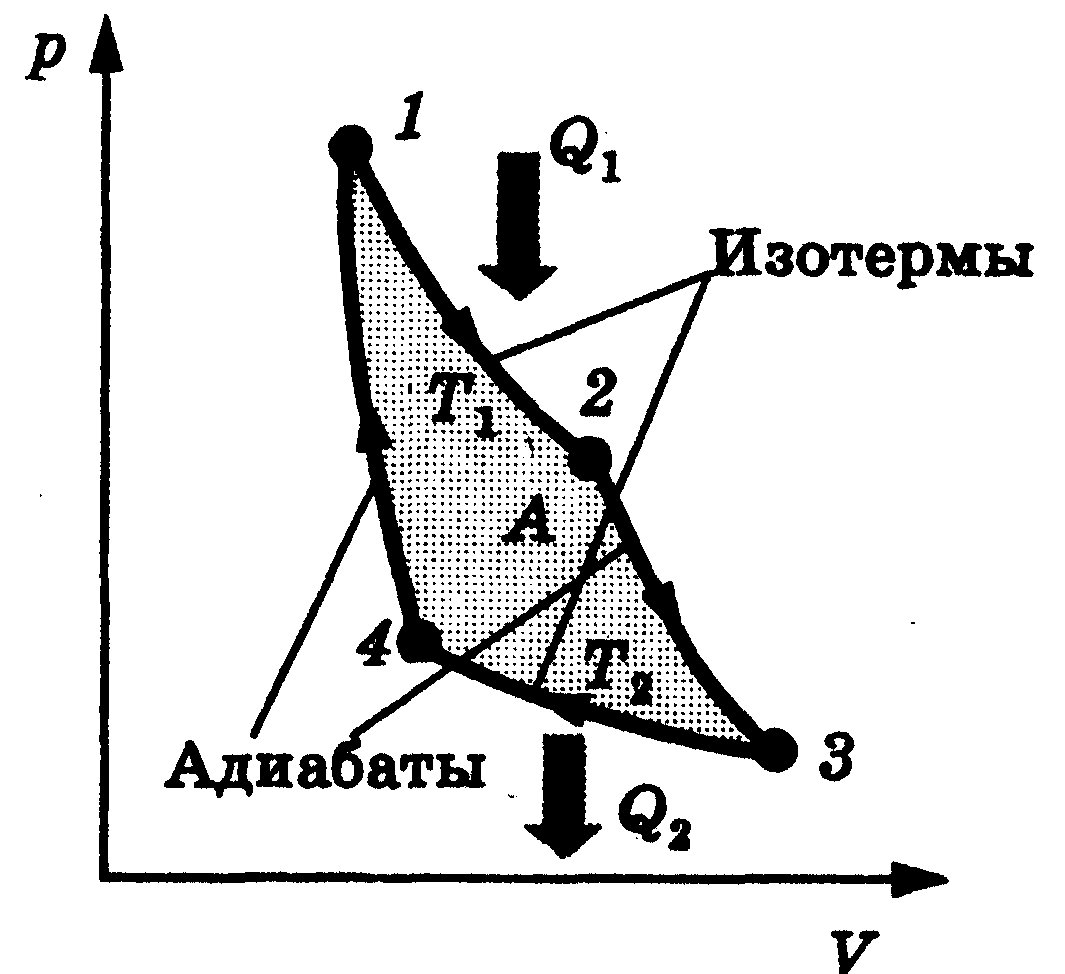 Цикл
Карно
Цикл
Карно