- •Тема: Введение в биохимию. Ферменты: строение, свойства, локализация, номенклатура и классификация
- •Строение ферментов
- •1. Оксидоредуктазы
- •2. Трансферазы
- •4. Лиазы
- •5. Изомеразы
- •6. Лигазы (синтетазы)
- •Лекция № 2
- •Тема: Регуляция активности ферментов в клетке.
- •Общие представления о гормонах и
- •Их роли в регуляции активности ферментов.
- •2 Курс.
- •1). Аллостерическая регуляция каталитической активности ферментов
- •III. Механизмы регуляции количества ферментов
- •Клеточная сигнализация
- •Рецепторы
- •Участие рецепторов в трансмембранной передаче сигнала
- •3). Рецепторы, сопряженные с g-белками (gpcr от англ. G – protein coupled receptor), по строению их еще называют серпантинными.
- •Регуляторные белки
- •Вторичные посредники (мессенджеры)
- •Ферменты
- •Трансмембранная передача информации с участием аденилатциклазной системы
- •Аденилатциклазная система активируется:
- •Инозитолтрифосфатная система активируется:
- •Трансмембранная передача информации с участием гуанилатциклазной системы
- •Трансмембранная передача информации с участием цитоплазматических и ядерных рецепторов
- •Лекция № 3 Тема: Медицинская энзимология
- •2 Курс.
- •I. Энзимопатология
- •1. Наследственные энзимопатии
- •Наследственные энзимопатии по типу нарушений метаболизма делят на:
- •2. Приобретенные энзимопатии
- •II Энзимодиагностика
- •1) Определение активности органо-, органеллоспецифических ферментов и их изоферментов.
- •2) Определение активности ферментов и их констант (Km, t, pH).
- •3) Определение концентрации органических веществ с помощью ферментов.
- •III Энзимотерапия
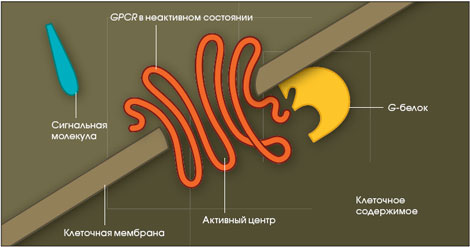
3). Рецепторы, сопряженные с g-белками (gpcr от англ. G – protein coupled receptor), по строению их еще называют серпантинными.
Это мономерные интегральные мембранные белки, полипептидная цепь которых 7 раз пронизывает клеточную мембрану. Внеклеточный домен GPCR обеспечивает взаимодействие с гормоном, а внутриклеточный - контакт с G-белками. В настоящее время открыто более 200 видов GPCR. К GPCR относятся: α и β рецепторы. К GPCR присоединяются: адреналин (рецепторы α1 и α2, β1 и β2), ацетилхолин (рецепторы М1, М2, М3, М4), серотонин (1А, 1В, 1С, 2), дофамин (Д1 и Д2), АКТГ, ТТГ, ФСГ, ЛГ, хорионический гонадотропин, простагландины, гастрин, холецистокинин, нейропептид Y, нейромедин К, вазопрессин, ангиотензин, вещество К, вещество Р, или нейрокинин 1, 2 и 3 типа, тромбин, интерлейкин-8, глюкагон, кальцитонин, секретин, соматолиберин, ВИП, гипофизарный аденилатциклазактивирующий пептид, глютамат (MG1 – MG7), аденин. |
|
|
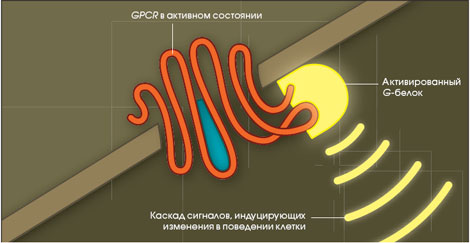
GPCR через G-белки активируют аденилатциклазную и инозитолтрифосфатную системы. GPCR инактивируются:
путем ухода сигнальной молекулы из активного центра рецептора;
путем фосфорилирования рецепторов протеинкиназами и последующего присоединения специального белка (например, β-аррестин);
GPCR участвуют почти во всех жизненно важных процессах, протекающих в организме: они поддерживают работу сердца, органов пищеварения и дыхания, мозговую деятельность.
Примерно половина современных лекарств взаимодействуют с GPCR.
4). Ядерные и цитоплазматические рецепторы. Находятся в цитоплазме или ядре, при взаимодействии с гормоном, образуют комплекс, который присоединяется к регуляторной нуклеотидной последовательности в ДНК, изменяет доступность промотора для РНК-полимеразы, соответственно меняет скорость транскрипции мРНК и трансляции новых ферментов.
Ядерные и цитоплазматические рецепторы содержат ДНК-связывающий домен, характеризующийся наличием двух структур «цинковых пальцев». Особенностью цитоплазматических рецепторов является связь с белком-шапероном, который стабилизирует их структуру.
Разные клетки организма, в зависимости от функций, имеют определенный набор рецепторов. На мембране одной клетки может быть более десятка разных типов рецепторов.
Регуляторные белки
G-белки - универсальные посредники, передающие сигнал от рецепторов к ферментам клеточных мембран.
В настоящее время известно более 50 G-белков:
Gs-белок активирует аденилатциклазу. Масса 80000-90000Да.
Gi-белок ингибирует аденилатциклазу. Масса 80000-90000Да. Через рецептор, активируется соматостатином.
Gq-белок активирует фосфолипазу С.
G-белки влияют на активность фосфодиэстеразы, фосфолипазы А2, некоторые типы Са2+- и K+-каналов.
G-белки также обеспечивают передачу сигнала в сенсорных клетках (фоторецепторных, обонятельных и вкусовых): Свет → родопсин → Gt → ФДЭцГМФ → (цГМФ→ГМФ)
G-белки олигомеры, состоят из 3 субъединиц α, β, γ.
β-субъединицы (35000 Да) у Gs- и Gi-белков одинаковы.
α- субъединицы (41000 Да у Gi, 45000 Да у Gs) кодируются разными генами и обеспечивают специфический ответ (“+” или “-”).
|
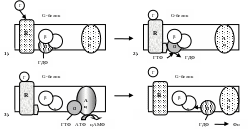
1). Гормон (Г), взаимодействуя с рецептором (R), изменяет его конформацию. 2). Гормон-рецепторный комплекс, взаимодействуя с G-белком, уменьшает у α-субъединицы (α) сродство к ГДФ и увеличивает сродство к ГТФ. 3). Присоединение ГТФ к α-субъединице (в присутствии Mg2+) вызывает в G-белке изменение конформации и диссоциацию его на субъединицы: α-субъединицу (α-ГТФ) и димер βγ. α-ГТФ имеет высокое сродство к аденилатциклазе (Ац), его присоединение приводит к активации последней. 4). α-субъединица катализирует распад ГТФ до ГДФ + Фн. α-ГДФ имеет низкое сродство к Ац и высокое к димеру βγ. Отделение α-ГДФ от Ац инактивирует последнюю.
|
STAT белки.