
- •Тема: Введение в биохимию. Ферменты: строение, свойства, локализация, номенклатура и классификация
- •Строение ферментов
- •1. Оксидоредуктазы
- •2. Трансферазы
- •4. Лиазы
- •5. Изомеразы
- •6. Лигазы (синтетазы)
- •Лекция № 2
- •Тема: Регуляция активности ферментов в клетке.
- •Общие представления о гормонах и
- •Их роли в регуляции активности ферментов.
- •2 Курс.
- •1). Аллостерическая регуляция каталитической активности ферментов
- •III. Механизмы регуляции количества ферментов
- •Клеточная сигнализация
- •Рецепторы
- •Участие рецепторов в трансмембранной передаче сигнала
- •3). Рецепторы, сопряженные с g-белками (gpcr от англ. G – protein coupled receptor), по строению их еще называют серпантинными.
- •Регуляторные белки
- •Вторичные посредники (мессенджеры)
- •Ферменты
- •Трансмембранная передача информации с участием аденилатциклазной системы
- •Аденилатциклазная система активируется:
- •Инозитолтрифосфатная система активируется:
- •Трансмембранная передача информации с участием гуанилатциклазной системы
- •Трансмембранная передача информации с участием цитоплазматических и ядерных рецепторов
- •Лекция № 3 Тема: Медицинская энзимология
- •2 Курс.
- •I. Энзимопатология
- •1. Наследственные энзимопатии
- •Наследственные энзимопатии по типу нарушений метаболизма делят на:
- •2. Приобретенные энзимопатии
- •II Энзимодиагностика
- •1) Определение активности органо-, органеллоспецифических ферментов и их изоферментов.
- •2) Определение активности ферментов и их констант (Km, t, pH).
- •3) Определение концентрации органических веществ с помощью ферментов.
- •III Энзимотерапия
6. Лигазы (синтетазы)
Соединение 2 молекул с использованием энергии макроэргических соединений (АТФ и др). В реакцию вступают 3 вещества, образуется 3 вещества.
Систематическое название субстрат: субстрат–лигаза (источник энергии)
АТФ + L-глутамат + NH4+ → АДФ + Фн + L-глутамин
Систематическое название: L-глутамат: аммиак–лигаза (АТФ → АДФ + Фн)
Тривиальное название: глутаминсинтетаза
АТФ + ПВК + СО2 → АДФ + Фн + ЩУК
Систематическое название: ПВК: СО2–лигаза (АТФ → АДФ + Фн)
Тривиальное название: пируваткарбокилаза
Лекция № 2
Тема: Регуляция активности ферментов в клетке.
Общие представления о гормонах и
Их роли в регуляции активности ферментов.
Факультеты: лечебно-профилактический, медико-профилактический, педиатрический.
2 Курс.
Одним из важнейших свойств живых организмов является способность к поддержанию гомеостаза. Гомеостаз в организме поддерживается за счет регуляции скорости ферментативных реакций. Эта регуляция осуществляется:
I). Доступностью молекул субстрата и кофермента;
II). Изменением каталитической активности молекул фермента;
III). Изменением количества молекул фермента.
I. Доступность молекул субстратов обеспечивается контролируемой работой трансмембранных транспортных систем. Например, количество в мембране ГЛЮТов (трансмембранных переносчиков глюкозы) определяет скорость поступления глюкозы в цитоплазму клеток и скорость метаболических процессов, в которых она используется (гликолиз, ПФШ, гликогенез).
Доступность коферментов зависит от скорости их регенерации. В результате, чем больше концентрация исходного субстрата и регенерированных коферментов, тем выше скорость метаболического пути. Например, дефицит НАД+ лимитирует реакции ЦТК.
II. Регуляция каталитической активности ферментов. Бывает:
1). Неспецифическая регуляция. В связи с лабильностью всех ферментов, их каталитическая активность зависит от температуры, рН и давления.
2). Специфическая регуляция. Под действием специфических активаторов и ингибиторов изменяется активность регуляторных ферментов, которые контролируют интенсивность метаболических процессов в организме.
Механизмы специфической регуляции каталитической активности ферментов:
1). Аллостерическая регуляция;
2). Регуляция с помощью белок-белковых взаимодействий;
3). Регуляция через ковалентную модификацию.
а). Регуляция путем фосфорилирования/дефосфорилирования фермента;
б). Регуляция частичным протеолизом.
1). Аллостерическая регуляция каталитической активности ферментов
Аллостерическими ферментами называют ферменты, активность которых регулируется обратимым нековалентным присоединением модулятора (активатора и ингибитора) к аллостерическому центру. Ингибиторами аллостерических ферментов часто являются конечные продукты метаболических путей, активаторами – их начальные субстраты.
Активирование происходит по принципу прямой положительной связи, а ингибирование - по принципу отрицательной обратной связи.
Аллостерические ферменты играют важную роль в регуляции т.к. чрезвычайно быстро реагируют на изменения среды.
Например, конечный продукт катаболизма глюкозы АТФ ингибирует аллостерически ферменты гликолиза фосфофруктокиназу и пируваткиназу. Накапливаемая в гликолизе фруктоза-1,6-ф активирует пируваткиназу, что ускоряет реакции гликолиза.
2). Регуляция каталитической активности ферментов с помощью белок-белковых взаимодействий. Выделяют 2 механизма:
а). Активация ферментов в результате присоединения регуляторных белков. Например, аденилатциклаза (Ац), которая катализирует превращение АТФ в цАМФ, активируется присоединением α-субъединицы G-белка. Этот механизм регуляции обратим.
б). Регуляция каталитической активности ферментов ассоциацией/диссоциацией протомеров. Например, протеинкиназа А, активируется при диссоциации ее тетрамера на 4 субъединицы и инактивируется при обратном соединении 4 субъединиц в тетрамер.
3). Регуляция каталитической активности ферментов путем их ковалентной модификации. Регуляция активности фермента осуществляется в результате ковалентного присоединения или отщепления от него фрагмента. Она бывает 2 видов:
а). путем фосфорилирования и дефосфорилирования ферментов;
б). путем их частичного протеолиза.
а). Регуляция каталитической активности ферментов путем их фосфорилирования и дефосфорилирования. Фосфорилирование осуществляется протеинкиназами (ПК) по ОН-группе серина, треонина или тирозина регуляторный белков и ферментов. Дефосфорилирование в этих же положениях осуществляется фосфопротеинфосфатазами (ФПФ).
Введение отрицательно заряженной фосфорной группы приводит к обратимому изменению конформации и активности фермента.
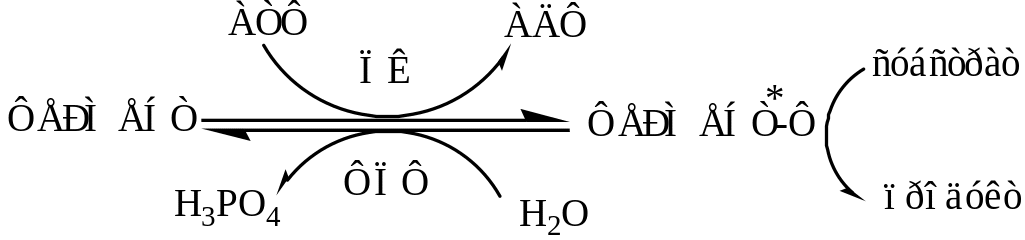
Например, под действием глюкагона и адреналина в клетках печени происходит фосфорилирование ключевых ферментов гликогенеза (гликогенсинтаза) и гликогенолиза (гликогенфосфорилаза), при этом распад гликогена активируется, а синтез ингибируется.
Инсулин наоборот вызывает в клетках печени дефосфорилирование тех же ключевых ферментов, в результате синтез гликогена активируется, а распад ингибируется.
б). Регуляция каталитической активности ферментов путем их частичного протеолиза. При участии активаторов и протеолитических ферментов происходит отщепление части молекулы фермента и его необратимая активация. Такой фермент функционирует короткий период, а затем разрушается. Подобная схема активации характерна для внеклеточных ферментов ЖКТ (пепсин, трипсин, химотрипсин и др.) и ферментов свертывающей и противосвертывающей системы крови (тромбин, фибрин, плазмин др.). Например, трипсиноген, синтезируемый в поджелудочной железе, поступает в двенадцатиперстную кишку, где энтеропептидаза кишечника отщепляет у него с N-конца гексапептид. В результате в оставшейся части молекулы фермента формируется активный центр.

