
Литература
1. Небольсин В.А., Долгачев А.А., Дунаев А.И., Завалишин М.А. Об общих закономерностях роста микро- и наноразмерных нитевидных кристаллов кремния / Известия РАН. Сер. физическая. 2008, Т. 72, № 9, с. 1285-1288.
2. Thelander C. et al. Nanowire-based one-dimensional electronics / Mater. Today, 2006. V.9. P.28-35.
3. Гиваргизов Е.И. Искусственная эпитаксия - перспективная технология элементной базы микроэлектроники.- М.: Наука, 1988. 176 с.
4. Бережной А.С. Кремний и его бинарные соединения.- Изд-во АН УССР. Киев, 1958.-256 с.
5. Хирс Д., Паунд Г. Испарение и конденсация / Пер. с англ.-М.: Наука, 1966.-248 с.
6. Термодинамические свойства индивидуальных веществ / Под ред. В.П. Глушко: В 4 т. Т.4 // М.: Наука, 1979. 340 с.
7. Небольсин В.А., Щетинин А.А. Рост нитевидных кристаллов. Воронеж: ВГУ, 2003. 620 с.
Воронежский государственный технический университет
УДК 541.183
В.П. Горшунова, А.В. Рыльков, О.В. Чибисова, В.А. Небольсин
ИЗУЧЕНИЕ ПОГЛОЩЕНИЯ АММИАКА СИНТЕТИЧЕСКИМИ НЕОРГАНИЧЕСКИМИ СОРБЕНТАМИ
Приведены результаты исследования адсорбции аммиака термически активированными силикагелями и активным оксидом алюминия (алюмогелем)
Аммиак используется в химической промышленности при производстве минеральных удобрений и азотной кислоты. Но наиболее широко он применяется в качестве хладагента в холодильных установках на предприятиях пищевой промышленности. На этих предприятиях возможны утечки газа, что является опасным как для персонала, работающего на предприятии, так и для населения близлежащих районов. Аммиак, как известно, относится к аварийно химически опасным веществам. Аварии с выбросом NH3 происходят достаточно часто. Основная опасность аммиака в большей степени обусловлена возможностью его распространения и вредного воздействия на окружающую среду и людей. Поэтому проблемы улавливания аммиака в вентиляционных выбросах, а также защиты органов дыхания во время аварийных выбросов являются очень актуальными.
Нами исследовалась поглотительная способность силикагеля и алюмогеля по отношению к аммиаку. Известно, что силикагель и алюмогель являются синтетическими полярными сорбентами, которые широко используются для поглощения влаги. Поскольку вода и аммиак имеют близкие размеры молекул (их диаметры 0,27 и 0,36 нм соответственно), а также близкие дипольные моменты (1,86 D и 1,64 D), то можно предположить, что эти сорбенты могут применяться для поглощения аммиака.
Силикагели по своей химической природе представляют собой гидратированные аморфные кремнеземы (SiO2∙nH2O), являющиеся реакционноспособными соединениями переменного состава, превращения которых происходит по механизму поликонденсации:
n Si(OH)4 → SinO2n-m + (2n-m) H2O
Поликонденсация ведет к формированию структурной сетки сфероподобных частиц коллоидных размеров (2∙10-9 - 2∙10-8 м), сохраняющейся при высушивании гидрогеля кремниевой кислоты и образующей жесткий кремнекислородный каркас. Зазоры между частицами образуют пористую структуру силикагеля. Для получения силикагелей в промышленности обычно используют метод осаждения аморфного кремнезема из силикатов щелочных металлов минеральными кислотами. Выпускают силикагель в виде шариков, таблеток или кусочков неправильной формы. Размеры их зерен составляют от 0,1 до 7,0 мм.
Объем пор силикагелей составляет 0,3 - 1,2 см3/г, их удельная поверхность находится в пределах 300 - 900 м2/г, а гравиметрическая плотность заключена в интервале 0,4 - 0,9 г/см3. Последний показатель может служить косвенной характеристикой пористой структуры силикагелей: для мелкопористых силикагелей он составляет 0,6 - 0,8 г/см3, а для крупнопористых – 0,4 - 0,6 г/см3.
На поверхности силикагелей имеются силанольные и силоксановые группы. В зависимости от степени дегидроксилирования поверхности их соотношение может сильно изменяться. В предельно гидроксилированном кремнеземе на поверхности имеется 4,6-4,8 ОН-групп/нм2 или около 8 мкмоль/м2. При этом предполагается, что вся физически сорбированная вода количественно удалена с поверхности. Для удаления физически сорбированной воды достаточно длительного прогревания кремнезема на воздухе при 120 оС. Основное значение для адсорбции силикагелей имеют реакционноспособные силанольные группы. Силанольные группы значительно более активны и легче вступают в химические реакции, чем силоксановые группы, так как протон силанольной группы имеет слабокислый характер и способен вступать в реакции обмена [1]. Силанольные группы легко образуют водородные связи с полярными молекулами.
По сорбционным свойствам к силикагелю весьма близки алюмогели, представляющие собой смеси нормального гидрата окиси алюминия [Al(OH)3] и ее полигидратов, получаемые термической обработкой гидрата окиси алюминия при температурах 600-1000оС. Получаемый сорбент (92% Al2O3) имеет поры со средним диаметром 1-3 нм, среднюю удельную поверхность 200-400 м2/г, истинную плотность 3,25-3,50 г/см3 и кажущуюся плотность 1,6 г/см3. В кристаллической структуре первичные кристаллические частицы размером 3-8 нм упакованы так, что поры, образуемые ими, имеют либо щелевидную, либо бутылеобразную форму.
Как и силикагели, активный оксид алюминия является полярным адсорбентом и проявляет склонность к образованию водородных связей вследствие наличия поверхностных гидроксильных групп.

Зависимость адсорбционной способности термически активированных сорбентов от объемной концентрации аммиака в газовой среде: 1 – силикагель марки КСКГ; 2 - силикагель марки КСМГ; 3 – алюмогель
Нами исследовалась адсорбция аммиака термически модифицированными силикагелями марок КСКГ (крупнопористым) и КСМГ (мелкопористым) и активным оксидом алюминия.
Для изучения адсорбции в эксикаторах создавали атмосферы с содержанием аммиака 5, 10, 20, 50, 100, 200 и 400 мг/м3, для чего готовили растворы аммиака различной концентрации в соответствии с данными справочника [2]. Поскольку в исследуемых условиях содержание паров воды в 1,3 - 1,6 раз меньше, чем аммиака, то преимущественно сорбируется аммиак.
Насыщение термически активированных сорбентов проводили в статических условиях, применяя гравиметрический метод [3]. Получали сначала кинетические зависимости адсорбции от времени, по которым затем строили изотермы адсорбции –зависимости адсорбции от объемной концентрации аммиака в газовой среде (см. рисунок).
Обращает на себя внимание то обстоятельство, что в одинаковых условиях эксперимента большей адсорбционной способностью по отношению к аммиаку обладает мелкопористый силикагель (примерно в 2,2 – 3 раза по сравнению с крупнопористым). Промежуточными поглотительными свойствами обладает алюмогель. Мелкопористый силикагель лучше поглощает аммиак по сравнению с алюмогелем в 1,4 раза.
Как известно [3], микропоры имеют размеры, соизмеримые с размерами адсорбируемых молекул. Эффективные радиусы пор находятся в интервале от 1,0 до 1,5 нм. В качестве верхней границы размера микропор принимают диаметр 3,0 нм. Характерной чертой адсорбции в микропорах является существенное повышение энергии адсорбции по сравнению с адсорбцией в более крупных порах. В случае поглощения газов повышение энергии адсорбции в микропорах приводит к возрастанию адсорбционной способности в области малых равновесных концентраций, что наблюдается на рисунок, кривая 2. В микропорах все атомы и молекулы вещества адсорбента находятся во взаимодействии с молекулами адсорбата. Другими словами, во всем пространстве микропор существует поле адсорбционных сил.
Кроме того, следует учитывать образование водородных связей, которыми силанольные группы удерживают полярные молекулы аммиака. Концентрация этих групп в микропорах выше, чем в макропорах, так как сама удельная поверхность микропор превышает удельную поверхность макропор. Удельная поверхность микропор составляет 550 – 900 м2/г, а удельная поверхность макропор значительно меньше, а именно – от 210 до 350 м2/г. Макропоры играют роль крупных транспортных артерий в зернах адсорбентов, так как их эффективные радиусы составляют 100 – 200 нм. В случае алюмогеля также можно предположить образование водородных связей между имеющимися на поверхности гидроксильными группами и аммиаком. Так как размер пор в алюмогеле близок к размеру пор в мелкопористом силикагеле, то площадь поверхности этих пор (200 – 400 м2/г) больше, а значит групп, способных удерживать аммиак на поверхности алюмогеля, также больше. Этим можно объяснить наблюдаемые в ходе экспериментов различия в поглотительных свойствах изученных сорбентов.
Таким образом, исследование поглотительных свойств синтетических неорганических сорбентов – силикагелей разной пористости и активного оксида алюминия (алюмогеля) – показало, что эти сорбенты, предварительно активированные термически, могут применяться с целью удерживания аммиака на своей поверхности. Причем лучшей сорбционной активностью обладает мелкопористый силикагель.
Литература
1. Модифицированные кремнеземы в сорбции, катализе и хроматографии / Под ред. Г.В. Лисичкина. – М. : Химия,1986. – 248 с.
2. Рабинович В.А. Краткий химический справочник / В.А. Рабинович, З.Я. Хавин. – С.- Пб.: Химия, 1997. – 392 с.
3. Кельцев, Н.В. Основы адсорбционной техники. – М.: Химия, 1981. – 592 с.
Воронежский государственный технический университет
УДК 574
О.Н. Болдырева
ГАЛЬВАНО – ХИМИЧЕСКИЕ МЕТОДЫ ОЧИСТКИ ПРОИЗВОДСТВЕННЫХ ВОД МАШИНОСТРОИТЕЛЬНЫХ ПРЕДПРИЯТИЙ
Наиболее распространенный в настоящее время метод очистки стоков производств химической, нефтегазовой и металлургической промышленности – реагентный, основанный на реакциях нейтрализации и окисления – восстановления
Для удаления (извлечения) металлов из различных сточных вод использования полученной воды в обороте заслуживает внимания гальванохимический метод, или как эффект микро-, макрогальванопары в очистке сточных вод. Гальванохимическая очистка (ГХО) является альтернативным, более эффективным процессом для существующих технологий удаления различных растворенных веществ их сточных вод.
Гальванохимическая очистка сточных вод позволяет в одном агрегате снижать как концентрации тяжелых металлов, общее солесодержание, так и органические примеси.
ЮНЕСКО рекомендовало метод очистки с помощью коагуляторов как наиболее эффективный в экологическом плане.
Процесс гальванохимичекой очистки и деминерализации сточных вод, основанный на использовании эффекта короткозамкнутых гальванических элементов из смеси двух или нескольких токопроводящих материалов, имеющих различные значения электрохимических потенциалов, помещенных в очищаемый раствор и образующих множество микрогальванопар без наложения тока от внешнего источника в присутствии кислорода воздуха, позволяет практически без применения химических реагентов и повышения солесодержания обрабатываемой воды добиться нужного уровня очистки от тяжелых металлов, солей жесткости, сульфатов и различных органических загрязнителей (СПАВ, нефтепродуктов, красителей, пестицидов), возвратить воду в производство и достичь самого большого экологического эффекта – радикального сокращения сброса техногенных стоков в поверхностные водоемы.
Разработаны теоретические основы гальванохимического процесса (ГХП) для удаления основных катионов металлов – Cu, Zn, Cr, Cd, Ni, Co, жидких радиоактивных отходов –U, Th, Am, Pu, токсичных анионов – мышьяка As, цианида CN, сероводорода H2S, различных органических примесей, в том числе флотационных реагентов, нефтепродуктов, смачивающих охлаждающих жидкостей и текстильных красителей различного типа [1,2]. Дан анализ различных гальванопар – Fe0 – кокс (медь), алюминий – кокс, ферромарганец – кокс – и процессов, протекающих при переменном контакте компонентов гальванопар между собой в присутствии кислорода воздуха.
Металлы Cu, Zn, Cr, Cd, Ni, Co удаляются на 97-98%.
Установлено, что гальваногенерируемые оксигидраты железа при контакте гальванопары выступают в роли основных железосодержащих сорбентов. Например, гетит, лепидокрокит и магнетит сорбируют соответственно 99,7; 97,9 и 99,8% мышьяка.
Основной вклад в осаждение металлов из растворов при гальванохимической очистке принадлежит гидролитическому осаждению примесей и сорбции на оксигидрате железа.
Удаление мышьяка осуществляется за счет его сорбции гетитом и образования малорастворимых арсенатов (скородита) и арсенидов железа. Гальванохимический процесс сточных вод не приводит к образованию вторичных загрязнителей, содержание железа в очищенной воде всегда ниже предельно допустимой концентрации (ПДК).
Очищенная вода может быть использована в обороте для некритических процессов по содержанию примесей, так как обеспечивается снижение общего солесодержания на 60-75% за счет образования сложных гидрооксосульфатов железа и достижение предельно допустимой концентрации по токсичным компонентам.
Эффективность гальванохимической очистки проверена на примере удаления ионов SiF2-6, Cr5+, Cr3+, F – из отработанных травильных растворов (ОТР) производство полупроводникового кремния (Si) и синтетического кварца.
На предприятии ОАО «Станкозавод» травление осуществляется раствором хромовой и плавиковой кислот, смесью HF и HNO3 кислот в целях очистки полупроводникового кремния от поверхностных загрязнений и выявления дефектов кристаллической решетки. Процесс травления проходит ряд стадий:
CrO3 + H2O = H2CrO4; (1)
3Si + 4 H2CrO4 = 3SiO2 + 2Cr2O3 + 4H2O; (2)
SiO2 + 6HF = H2SiF6 + 2H2O; (3)
Si + 2HNO3 = SiO2 + H2O + NO + NO2 (4)
Реакция (2) способствует образованию хрома - Cr2O3 (Cr2O3 · 3 H2O) в степени окисления 3. Поэтому было принято решение осуществлять восстановление отработанных травильных растворов гальванохимическим способом.
Исходный раствор с pH =2 содержал хром (VI) и хром (III), в том числе Cr6+ - 3,5 мг/л. После 10-кратного прохождения раствора через гальванопару, состоящую из отходов графитовых тиглей и металлической стружки при соотношении 1:2, в растворе не обнаружено хрома. Весь хром перешел в осадок, pH раствора при этом повысился с 2,0 до 5,5.
Влияние продолжительности барботажа на процесс гальванохимической очистки для раствора с содержанием Cr6+ 54 мг/л показано в таблице.
Предложена технология переработки хромвторидных растворов с получением натрия кремнефтористого и гидрооксида Fe(III), хрома (III) гирдрооксида, кальция фторида, натрия нитрата (Рис.1).

Рис. 1. Технологическая схема переработки хромофторидных стоков предприятия ОАО «СТАНКОЗАВОД»
Выделенные продукты соответствуют установленным стандартам.
Разработана окислительная деструкция органических компонентов сточных вод в присутствии кислорода O2, перекиси водорода H2O2 (ПВ) и при наличии ионов железа.
Исходные концентрации хрома (VI) составили 19,3 и3,4 мг/л соответственно. При этом эффективность очистки по хрому достаточно высока и меняется несущественно как в присутствии окислителя, так и без него. Необходимо отметить, что в очищенной воде хром (VI) отсутствовал. Экспериментальные данные по ГК основных составных компонентов смеси – пирокатехина и п-фенилендиамина – свидетельствует о том, что обработка без окислителя дает незначительный эффект снижения концентрации загрязнителей. После ГКО в присутствии перекиси водорода исходные соединения в очищенной воде не были обнаружены.
Гальванокоагуляционный метод, основанный на самопроизвольном окислении железа, находящегося в контакте с углеродным материалом и водой, содержащей пероксид водорода, при одновременном диспергировании через эту систему кислорода воздуха, позволяет реализовать эффективное окисление органических компонентов воды с использованием реагента Фентона с одновременной сорбцией продуктов неполного окисления субстратов гидроскосоединениями железа.
Согласно технологической схеме очистки красильных стоков цеха по выделке овчин (рис.2), сточные воды поступают в приемный резервуар – усреднитель периодического действия. Затем насосом сточные воды подаются в гальванокоагулятор. Блок гальванокоагуляционной очистки состоит из одного рабочего и одного резервного коагуляторов, соединенных параллельно. Производительность одного модуля составляет 1м3/час. После гальванокоагулятора вода самотеком поступает в тонкослойный отстойник со встроенной камерой хлопьеобразования. Осадок влажностью 95-96% из отстойника подается в емкость для сбора и утилизируется по разработанной Байкальским институтом природопользования СО РАН технологии вермикомпостирования с использованием красных калифорнийских червей Eisenia foetida.
Метод применим для удаления Cr, Cu, а также органических примесей из стоков полиграфического производства (рис.3).

Рис. 2. Технологическая схема очистки красильных стоков цеха по выделке овчин:
1-резервуар-усреднитель сточной воды; 2- гальванокоагуляционный модуль; 3- тонкослойный отстойник со встроенной камерой хлопьеобразования; 4- емкость для осадка; 5- резервуар- накопитель очищенной воды; 6-9- расходные баки для щелочного агента, флокулянта, пероксида водорода и кислоты; 10-насос
Эффективность гальванохимической очистки стоков полиграфического производства характеризуется следующими данными, %: хром (VI) и хром (III) – 100, медь и никель – 98, марганец и магний – 99, аммоний щавелевокислый, феноксол, фенизон, метол, гидрохинон и этанол – 100, pH 6,5 – 9,0.
Проведенными исследованиями выявлена перспективность использования гальванохимической обработки для глубокой очистки водных стоков от тория, урана и трансурановых элементов в виброаппарате колонного типа. В качестве объекта исследований использовали скрубберные торийсодержащие воды системы «мокрой» очистки газов установки обезвреживания жидких органических радиоактивных отходов (ЖРО), жидкие радиоактивные растворы Сибирского химического комбината (г. Северск Томской области).

Рис. 3. Рекомендуемая схема очистки сточных вод Чеховского полиграфического комбината с использованием гальванохимического процесса
Установлена высокая эффективность очистки растворов от ионов природного тория (IV) Th4+ вне зависимости от исходного солесодержания. При концентрации ионов Th4+ 100-125 мг/л остаточное содержание составляет менее 0,05 мг/л (допустимое содержание – 1,38 мг/кг). Одновременно с улавливанием ионов тяжелых металлов идет снижение концентрации анионов, таких как сульфат-, хлорид-, нитрат-ионы.
При гальванохимической обработке жидких отходов радиохимического производства был достигнут наивысший коэффициент очистки от плутония – 239 равной 1,95 *106 , при остаточной активности раствора 4Бк/л. При гальванохимической очистке раствора с высоким содержанием америция – 241 коэффициент очистки от плутония – 239 составил 1050, а от америция – 231 – 13800, что имеет важное значение, поскольку америций традиционно считается наиболее трудноулавливаемым компонентом.
Содержание урана – 238 после гальванохимической обработки – менее 0,1 мг/л, что находится на уровне санитарных норм, предъявляемых к питьевой воде.
Таким образом, подтверждена возможность использования методов для глубокой очистки жидких радиоактивных отходов от нуклидов актиноидного ряда. Высокие коэффициенты очистки от U238 , PU239, Am241 (103 - 106) в процессе однократной обработки реальных растворов является предпосылкой для широкого использования метода в процессах очистки жидких радиоактивных отходов, что позволит решить многие производственные проблемы, стоящие перед предприятиями ядерного топливного цикла.
Разработана концепция конструирования устройств большой единичной производительности. Развивается гальванофлотация, в которой сочетается гальванохимический процесс с флотацией гидрофобных примесей (масло, ПАВ). Гальванохимические флотаторы эффективно удаляют белки из сточных вод молочной и мясной промышленности, в частности, Бирюлевского мясоперерабатывающего и Останкинского молочного комбинатов.
Процесс гальванохимической очистки универсален и проявляется в том, что стадия осаждения совмещена с кондиционированием, количество выводимых солей близко к стехиометрическому. Гальванохимическая очистка сточных вод не приводит к образованию вторичных загрязнителей, содержание железа в очищенной воде всегда ниже предельно допустимой концентрации. Гальванохимическая очистка на ряду с термической дистилляцией, электродиализом и обратным осмосом вполне конкурентоспособна. При этом она имеет ощутимые преимущества, поскольку процессы очистки и обессоливания воды осуществляются одновременно.
Литература
Чантурия В.А. Гальванохимические методы очистки техногенных вод: Теория и практика/ В.А. Чантурия, П.М. Соложенкин . – М.: ИКЦ «Академкнига», 2005.
Ковалев В.В. Теоретические и практические аспекты электрохимической обработки воды/ Ковалев В.В, О.В.Вовалева. – Кишинев: Изд. – полиграф. центр Молдавского госуниверситета, 2003.
Воронежский государственный технический университет
УДК 669.4
А.В. Лешова, В.А. Небольсин, Б.А. Спиридонов, А.Ю. Воробьев, В.П. Горшунова
СОВЕРШЕНСТВОВАНИЕ МЕТОДА ДЕСУЛЬФАТАЦИИ КАУСТИЧЕСКОЙ СОДОЙ ПРИ ИЗВЛЕЧЕНИИ СВИНЦА
И ЕГО ОКСИДОВ ИЗ ЛОМА АККУМУЛЯТОРНЫХ БАТАРЕЙ
Изучено влияние постоянного тока на процесс увеличения свинца из промывных растворов, образующихся после отделения осадков оксидов свинца при щелочной переработке лома свинцовых аккумуляторов
Известно, что свинец производят как из рудного, так и из вторичного сырья. Учитывая, что монометаллических руд свинца практически нет, а при переработке полиметаллического сырья выделение качественных свинцовых концентратов является процессом технологически трудоемким и дорогостоящим, наиболее экономичным является переработка вторичного сырья. В развитых промышленных странах создана подотрасль по переработке вторичного свинцового сырья.
Для производства одной тонны свинца из вторичного сырья требуется две тонны исходной шихты, при этом образуется не более одной – двух тонн отходов – шлаков. В тоже время, для производства одной тонны свинца из рудного сырья требуется извлечь из недр и переработать на переделе обогащения 50÷80 т руды и выбросить в отвал почти такое же количество «хвостов», а в металлургическом переделе за счет применения флюсов
дополнительно еще более трех тонн шлаков. Тем самым малоэффективно используются не только природные ресурсы, но и земля для хранения отвалов.
Следует отметить, что накапливающиеся и неперерабатываемые свинецсодержащие отходы являются источниками загрязнения окружающей среды, угрожающего здоровью населения. Так свинец и его соединения отнесены к токсичным веществам 1-го класса опасности. Практически во всех странах мира введены жесткие нормативы, определяющие предельно допустимые концентрации (ПДК) загрязнения свинцом воздуха в зоне дыхания человека и в воде. В России среднесуточная величина ПДК в воздухе составляет 0,0003 мг/м3 и 0,03 мг/л в питьевой воде [1], [2].
Все это определяет возрастающую роль переработки вторичного сырья и промышленных отходов с учетом непрерывного роста потребления и общего производства свинца в странах мирового сообщества.
В настоящее время основными видами вторичного сырья являются лом отработавших свинцово-кислотных батарей и текущие отходы аккумуляторной промышленности.
К настоящему времени разработаны и успешно используются в промышленности различные технологические схемы переработки отработавших батарей, обеспечивающие высокое извлечение свинца и некоторых сопутствующих веществ в товарную продукцию.
При выборе технологии переработки необходимо учитывать реальный состав отработавших батарей, так как конструкции всех элементов аккумуляторов непрерывно совершенствуются (изменяются материалы корпусов, составы сплавов решеток, весовые соотношения элементов в батареях).
Собираемые отработавшие аккумуляторы содержат непостоянную долю компонентов в перерабатываемом ломе. Средний состав компонентов в отработавших батареях после слива электролита (серной кислоты) включает: 7,5% - H2SO4; 34,5% - свинцовые решетки и полюса; 23,5% - сульфат свинца; 17,2% - оксид свинца; 5% - полипропилен; 8,5% - эбонит; 2,5% - сепараторы (ПВХ); 1,3% - прочие [3].
Первой операцией переработки электролита является его фильтрация или отстаивание. Отфильтрованный или отстоявшийся шлам присоединяют к пасте, а очищенный от взвешенных частиц электролит отправляют на дальнейшую переработку.
Основными способами утилизации электролита являются нейтрализация известью или кальцинированной содой. В отдельных случаях отработанный электролит может быть использован для промывки газообразного SO2 в производстве серной кислоты.
При пирометаллургической переработке оксисульфатной фракции от разделки батарей (пасты), сера из сульфат-иона переходит либо в газовую фазу в виде SO2, либо в сульфидно-железистый штейн, либо в штейно-шлаковый расплав, состоящий из сульфидов железа, натрия и свинца. Образование этих новых соединений серы увеличивает затраты на предотвращение загрязнения окружающей среды. Поэтому на многих заводах мира перед плавкой проводят операцию удаления сульфат-ионов из сульфата свинца, содержащегося в пасте, т.е. десульфатацию пасты [4]. Сущность этого процесса состоит в переводе сульфат-иона из сульфата свинца в раствор, а свинца в менее растворимое соединение, не создающее затруднений при его пирометаллургической переработке. В качестве основных десульфатирующих реагентов применяют гидроксид натрия и карбонаты щелочных металлов и аммония.
Использование каустической соды для десульфатации пасты приводит, в первую очередь, к нейтрализации содержащейся в пасте серной кислоты по реакции:
H2SO4+2NaOH→Na2SO4+2H2O
Десульфатация пасты каустической содой происходит в соответствии с реакцией:
PbSO4+2NaOH→Pb(OH)2+Na2SO4
При повышенной температуре в процессе десульфатации происходит изменение состава твердой фазы:
PbSO4+2NaOH→PbO·1/3Н2O+2/3H2O+Na2SO4
Возможно также протекание этой реакции до образования PbO [5]:
PbSO2+2NaOH→PbO +Na2SO4+H2O.
Для более глубокого перехода сульфат-ионов в раствор необходимо вводить дополнительное количество щелочи 10÷20 % [4]. При этом степень десульфатации пасты составляет около 95 %. Недостатком этого способа является то, что около 0,6% свинца остается в продукте десульфатации и около 4,4% свинца переходит в раствор в виде Na2PbO2 по реакции:
PbSO4+ 4NaOH↔Na2PbO2+Na2SO4+2 H2O
Для очистки раствора от свинца дополнительно проводят операцию нейтрализации по реакции:
Na2PbO2+2H2SO4→PbSO4+Na2SO4+2H2O
Осадок сульфата свинца возвращают на десульфатацию.
Методика эксперимента и результаты
Перед проведением операции десульфатации предварительно был проведен элементный анализ исходной свинцово-сульфатной пасты электронно-микроскопическим методом. На рис. 1а представлено электронно-микроскопическое изображение пасты, а на рис. 1б и в таблице 1 – ее элементный состав.


(а) (б)
Рис. 1. Электронно-микроскопическое изображение исходной пасты (а) и ее состав (б)
Обработку пасты (30г) проводили в 100 мл 20%-ного раствора NaOH в течение 60 мин при нагревании (70÷90˚С). После охлаждения осадок отфильтровывали и промывали водой до нейтральной среды (pH7). Общий объем раствора после отмывки водой составлял – 500 мл.
Таблица 1
Элементный состав исходной свинцово-сульфатной пасты
Элемент |
Весовой % |
Атомный % |
O (K) |
20.13 |
70.98 |
S(K) |
4.89 |
8.60 |
Pb (M) |
74.99 |
20.42 |
Итоги |
100.00 |
|
Из этого раствора электрохимическим методом осаждали свинец на титановом катоде с площадью поверхности S=24 см2. Катодная плотность тока ik=2 А/дм2; сила тока I=0,48 А; продолжительность электролиза 180 мин.
Масса свинца составляла 1,1г или 3,67% от начальной массы пасты.
Осадок после отделения щелочного раствора и отмывки водой сушили и прокаливали (пиролиз) при t=400˚С в алундовом тигле в течение 60 мин. Масса оставшегося продукта составила 22,3 г.
После проведения пиролиза был исследован элементный состав полученного продукта. Данные по электронно-микроскопическому анализу приведены на рис. 2 и в табл. 2. Можно предположить, что основными компонентами продукта являются оксиды свинца PbO и PbO2.


(а) (б)
Рис. 2. Электронно-микроскопическое изображение пасты после обработки в щелочном растворе (а) и ее состав (б)
После осаждения свинца на катоде десульфатацию раствора электролита проводили химическим способом. Для этого в раствор вводили избыток двухлористого кальция СаСl2 с целью образования осадка СаSO4 в соответствии с уравнением
СаСl2 +Na2SO4 = СаSO4↓+ 2NaСl
Масса сульфата кальция (гипса) составила 5,4г (18%).
Таким образом, можно заключить, что на основании полученных данных щелочной метод десульфатации с применением электролиза для извлечения свинца из щелочного раствора позволяет получить 74,3% смеси оксидов (PbO и PbO2), 18% сульфата кальция и 3,67% свинца, т.е. 96% от начальной массы пасты.
Таблица 2
Элементный состав пасты после обработки в щелочном растворе
Элемент |
Весовой % |
Атомный % |
O K |
15.66 |
66.23 |
Na K |
2.37 |
6.99 |
Pb M |
81.97 |
26.78 |
Итоги |
100.00 |
|
Литература
1. Principal Uses of Leland Zinc. 1994-1999; ILZSG-2001.-р.7
2. Нормативные данные по предельно-допустимым уровням загрязнения вредными веществами объектов окружающей среды: Справочные материалы. – С.-Петербург, 1994. С.9; 115.
3. Морачевский А.Г., Вайсгант З.И., Демидов А.И. Переработка вторичного свинцового сырья.- С.-Петербург, 1993
4. Морачевский А.Г. Журнал прикладной химии. 1998, №6. с. 881-890.
5. Глазкова Т.И., Угорец М.З., Шкодина Т.Б. Известия Вузов. Цветная металлургия, 1988. №5. с.42-45.
Воронежский государственный технический университет
УДК 621. 367. 502.7
И. М. Винокурова, И. В. Винокуров
РАСЧЕТ ТЕХНОЛОГИЧЕСКОГО ПРОЦЕССА
ПРИ Электрохимической ОБРАБОТКЕ
В материалах статьи приводятся данные по определению методов расчета процессов электрохимической обработки металлов
Применение электрохимической размерной обработки (ЭХО) позволило реализовать многие замыслы конструкторов при разработке перспективных изделий авиационной и космической техники. По /1-4/ изготовление лопаток, валов, дисков ГТД, технологической оснастки возможно или целесообразно с использованием ЭХО. На предприятиях ракетной техники с применением таких процессов выпускают турбонасосные агрегаты (цельные рабочие колеса, направляющие лопатки, сопловые аппараты), детали топливной аппаратуры (форсунки, смесители, фильтры).
Для расчета параметров технологического процесса технолог должен иметь чертежи готовой детали и заготовки или карту операции, предшествующей ЭХО, данные о материале, его состоянии, о методе получения заготовок и технические условия на их поставку [1-6] (например, при получении труб с металлургических заводов).
Расчет выполняют в следующей последовательности:
1. Анализируют чертежи заготовки и находят наиболее приемлемый способ и схему обработки внутренней поверхности, при этом учитывают возможность использования имеющегося оборудования или его комплектующих.
2. Для выбранного способа обработку находят тип катодного устройства и выбирают или рассчитывают по приведенным методикам его основные параметры (зазор, длину и диаметр направляющих, рабочей части и др.). На основании таких материалов разрабатывают техническое задание на инструмент. При этом особое внимание уделяют обеспечению плавности движения электролита.
3. С учетом опыта создания оборудования для ЭХО внутренних поверхностей выбирают станок. Если необходимого оборудования не имеется, то разрабатывают заявку на его приобретение или выдают техническое задание на проектирование. При этом рассчитывают комплектующие изделия (насосы, ванны, источники питания, устройства для очистки электролита), а такие при необходимости находят диапазоны скоростей вращения деталей и поступательного перемещения электродов.
4. По марке обрабатываемого материала подбирают состав электролита и его температуру. Здесь следует иметь в виду, что по мере создания новых электролитов их состав будет изменяться и имеющиеся рекомендации следует корректировать с учетом результатов новых исследований.
5. Для выбранного электролита находят его электропроводность, потери напряжения в приэлектродных слоях. Кроме того, рассчитывают или выбирают по литературным данным электрохимический эквивалент сплава.
6. Для выбранного способа обработки с учетом результатов расчетов по пункту 5 находят, скорость съема материала и характеристики течения электролита (давление, подачу насоса).
7. По марке, структуре материала и виду заготовки для расчетного режима рассчитывают ожидаемую шероховатость поверхности и глубину микрорастравливаний. При необходимости корректируют режим обработки с позиций получения заданного качества поверхности. В последнем случае уточняют результаты расчетов по пункту 6.
8. С учетом исходных материалов находят минимальный припуск на обработку и проектируют заготовку с учетом особенностей ЭХО.
9. Определяют погрешность обработки и оценивают необходимость в последующей операции и припуске для нее.
10. По известному режиму обработки для различных участков детали устанавливают точность на концах и в местах перехода от одного сечения к другому. Оценивают целесообразность последующей операции на этих участках.
11. Находят наибольшую допустимую скорость подачи электрода и производительность процесса.
12. Для получениях параметров процесса уточняют размеры катодных устройств.
13. Оценивают изменение усталостной прочности детали при ЭХО по сравнению c прочностью, достигаемой при механической обработке, и с учетом условий эксплуатации изделия дают заключение о возможности использования ЭХО.
В источнике [3, 4], авторы показали необходимость увеличения давления на входе по мере роста плотности тока при стабильной длине зазора.
Авторы считают [5, 6], что границей образования "пробки" может служить часть канала, где пузырьковый режим течения газожидкостной смеси переходит в пленочный, т.е. образуется газовая "пробка" перекрывающая канал и останавливающая поток смеси (рис. 1). Расчет может быть выполнен при условии, что газы имеют одинаковый (или близкий) диаметр пузырьков, их количество и степень заполнения растут равномерно, а движение жидкой среды между газами происходит по аналогии с фильтрами, при этом газ из смеси остается до начала положения "пробки", заполняет пространство между пузырьками, образуется газовый участок, который растет, тормозит движение "пробки" до ее полной остановки. После остановки потока процесс анодного растворения прекращается, газообразные продукты обработки со стороны Рвх сжимаются и уменьшают объем, давление в МЭЗ перед "пробкой" растет, а с противоположной стороны часть газов из "пробки" переходит в жидкость, которая по инерции движется по каналу, образуя зоны пониженного давления.
Активную роль, в разрушении "пробки" играет размыв ее струей газожидкостной смеси, поступающей в зазор при давлении Рвх.
Если давление Рвх достаточно для проталкивания "пробки", то ее разрушение произойдет достаточно быстро, т.к. после прекращения анодного процесса газу вновь не поступают к "пробке" со стороны движения потока, а ранее образовавшиеся пузырьками перешли в МЭЗ.
Большие расхождения с экспериментом (таблица) объясняются тем, что в расчетах вязкость газожидкостной среды принималась постоянной, хотя ее изменение достигает 300 %.
За счет равномерности механических свойств материала заготовки по глубине создаются условия для управляемого съема припуска при чистовой электрохимической обработке. Снижение размеров зерна по /4/ позволяет уменьшить шероховатость поверхности детали после ЭХО до заданной в чертеже (для стальных лопаток Ка>0,63 мкм, титановых Ра>2,5 мкм алюминиевых

Рис. 1. Содержание газов в смеси по длине канала при давлении на входе в МЭЗ 1 - 0,8 МПа; 2 - 0,4 МПа; 3 - 0,2 МПа; 4-0,1 МПа
Ка> 1,26 мкм). Главным фактором, позволившим выполнить требования чертежа (рис. 1), является снижение погрешности пера заготовки до 0,3 -0,5 мм (обычно только на недоштамповку допуск составлял 0,7 мм), повышение точности установочных баз, которые для сборных роторов выполняют электроабразивным шлифованием с прямой, обратной полярностью или на переменном токе.
При всех схемах подачи тока погрешность после обработки выше, чем при абразивном шлифовании, т.к. в процессе чистовой обработки за кругом формируется гидравлический клин, вызывающий не расчетный съем материала. В /6/ предлагается применять при чистовой обработке баз импульсный режим подачи электролита непосредственно в межэлектродное пространство. За счет этого при использовании схемы /1/ с дозированной подачей электролита (пульсирующий режим течения потока) погрешность по ширине снизилась до заданной при обеспечении точности по профилю в пределах допуска.
Между количеством продуктов обработки и скоростью электролита, выносящего их из зазора, имеется однозначная связь, что подтверждается рис.1. Это условие можно писать в форме критерия
![]()
где
![]() - масса продуктов обработки, выделившихся
в зазор;
- масса продуктов обработки, выделившихся
в зазор;
![]() - масса частиц, (которая может быть
вынесена из зоны обработки за единицу
времени.
- масса частиц, (которая может быть
вынесена из зоны обработки за единицу
времени.
Левая часть выражения характеризует скорость образования продуктов обработки в процессе удаления металла с детали. Можно допустить, что все частицы поступают в электролит и выносятся из зоны обработки, иначе наблюдалось бы накопление гидроокислов в межэлектродном промежутке и процесс бы прекратился. Правая часть неравенства характеризует величину скорости движения электролита, которая требуется для очистки зазора. Практически выбирают такую скорость, которая несколько превышает значение, соответствующее динамическому равновесию масс образующихся и выносимых отходов. Однако это превышение должно быть незначительным, так как иначе резко возрастает, мощность гидроагрегатов, усиливается нагрев электролита в насосе и нарушается стабильность процесса. (Предположение о ламинарном характере потока электролита в зазорах не противоречит выражению, так как турбулентный поток вызывает ускорение диффузии частиц от прианодной зоны в жидкость и кривая рис. 1 становится круче, чем при ламинарном потоке, т. е. условие будет выполняться более строго.
Однако расчет по приведенной формуле дает весьма приближенные, осредненные результаты, т.к. не известны истинные значения длины контакта круга с деталью (зависит от глубины обработки, профиля поверхности заготовки) и др. Условия обработки по пути движения электролита и длина клиньев изменяются по мере наполнения межэлектродного пространства продуктами процесса, что отмечается в работе /6/. При пульсирующем режиме можно установить объем единичной подачи электролита (впрыск жидкости) и длительность паузы, необходимой для очистки межэлектродного пространства от продуктов обработки.
Из /4/ длина канала для глубинного шлифования составляет при обработке плоскостей около 40 мм, для других поверхностей этот показатель можно просчитать через геометрические размеры.
Значение коэффициента торможения жидкости в зазоре (окружная скорость круга 25 - 30 м/с)
Вид круга
|
Ширина круга
|
||
|
до 10 мм |
10-50 мм |
Более 50 мм |
гладкий металлический
|
0,2 - 0,25
|
0,2 - 0,3
|
0,3-0,35
|
металлический с насечкой (рифлениями)
|
0,3-0,35
|
0,32-0,35
|
0,35-0,38
|
токопроводящий абразивный с крупным зерном
|
0,4 - 0,45
|
0,45 - 0,5
|
0,5-0,6
|
токопроводящий абразивный с мелким зерном
|
0,35-0,4
|
0,4 - 0,45
|
0,45-0,5
|
Время пауз (2) подачи электролита можно принять меньшим по сравнению с (1) т.к. в момент выброса порции жидкости из зазора давление внутри объема среды резко возрастает за счет газообразных продуктов реакции, а перед жидкостью образуется вакуум, вызванный перемещением порции жидкости с высокой скоростью в газовой среде между форсункой и кругом. За счет этого происходит ускорение перемещения жидкости и быстрая очистка межэлектродного промежутка.
На рис. 1 приведен пример лопатки соплового аппарата турбонасосного агрегата. Анализ допусков сечения лопатки показывает, что при использовании режимов по /189/ погрешность лопаток составляет не менее 0,2 - 0,25 мм, т.е. не удовлетворяет требованиям чертежа, если отсутствует последующая операция для уточнения профиля. Даже если принять, что при постоянной скорости потока обеспечивается заданная погрешность по профилю (+ 0,1 мм), то ее изменение в пределах допуска приводит к колебанию ширины лопатки в пределах 33,8 - 36,2 мм, хотя по чертежу этот параметр должен быть от 34,5 - 35,5 мм. Все попытки корректировать электрод-инструмент по ширине лопатки не дали положительного результата, т.к. колебания профиля заготовки значительно превышали величину, которая
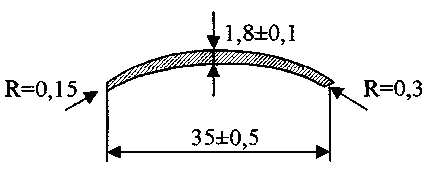
Рис 2. Сечение лопатки соплового аппарата турбонасосного агрегата
необходима для выбора начального межэлектродного зазора вблизи кромок профиля. Проблему удалось решить для некоторых профилей лопаток при сквозном проектировании технологии от заготовки до конечного профиля /5/.
На стадии получения заготовки установлены пути стабилизации свойств материалов лопаток за счет управления температурными полями, повышение точности профиля.
После выхода электролита из зоны обработки реакция нанего круга снимается, газы расширяются, перекрывая пространство между обработанной поверхностью и жидкостью.
Как показано в /6/ жидкостный клин между инструментом и обработанной поверхностью вызывает неуправляемый съем металла и нарушает сформированный при обработке профиль. Воздушная прослойка между кругом и поверхностью резко сокращает анодное растворение и снижает погрешности процесса. В этом же направлении действует ускорение движения порции электролита, что снижает время протекания анодного процесса на обработанной поверхности.
В /3/ приведен разработанный автором численный метод расчета нестационарного трехмерного потока для поля давлений с учетом неразрывности среды в период импульса. Особенностью метода является включение в расчет параметров завихренности потока. Автором использовался метод сеток, решение выполнялось в Проведены экспериментальные исследования по оценке сходимости расчетных значений с опытными данными (таблица).
Исследования, выполненные в авиационных и других технических ВУЗах /1-6/ однозначно показали, что при стабильном процессе анодного растворения достигается массовынос, обеспечивающий высокую точность формообразования профиля. Управление массовыносом возможно /3/ при выполнении критерия, позволяющего полностью реализовать потенциал потока жидкости в межэлектродном зазоре по выносу образовавшихся продуктов обработки, главным образом газообразных.
Литература
1. Электрохимическая размерная обработка. Проблемы и решения/ Г.Н. Зайдман // Электрохимическая размерная обработка. 1991. № 1. С. 3-14.
2. Саушкин Б. П. Электрохимическая обработка изделий из титановых сплавов / Б. П. Саушкин, Ю. Н. Петров, А. З. Нистрян, А. В. Маслов // Кишинёв. Штиница. 1988. 200 с.
3. Мандрыкина И. М. Исследование взаимосвязи термокине-тических и электрохимических параметров при импульсных режимах обработки титановых сплавов. Дис… Воронеж. 1998. 210 с.
4. Шалимов Ю. Н. Оптимизация электрохимического процесса обработки алюминиевой фольги в производстве конденсаторов / Ю. Н. Шалимов, И. М. Мандрыкина, Ю. В. Литвинов Воронеж: Изд-во ВГТУ, 2000. 343 с.
5. Винокурова И. М., В. П. Смоленцев. Математическое описание процессов переноса в турбулентных потоках при электрохимиической обработке металлов. Современная электротехнология в промышленности центра России. Сб. тр. VIII региональ. научно-техн. конф. Тула, 1 июня 2006. –Тула:ТулГУ С. 22-26.
6. Газизулин К. М. Электрохимическая размерная обработка крупногабаритных деталей в пульсирующих рабочих средах: Научное издание. Воронеж: Воронежский государственный университет, 2002. 243 с.
Воронежский государственный технический университет
УДК 622.357.7
Б.А.Спиридонов, А.А. Камец
ИССЛЕДОВАНИЕ ЭФФЕКТИВНОСТИ ПРОТЕКТОРНОЙ
ЗАЩИТЫ СТАЛИ Х40, ИСПОЛЬЗУЕМОЙ В ПРОИЗВОДСТВЕ ГАЗОТРУБОПРОВОДОВ
Гравиметрическим и электрохимическим методами изучено влияние природы материала протектора на коррозию стали Х40, используемой в производстве газотрубопроводов. Установлено, что наиболее эффективным является протектор, изготовленный из магния.
Значение
природного газа для энергетики,
транспорта, обороны страны, для
разнообразных отраслей промышленности
и для удовлетворения бытовых нужд
населения исключительно высоко. Природный
газ – один из важнейших горючих
ископаемых, занимающий ключевые позиции
в топливно-энергетических балансах
многих государств, важное сырье для
химической промышленности. Россия
занимает первое место в мире по объемам
доказанных запасов природного газа
(47,6 трлн. м![]() ),
что соответствует 26,7 % от общемировых
доказанных запасов. Всего на 10 крупнейших
стран по запасам газа приходится 77,9 %
мировых запасов (134,0 трлн. м
).
К 2020 г. мировая добыча газа превысит 5
трлн. м
.
Доля газа составляет около половины
общего объема производства и внутреннего
потребления энергетических ресурсов,
поэтому газовая отрасль играет
стратегическую роль в экономике России.
Обладая крупнейшими в мире запасами
природного газа и не имея равных по
объемам годовой добычи, Россия является
важнейшим звеном мировой газовой
промышленности. На сегодняшний день
доля газа в топливном балансе России
составляет 62 %, а в европейской части –
86 %. Отрасль обеспечивает порядка 10 %
национального ВВП, до 25 % доходов в
государственный бюджет страны. Экспорт
природного газа приносит России около
15 % валютной выручки.
),
что соответствует 26,7 % от общемировых
доказанных запасов. Всего на 10 крупнейших
стран по запасам газа приходится 77,9 %
мировых запасов (134,0 трлн. м
).
К 2020 г. мировая добыча газа превысит 5
трлн. м
.
Доля газа составляет около половины
общего объема производства и внутреннего
потребления энергетических ресурсов,
поэтому газовая отрасль играет
стратегическую роль в экономике России.
Обладая крупнейшими в мире запасами
природного газа и не имея равных по
объемам годовой добычи, Россия является
важнейшим звеном мировой газовой
промышленности. На сегодняшний день
доля газа в топливном балансе России
составляет 62 %, а в европейской части –
86 %. Отрасль обеспечивает порядка 10 %
национального ВВП, до 25 % доходов в
государственный бюджет страны. Экспорт
природного газа приносит России около
15 % валютной выручки.
Природный
газ очень удобно транспортировать по
трубопроводам - это дешевое энергетическое
и бытовое топливо [1]. Трубопроводы
относятся к категории энергонапряженных
объектов, отказы которых сопряжены, как
правило, со значительным материальным
и экологическим ущербом. Многочисленные
отказы на технологических трубопроводах,
транспортирующих природный газ, приводят
к локальным и общим загрязнениям
окружающей среды, создают риск с точки
зрения безопасности персонала и
населения. Особую остроту приобретает
проблема надежности и экологической
безопасности в системах магистрального
трубопроводного транспорта природного
газа. В настоящее время, например, в
Западной Сибири ежегодно происходит
около 35 тыс. отказов и аварий нефте - и
газопроводов, общая протяженность
которых в России составляет около 350
тыс. км. Около 21 % аварий связаны с
механическими воздействиями, в том
числе с потерей устойчивости фундаментов
и деформаций опор. Имеются многочисленные
примеры нарушения целостности и
разрушения жилых и производственных
зданий, разрывов трубопроводов, связанных
с деградацией вечной мерзлоты,
обусловленной глобальным потеплением
климата. Уже в настоящее время в Западной
Сибири отмечается интенсивное оттаивание
мерзлых пород (до 4 см в год), что приведет
к росту числа техногенных ЧС из-за
обрушения зданий и сооружений, повреждения
коммуникаций. Ожидается, что при
увеличении ежегодной температуры
воздуха на 2![]() ,
несущая способность аварийных фундаментов
сокращается на 50%. В последнее десятилетие
причиной разрыва магистральных
трубопроводов стала стресс – коррозия
– коррозионное растрескивание под
напряжением, наружная и внутренняя.
,
несущая способность аварийных фундаментов
сокращается на 50%. В последнее десятилетие
причиной разрыва магистральных
трубопроводов стала стресс – коррозия
– коррозионное растрескивание под
напряжением, наружная и внутренняя.
Обычно
газопровод
высокого давления выполняется подземно
с глубиной заложения не менее 1,0 м до
верха трубы, на обводненных участках и
болотах – 1,0 м до верха забалластированного
трубопровода. Благодаря контакту с
грунтовыми водами трубопроводы
подвергаются коррозии. Учитывая диаметр
трубы (530 мм) и длину трубопровода,
например 61,7 км, внешняя площадь поверхности
составляет 52309 м![]() .
.
Специальными исследованиями образцов стали в грунтах установлена потеря массы с единицы поверхности, равная 0.05 г/ м ч. Исходя из этой величины скорости коррозии и не учитывая неравномерный ее характер, расход массы металла на образование продуктов коррозии (ржавчины) составит
![]()
Однако реальные потери металла благодаря неравномерному характеру разрушения будут гораздо больше. Практически установлено, что уже после 8 – 10 лет эксплуатации в стенках трубопровода толщиной 8 мм появляются первые сквозные участки коррозии, т.е. скорость местного разрушения составляет 1 мм/год. Следовательно, на отдельных участках магистрального трубопровода, где скорость разрушения примерно в 20 раз выше средней, приходится уже через 8 лет менять трубы (или, если возможно, заваривать места поражения).
Американский опыт длительной эксплуатации подземных трубопроводов без защиты показывает, что число образующих сквозных участков коррозии увеличивается в геометрической прогрессии и обуславливает быстрый выход из строя всего трубопровода, так как становится экономически невыгодно проводить его ремонт.
В настоящее время трубопроводы без защитных противокоррозионных мероприятий не эксплуатируется [2]. В процессе строительства на трубопровод наносится изолирующее покрытие, которое позволяет увеличить срок без аварийной работы. Но без применения электрохимической защиты полностью устранить коррозию не удается, так как в процессе укладки трубопровода в землю покрытие местами разрушается. При относительно небольших затратах (например, стоимость катодной защиты не превышает 1 % от стоимости трубопровода) удается продлить срок службы до 50 – 100 лет.
Наиболее простое осуществление катодной защиты состоит в присоединении к трубопроводу протектора, изготовляемого из металла более электроотрицательного по отношению к стали [3]. Благодаря разности потенциалов между протекторами и трубопроводом в цепи образовавшегося гальванического элемента проходит ток.
Активный материал гальванического элемента, расходуемый на получение электрической энергии – протектор. Протектор является анодом, на котором происходит освобождение электронов (реакция окисления). Второй электрод элемента (катод), на котором происходит связывание электронов (реакция восстановления), - трубопровод. Внешней цепью (нагрузкой) этого элемента является соединительный проводник, а электролитом – окружающий трубопровод и протектор грунт. В качестве материалов, для изготовления протекторов, могут быть использованы - магний, цинк и алюминий.
Таким образом, можно заключить, что проблема повышения безопасности при эксплуатации магистральных газотрубопроводов остается актуальной. При этом следует отметить, что одним из факторов, снижающих безопасность трубопроводов, является коррозия, а одним из методов защиты – протекторная защита.
Цель работы – изучение влияния природы материала протектора на эффективность защиты стали Х 40 от коррозии в различных растворах, моделирующих коррозионную среду, в которой эксплуатируются магистральные трубопроводы.
Для
проведения коррозионных испытаний
изготовляли образцы из стали 40Х (C
0,36 – 0,44; Cr
0,8 – 1,1) с поверхностью 10 см
и помещали их в указанные коррозионные
среды (модельные растворы). Для защиты
стали от коррозии использовали в качестве
протектора – Mg
с поверхностью 10 см
.
Продолжительность испытаний варьировали
от 96 до 140 часов. Потерю массы стального
образца и Mg
– протектора определяли гравиметрическим
методом с точностью взвешивания до
10![]() г.
г.
Электрохимические
измерения проводили потенциодинамическим
(2мВ/с) методом на потенциостате П –
5827М. Рабочим электродом служила пластина
из стали 40Х с рабочей поверхностью 1
см
.
В качестве вспомогательного электрода
использовали пластину, а хлорид серебряный
электрод – как электрод сравнения.
E–![]() кривые записывали в автоматическом
режиме на потенциометре КСП. Потенциалы
приведены без пересчета на водородную
шкалу. На основании электрохимических
измерений были также определены скорости
коррозии (
кривые записывали в автоматическом
режиме на потенциометре КСП. Потенциалы
приведены без пересчета на водородную
шкалу. На основании электрохимических
измерений были также определены скорости
коррозии (![]() )
для стали в изучаемых средах. Коррозионные
токи получены из графического построения
анодных и катодных поляризационных
кривых и представленных в полулогарифмических
координатах [4]. Микроструктуру поверхности
образцов изучали на сканирующем
электронном микроскопе.
)
для стали в изучаемых средах. Коррозионные
токи получены из графического построения
анодных и катодных поляризационных
кривых и представленных в полулогарифмических
координатах [4]. Микроструктуру поверхности
образцов изучали на сканирующем
электронном микроскопе.
На
основании E
–
поляризационных кривых, снятых на стали
40Х в различных коррозионных средах.
установлено, что с большей скоростью
сталь окисляется в 3 % растворе NaCl
, что очевидно, можно объяснить активирующим
действием хлорид – ионов, разрушающих
оксидную пленку на поверхности стали.
Кроме этого известно, что для сталей
легированных хромом в присутствии Cl![]() - ионов характерна питтинговая коррозия.
- ионов характерна питтинговая коррозия.
Из
рис. 1 видно, что скорость коррозии стали
40Х в 3 % растворе NaCl
![]() =
0.13 мг/см
.
=
0.13 мг/см
.

Рис. 1. Катодная (1) и анодная (2) E-i-кривые, снятые в 3%-ном растворе NaCl
Учитывая
электрохимический эквивалент железа
(основной компонент стали),
и время снятия E
-
- кривых (0,3 часа - продолжительность
коррозии), была рассчитана скорость
коррозии
![]()
![]() =
0,041 мг/ см
час
(табл. 1).
=
0,041 мг/ см
час
(табл. 1).
Полученные данных кореллируют с результатами коррозионных испытаний, проведенных при определении потери массы стальных образцов (табл. 1).
Таблица 1
Результаты коррозионных испытаний стали 40Х в различных средах
Коррозионная среда |
масса образца до испытаний, г |
масса образца после испытаний, г |
потеря массы, г |
скорость коррозии, мг/ см2 |
скорость коррозии, опред. после эл.хим. измерений, мг/ см |
торф |
8,8031 |
8.7938 |
0.0093 |
0.0241 |
0.033 |
болото |
9,1348 |
9.1284 |
0.0064 |
0.0123 |
0.018 |
река |
10,0445 |
10.0412 |
0.0033 |
0.0093 |
0.011 |
грунтово-песчаная вода |
9,5962 |
9.5934 |
0.0028 |
0.0065 |
0.0073 |
15% Na2SO4 |
8,9773 |
8.9722 |
0.0051 |
0.0113 |
0.0125 |
3 % NaCl |
9,7086 |
9.6980 |
0.0106 |
0.036 |
0.041 |

Рис. 2. СЭМ изображение поверхности стали 40Х до коррозии в 3% растворе NaCl

Рис. 3. СЭМ изображение поверхности стали 40Х в 3 % растворе NaCl после коррозии
На
рис. 2 представлено СЭМ изображение
поверхности стали 40Х до коррозии, а на
рис. 3 осле коррозии в 3 % растворе NaCl.
Следует отметить, что светлые участки
на снимках – продукты коррозии стали
(Fe(OH)![]() и Fe(OH)3,
а темные – очаги коррозии.
и Fe(OH)3,
а темные – очаги коррозии.

Рис.
4. СЭМ изображение поверхности стали
40Х в растворе Na
SO![]()
На рис. 4 показана поверхность стали 40Х в растворе Na SO .Используя ту же методику снятия анодных и катодных E - - кривых, были определены значения для стали 40Х в других средах. (табл. 1).
С целью выбора протектора были изучены зависимости потенциал – плотность тока (E - - поляризационные кривые) для некоторых металлов (Mg, Al, Zn) в 15% растворе сернокислового натрия.

Рис. 5. Потенциодинамические поляризационные E-i – кривые, снятые на различных металлах в 15%-ном растворе Na2SO4: 1 – Mg, 2 – Zn, 3 – Al, 4 – сталь 40Х
Из
рис. 5 и табл. 2 видно, что с наибольшей
скоростью в данной среде растворяется
магний (кривая 1). При этом для выбора
протектора положительным фактором
является наибольшая разность потенциалов
между Mg
и железом (сталь) -
![]() E
= 0.96 В. С меньшей скоростью растворяется
Zn
(кривая 2), а разность потенциалов меньше
(
E
= 0.54 В). Наименьшая скорость растворения
наблюдается для Al
(кривая 3), что обусловлено наличием на
поверхности Al
коррозионностойкой оксидной пленки.
Начальная разность потенциалов составляет
E
= 0.22 В, однако затем при E
= -0.35 В, E
-
- кривые пересекаются и
E
становится близким к нулю. При дальнейшем
смещении потенциала в положительную
область анодом в гальванической паре
Al
E
= 0.96 В. С меньшей скоростью растворяется
Zn
(кривая 2), а разность потенциалов меньше
(
E
= 0.54 В). Наименьшая скорость растворения
наблюдается для Al
(кривая 3), что обусловлено наличием на
поверхности Al
коррозионностойкой оксидной пленки.
Начальная разность потенциалов составляет
E
= 0.22 В, однако затем при E
= -0.35 В, E
-
- кривые пересекаются и
E
становится близким к нулю. При дальнейшем
смещении потенциала в положительную
область анодом в гальванической паре
Al
![]() Fe
становится железо и соответственно,
защитные функции Al
уже не выполняет.
Fe
становится железо и соответственно,
защитные функции Al
уже не выполняет.
Таблица 2
Результаты коррозионных испытаний стали 40Х в различных коррозионных средах с Mg – протектором
коррозионная среда |
масса стали до испытаний, г |
масса стали после ис-пытаний, г |
потеря массы, г |
скорость коррозии, мг/ см2∙час |
коэффициент защиты от коррозии, Z, % |
торф |
9,4979 |
9,4967 |
0,0012 |
0,0014 |
94 |
болото |
9,3843 |
9,3838 |
0,0005 |
0,0008 |
93 |
речная вода |
9,5418 |
9,5410 |
0,0008 |
0,0003 |
96 |
грунтовая вода |
8,8562 |
8,8555 |
0,0007 |
0,0002 |
96 |
Таким образом, на основании полученных результатов можно заключить, что наиболее эффективным протектором может быть магний.
Литература
1. Красноярский В.В., Цикерман Л.Я. Коррозия и защита подземных металлических сооружений. М.: Высшая школа, 1968. – 296с.
2. Томашов Н.Д. Теория коррозии металлов. Изд – во АН СССР, 1958. – 143с
3. Улиг Г. Коррозия металлов. М.: Металлургия, 1968. – 308с.
4. Семенова И.В., Хорошилов А.В., Флорианович Г.М. Коррозия и защита от коррозии / под ред. И.В.Семеновой. – 2-е изд., перераб.и доп. М.: Физмат, 2006. – 376 с.
Воронежский государственный технический университет
УДК 621. 367. 502.7
И.М. Винокурова, М.А. Коровин
ИСПОЛЬЗОВАНИЕ АЛГОРИТМА ЭХО В ПРОИЗВОДСТВЕ
ПРИ АНОДНОЙ ОБРАБОТКЕ
В материалах статьи приводятся данные по определению методов расчета процессов анодной обработки
Накопленный в авиастроении опыт применения ЭХО показывает, что для большинства технологических приложений пульсирующим режимом можно управлять, если установить закономерности его изменения. При значительном изменении по длине канала его ширины и плавности профиля задача расчета параметров течения рабочей среды сводится к двухмерной и даже одномерной схеме с переменной скоростью движения. Это наблюдается визуально при скоростной съемке [1-3]. Большое влияние на протекание процесса оказывает обоснованный учет фазового состава рабочей среды в зазоре (табл. 1).
Анализ табл. 1 и результатов скоростной съемки [2, 3] дает основания считать, что для абсолютного большинства приложений ЭХО в ракетно-космической технологии справедливо принять рабочую среду как 2 фазную, содержащую жидкую и газообразную составляющую и протекающую в пульсирующем режиме с частотой от 1 до сотен и тысяч циклов за время обработки. Из [4] видно, что гидроокислы в зазоре проявляются в виде загрязнений, достаточно равномерно заполняющих пространство. Это может быть объяснено возможностью нахождения такой фазы в жидкости в виде растворенных частиц, которые только после выхода из зазора переходят в нерастворимое состояние. Подобные исследования, выполненные с применением коагуляторов, показали образование в зазоре скоплений нерастворимых продуктов обработки, что, возможно, будет иметь место при формообразовании длинномерных поверхностей. Однако на технологические показатели гидроокислы оказывают незначительное влияние (по [4] не более 7 %), хотя могут повышать вязкость среды в зазоре.
На стадии отработки технологичности требуется обосновать вариант течения жидкости через рабочее пространство. Исходные данные здесь выбираются из карт заготовки и детали, что дает 3 варианта обработки: когда профиль заготовки близок к заданному в детали (рис., а), в случае образования между электродами (профиль канала имитируют заготовка и катод-инструмент) диффузорного (рис., б) или конфузорного (рис., в) пространства.
Таблица 1
Влияние фазового состава рабочей среды на стабильность
процесса ЭХО
Состав рабочей среды
|
Содержание в рабочей среде, %
|
Влияние на процесс ЭХО
|
Влияние на характер течения рабочей среды
|
|
начало канала
|
по длине канала
|
|||
Жидкие раст- воры ней- тральных со- лей в воде |
100
|
снижа- ется
|
значи- тельное
|
незначи- тельное
|
Твердые частицы
|
возникают как результат загрязнения рабочей среды
|
влияют при концентрации более 5 %
|
||
Коллоидные гидроокислы |
отсутст- вуют |
до 8-10
|
незначи тельное |
незначи- тельное |
Газообразные продукты обработки
|
отсутствуют
|
до 100
|
значительное
|
значительное при длине канала до 200 зазоров опре-деляющее при длине каннала свыше 200 зазоров |
Равномерный зазор (рис., а) в практике встречается редко, т.к. с позиций технолога в этом случае размерная предварительная обработка должна быть исключена, как не имеющая смысла, но вызывающая дополнительные затраты. Достаточно рассчитать припуск только на чистовую операцию, как правило, безразмерную. Поэтому будут анализироваться схемы "б, в" (рисунок), где карты припусков формируют диффузорный и конфузорный каналы (при большой длине канала могут быть участки с обоими профилями).
Для
ЭХО, особенно на этапе удаления основной
части припуска, целесообразно иметь
схему "б"
(рисунок), поскольку она способствует
лучшему массовыносу при выбранном
направлении течения рабочей среды (по
мере накопления продуктов обработки в
з азоре
сечение канала возрастает). Поэтому
в варианте "в"
азоре
сечение канала возрастает). Поэтому
в варианте "в"
а) б) в)
К выбору направления подачи электролита в зону
обработки: 1 - заготовка (пунктиром показан профиль
детали); 2 - электрод-инструмент; V - скорость прокачки
электролита; So - начальный межэлектродный зазор
(рисунок) целесообразно изменить направление течения электролита (V) на противоположное и учесть это в техническом задании на технологическую оснастку. Если длина (по направлению течения рабочей среды) обрабатываемой поверхности не значительна (по [5] не свыше 200 межэлектродных зазоров So), то нижний предел скорости течения электролита находится из условия выноса продуктов обработки из зазора по осредненным (приближенным) зависимостям, например из [6].
Верхний предел зависит от геометрии канала. Если канал плоский или с аэродинамическим профилем, имеет незначительное плавное изменение ширины, то оборудование позволяет создать на входе однородный по давлению поток, а верхний предел скорости может быть выбран исходя из возможностей гидравлического агрегата (давление на входе, расход). Это позволяет снизить начальный межэлектродный зазор до предела, соответствующего началу образования пульсаций (с учетом возможностей системы регулирования зазора на оборудовании), повысить напряжение на электродах (не превышая предела, вызывающего пробой промежутка между электродами) и достичь наиболее высокой скорости обработки, точности, качества поверхности. Отсюда вытекает ранее не применяемая в технологии ЭХО научная концепция: для технологичных с позиции ЭХО деталей (по геометрии, припуску, длине канала, схеме подачи электролита) возможно путем оптимизации комплекса зазор - скорость электролита - напряжение на электродах достичь наилучших технологических показателей по производительности, точности, качеству поверхности. Если учесть, что по [7] только отклонения от рабочего режима течения электролита, влияющие также на стабильность его параметров, определяют более 20 % погрешностей обработки, а с учетом стабилизации на современных станках зазора - до 80 % погрешностей, то научно обоснованные режимы течения дают возможность получить для значительной группы деталей авиационной и космической техники наиболее высокие технологические результаты от применения ЭХО.
Использование разработанного алгоритма дает возможность рекомендовать внедрение ЭХО в производство для выполнения работ, перечисленных ниже:
1. Выполнение уникальных операций, осуществимых только электрохимическим методом. В этом случае нет необходимости обосновывать целесообразность применения ЭХО, так как иначе вообще невозможно изготовить разработанную деталь.
2. При изготовлении деталей из высокопрочных материалов практически нет необходимости учитывать их форму и масштаб выпуска. Здесь электрохимический метод обработки внутренних поверхностей имеет неоспоримые преимущества.
3. Для обработки заготовок из материалов, обладающих особыми свойствами (повышенной вязкостью, хрупкостью и др.), при обработке которых возникают технологические затруднения. К этой группе можно отнести жаропрочные, титановые и магнитные сплавы. Однако здесь имеются ограничения: если детали простой формы, а выпуск их ограничен, то внедрять процесс ЭХО, как правило, невыгодно. Например, простые втулки целесообразно изготовлять с применением ЭХО в случае, когда количество одноименных деталей обеспечивает загрузку хотя бы одного станка в течение смены без перенастройки.
4. Изготовление деталей из конструкционных сталей, которые наиболее широко используют в машиностроении. Такие операции рентабельны для длинномерных отверстий (l/(d> 810), при условии, если можно обеспечить загрузку станка с периодической перенастройкой не чаще 6-10 раз в течение месяца. Это соответствует масштабу выпуска 50-100 одноименных труб или 10-20 деталей с внутренней полостью переменного сечения. В случае, когда электрохимическое оборудование уже имеется на заводе и требуется только его переналадка, указанные цифры уменьшаются в 1,5-2 раза.
5. При обработке внутренних поверхностей в деталях из сплавов легких и цветных металлов (алюминия, меди, магния и др.) процесс ЭХО применим, если доступ инструмента к месту удаления припуска затруднен, а число изготовляемых деталей значительно (загрузка одноименными деталями не менее 1-3 смен). Создавать новое оборудование для таких деталей в большинстве случаев нецелесообразно, кроме деталей, требующих выполнения уникальных операций.
Для случая течения рабочей двухфазной среды с переменной скоростью в зазоре с различным профилем можно разработать физическую модель и сформулировать закон управления подачей среды в зависимости от геометрии конкретной обрабатываемой поверхности и способа регулирования межэлектродного зазора. По физической модели можно сформировать математическое описание процесса и реализовать его с использованием современных средств регулирования и управления (процессоры, блоки ЧПУ), имеющихся на оборудовании.
Начальная температура электролита вначале нарастает достаточно медленно, затем резко увеличивается и стабилизируется. В конце канала наблюдается снижение температуры, видимо /1/ за счет падения давления внутри канала и расширения газов в электролите, что увеличивает сопротивление среды, снижает плотность тока и нагрев электролита. На первом участке (до 50 мм) скорость анодного растворения не высока, однако за счет уменьшения зазора она увеличивается, а незначительное газонаполнение на этом участке приводит к последующей интенсификации съема. Стабилизация температуры на длине 100-200 мм позволяет получить достаточно равномерный съем и высокую точность, однако последующее "запирание" потока делает съем не управляемым. Снизить негативное влияние изменения съема удается за счет пульсаций потока, когда образуется так называемая зонная обработка и погрешности локализуются внутри каждой зоны, а рост электропроводности по длине канала сдерживается, т.к. во время остановки потока его температура выравнивается и в начале импульса движения рабочей среды условно становятся осредненными.
Таблица 2
Характер течения электролита в межэлектродном зазоре
Форма канала |
Типовые обрабаты-ваемые детали |
Длина канала |
Характер течения рабочей среды |
Плоская: - с постоянной или незначительной плавно изменяющейся шириной канала |
валы |
до 200 зазоров
|
одномерное |
постоянное |
|||
лонжероны
|
свыше 200 зазоров |
одномерное пульсирующее
|
|
- с переменной шириной канала
|
лонжероны
патрубки
|
свыше 200 зазоров до 200 зазоров |
двухмерное пульсирующее двухмерное постоян-ное или пульсирующее |
Криволинейная с плавным профилем: - с постоянной или слабо изменяющейся шириной канала |
лопатки ТНА, турбин, турбонагнетателей
|
до 200 зазоров свыше 200 зазоров
|
двухмерное постоян-ное двухмерное пульсирующее |
- с переменной шириной канала |
лопатки компрес-соров ГТД, венти-ляторов, насосов, паровых турбин |
свыше 200 зазоров
|
двухмерное пуль-сирующее с неста-бильным циклом по времени |
Криволиней- ная с дискретным профилем
|
полости, отверстия, ковочные штампы прессформы, облег-чения в узлах шасси, панелях фюзеляжа, корпусов ракет, обтекателей, полировка проточного тракта ТНА |
любая
|
трехмерное с переменным векто-ром и величиной скорости, зменяю- щейся по длине канала
|
С произвольным профилем
|
Скругление кромок, удаление заусенцев с подачей электролита поливом нанесение информации: - без прокачки электролита - с прокачкой электролита |
любая
до 200 зазоров |
одномерное ламинарное
локальные пульсации одномерное ламинарное |
Литература
1. Электрохимическая размерная обработка. Проблемы и решения/ Г.Н. Зайдман // Электрохимическая размерная обработка. 1991. № 1. С. 3-14.
2. Саушкин Б. П. Электрохимическая обработка изделий из титановых сплавов / Б. П. Саушкин, Ю. Н. Петров, А. З. Нистрян, А. В. Маслов // Кишинёв. Штиница. 1988. 200 с.
3. Мандрыкина И. М. Исследование взаимосвязи термокине-тических и электрохимических параметров при импульсных режимах обработки титановых сплавов. Дис… Воронеж. 1998. 210 с.
4. Шалимов Ю. Н. Оптимизация электрохимического процесса обработки алюминиевой фольги в производстве конденсаторов / Ю. Н. Шалимов, И. М. Мандрыкина, Ю. В. Литвинов Воронеж: Изд-во ВГТУ, 2000. 343 с.
5. Винокурова И. М., Смоленцев В. П., Математическое описание процессов переноса в турбулентных потоках при электрохимиической обработке металлов. Современная электротехнология в промышленности центра России. Сб. тр. VIII региональ. научно-техн. конф. Тула, 1 июня 2006. –Тула:ТулГУ С. 22-26.
6. Смоленцев В. П. Технология электрохимической обработки внутренних поверхностей. Москва. Машиностроение. 1978. 176 с.
7. Газизулин К. М. Электрохимическая размерная обработка крупногабаритных деталей в пульсирующих рабочих средах: Научное издание. Воронеж: Воронежский государственный университет, 2002. 243 с.
Воронежский государственный технический университет
УДК 547.2
О.Н. Болдырева
ТЕХНОЛОГИЯ ОЧИСТКИ НЕФТЕСОДЕРЖАЩИХ СТОЧНЫХ ВОД ПРОИЗВОДСТВЕННЫХ ОБЪЕКТОВ
Сбор нефтяных загрязнений с водных поверхностей осуществляется с помощью нетканых волокнистых материалов природного происхождения(целлюлозы, базальтового волокна), а также синтетических материалов( продуктов переработки отходов полиэтилена, полипропилена и др.), обработанных специальными активирующими добавками [1]. Материалы применяются в виде секций («матов»), которые могут быть соединены в боновые заграждения или мобильные сборки для траления поверхности
Высокая эффективность сбора нефтепродуктов достигается путем обработки волокон специальными полимерными добавками на основе окисленного атактического полипропилена (АПП), обеспечивающими гидрофобные свойства и высокую способность впитывания нефтепродуктов (до 15 кг нефти на 1 кг адсорбента для промышленных образцов). Возможность регенерации элементов, основанная на «отжиме» за счет создания перепада давления, обеспечивает их многократное (не менее 10 циклов) повторное использование на месте аварийного разлива. Остаточная тонкая (не менее 0,1 мкм) нефтяная пленка может быть удалена специальными тканевыми шлейфами на основе марлевых элементов, действующими на тех же принципах гидрофобизации и активации.
Результаты последних исследований не позволяют надеяться на достижение емкости волокнистых адсорбентов до 20-30 кг нефти на 1 кг адсорбента в зависимости от содержания полимерной добавки, т.е. достичь уровня лучших зарубежных синтетических полимерных материалов с привитыми функциональными группами при значительно меньшей стоимости.
Использование этой технологии позволяет полностью удалять взвешенные и (частично) эмульгированные нефтепродукты с поверхности открытых водоемов и проточной воды.
Для очистки постоянно поступающих нефтесодержащих водных отходов нефтепредприятий разработана фильтроадсорбционная технология, обеспечивающая тонкую комплексную доочистку природных и сточных вод от нефтепродуктов, ПАВ, тяжелых металлов и различных органических загрязнителей до уровня, разрешенного для сброса в открытые водоемы. Она основана на многослойной фильтрации загрязненных вод через чередующиеся слои адсорбентов и предусматривает комплексное использование волокнистых адсорбентов и ультрадисперсных оксигидроксидов алюминия в многослойных фильтрах-адсорберах. Схема такого фильтра приведена на рис. 1.

Рис.1. Принципиальная схема многослойной фильтрации нефтесодержащих сточных вод: 1-волокнистый адсорбент; 2-порошковый адсорбент
В качестве порошкового компонента обычно используются ультрадисперсные оксигидроксидные фазы алюминия, полученные прямым термогидролизом электровзрывного ультрадисперсного порошка алюминия дистиллированной водой при 60 0С и прокаленные при 380 0С. Частицы адсорбента представляют собой сложные структуры с развитой поверхностью типа «снежинок» размером менее 1 мкм. Удельная поверхность адсорбента составляет 270-360 м2/г, состав включает следующие фазы, % масс.: AL(OH) – 7, ALOOH – 47, γ – AL2O3 – 25, α – AL2O3 – 21.
Исследования показали, что оксидно-гидроксидные фазы алюминия, полученные прямым окислением электровзрывных ультрадисперсных порошков алюминия [2-3] водой, могут использоваться в качестве эффективных адсорбентов для извлечения нефтепродуктов из водных растворов и эмульсий. Наличие значительного(100-150 мВ) электрического потенциала, создаваемого ультрадисперсными оксидными адсорбентами на границе с водной фазой, приводит к быстрому разрушению и коагуляции нефтяных микроэмульсий [3]. Положительный опыт применения таких адсорбентов для очистки сточных вод нефтебаз и водных отходов бурения и добычи нефти показал необходимость детального изучения процессов адсорбции и разрушения микроэмульсий нефтепродуктов адсорбентами данного типа с целью определения оптимальных условий процессов очистки.
При многослойной фильтрации адсорбция нефтепродуктов описывается одной изотермой (рис.2). При этом обеспечивается быстрое разрушение и адсорбция микроэмульсий нефтепродуктов вплоть до значений исходных концентраций 2000 мг/л (рис. 2,3). На примере микроэмульсий дизельного топлива (рис.3) показана зависимость эффективности очистки от начальной концентрации. Проскок загрязняющего компонента наблюдается лишь при исходных концентрациях 600-750 мг/л.

На рис. 4 приведены результаты очистки воды от растворенных нефтепродуктов после 2 ступеней(2 фильтров). При этом одновременно происходит (см. таблицу) очистка воды от соединений свинца поверхностно-активных веществ (ПАВ).


Эффективность работы станции фильтрации
Показатель |
Сточная вода |
Очищенная вода |
ПДК для рыбохоз. водоемов |
Степень очистки, % |
Нефтепродукты, мг/л |
10-85 |
0,7 |
0,05 |
90-98 |
Свинец, мг/л |
0,0046 |
0,0009 |
0,1 |
80 |
Фенолы, мг/л |
0,028 |
0,001 |
0,001 |
96 |
ХПХ, мгO2/л |
400 |
340 |
- |
- |
БПК, мгО2/л |
85 |
31 |
3 |
- |
ПАВ, мг/л |
2-7 |
0,1-2 |
0,5 |
70-90 |
Литература
1. Сорбент для сбора нефти с поверхности воды. Патент РФ № 2061540 от 10.06.96
2. Сироткина Е.Е. Применение новых адсорбентов для комплексной очистки воды /Е. Е. Сироткина, В.Г.Иванов, О.В.Глазков и др.//Химия в интересах устойчивого развития. – 1997. № 4. Т. 5. С. 429 – 437.
3. Глазкова Е.А. Адсорбция нефтепродуктов из водных эмульсий на многослойном адсорбенте / Е.А. Глазкова, О.В. Глазков, В.Г.Иванов и др. // Нефтехимия. – 2001. №1. Т.41. С. 65-67.
Воронежский государственный технический университет
УДК 621.357
Б.А. Спиридонов
СТРУКТУРА И МОРФОЛОГИЯ ОЛОВО-НИКЕЛЕВЫХ ПОКРЫТИЙ, ОСАЖДЕННЫХ ИЗ ФТОРИД-ХЛОРИДНЫХ ЭЛЕКТРОЛИТОВ
Исследовано влияние режимов электролиза на структуру и морфологию олово-никелевых покрытий, осажденных из фторид-хлоридного электролита с добавкой ОС-20. Установлено, что при повышенной катодной плотности тока на отдельных участках поверхности образуются сфероиды, фазовый состав которых изучен микрорентгеноструктурным методом
Известно, для осаждения покрытий сплавом олово-никель с содержанием олова 50-65% практическое применение получили фторидхлоридные электролиты 1-4, основными компонентами которых являются хлориды олова и никеля и фториды натрия и аммония. В присутствии фторида аммония покрытия осаждаются блестящие и хрупкие, а на поверхности возникают слабовыраженные мелкие трещины, которых становится больше при увеличении концентрации фторида аммония. При введении в электролит фторида натрия вместо фторида аммония трещинноватость покрытий практически исчезает и возрастает их эластичность, однако при этом осадки становятся матовыми.
Трещинноватость покрытий снижает их защитные свойства, которые можно повысить путем увеличения толщины осадков. Установлено, что наибольшей коррозионной устойчивостью обладают покрытия толщиной от 15 мкм и выше с подслоем меди около 30 мкм 3. Без медного подслоя коррозионностойкие покрытия Sn-Ni осаждаются из электролита с добавкой ОС-20.
Условия проведения электролиза влияют не только на коррозионную стойкость покрытий, но и на некоторые физико-механические свойства – микротвердость, износостойкость и др. 1, которые определяются прежде всего структурой и фазовым составом катодных осадков.
Многие металлы характеризуются многообразной структурой. Наиболее часто встречаются пирамидальные, слоистые и ребристые структуры поверхности. Характерным элементом большинства структур являются макроступени, а особыми случаями – образование спиралей роста, нитевидных кристаллов, дендритов и сфероидов 5.
При изучении структуры электролитических покрытий применяют в основном физические методы исследований. Для исследования морфологии поверхности роста электролитических осадков наибольшее применение нашел метод сканирующей электронной микроскопии. Например, использование этого метода при изучении электрокристаллизации никеля позволило установить, что на начальных стадиях возникают многократно двойниковые кристаллы размером порядка 50 нм с пятиугольной псевдосимметрией. В процессе дальнейшего роста кристаллов наблюдались дефекты структуры с грубой полусферической морфологией.
Существенное влияние на структуру покрытий оказывает введение в электролиты поверхностно-активных добавок, которые блокируют активные центры нуклеации, тормозят линейный рост кристаллов, а также понижают работу образования зародышей. Например, при электрокристаллизации никеля из электролита без ПАВ в полученных осадках нередко наблюдается локализация мелких зародышей в виде кольца, окружающего крупный агрегат, что связывают с проявлением зон экранирования. Введение в электролит никелированного кремнийорганического соединения крелан-1 способствует уменьшению возникающих зародышей и увеличению их числа на катоде 6.
Ранее проведенными исследованиями было установлено, что при введении во фторидхлоридный электролит поверхностно-активной добавки ОС-20 изменяются как кинетические характеристики [7], так и фазовый состав, а также заметно повышаются защитные свойства покрытий Sn-Ni [4].
Цель работы – продолжение изучения структуры и морфологии покрытий сплавов Sn-Ni, осажденных из фторид-хлоридного электролита с добавкой ОС-20 при различных режимах электролиза.
Олово-никелевые покрытия осаждали на медную основу из двух электролитов состава (г/л): №1. NiCl2·2H2O – 200; SnCl2·2H2O - 40; NH4F – 60. №2. NiCl2·2H2O – 200; SnCl2·2H2O – 40; NH4F – 60; OC-20 – 5. Температура электролита 50 0С, рН 4.5. Катодная плотность тока (ik)=1- 4 A/дм2.
Рентгеноспектральный анализ катодных осадков Sn-Ni проводили на электроннозондовом микроанализаторе JSM-840 c cистемой энергодисперсионного анализа LINK-860. Позиционирование образцов, выбор места для анализа и планарного размера анализируемой области 300×300мкм проводили путем получения во вторичных электронах. Структурные исследования проводили на сканирующем электронном микроскопе JSM-6380LV в режиме вторичных электронов.

Рис.1. Морфология поверхности пленок SnNi при различных ik и времени электролиза
Катодная плотность тока (A/дм2 ); а – 0,5; б – 1,5.
Из риссунка1а видно, что из электролита №1 при низких ik=0,5A/дм2 (t=5 мин.) формируются сплошные осадки с изометрически-зернистой структурой. Видно, что зерна имеют округлую форму и небольшой размер (10-20 нм), что характерно для гальванических покрытий, осажденных из комплексных электролитов 8. Во фторидхлоридных электролитах олово образует комплексные анионы SnF42-, SnF64- и SnCl64-, а никель-комплексное соединение NiSnF4 9. Фазовый состав осадков представляет собой в основном интерметаллид NiSn с параметрами решеток (а = 4.15 Å, с = 5.12 Å).
С увеличением катодной плотности тока ik до 1,5А/дм2 (t=5мин) наблюдается рост кристаллитов и их слияние в более крупные образования – кластеры (рисунок1б), размеры которых составляют (3-7) мкм. При увеличении продолжительности электролиза с 5 до 20 мин. при той же ik=1,5A/дм2 происходит измельчение структуры и возрастает неоднородность в размерах кластеров от 300 до 3000 нм. Это, по- видимому, можно объяснить измененим как структуры, так и фазового состава за счет включения основных соединений олова и никеля, образующихся в процессе длительного электролиза вследствие повышения рНs.
При введении ОС-20 во фторидхлоридный электролит заметно изменяется как фазовый состав, так и структура покрытий. На рис. 2 представлена морфология поверхности осадков, полученных из электролита № 2. Видно, что в сравнении с осадками, полученными из электролита №1 без ОС-20, в присутствии этой добавки формируются кристаллиты более крупных размеров (30-40 нм). Состав сплава представлен двумя фазами – Ni3Sn4 и Ni3Sn2 7. Полученные данные согласуются с поляризационными измерениями.
Добавка ОС-20 ингибирует осаждение обоих металлов, при этом поляризация составляет порядка 0.4 В (I k= 4 A/дм2) при одновременном их осаждении. Пример подобной зависимости морфологии поверхности от поляризации был показан в работе 5. При изучении электрокристаллизации висмута из электролита было установлено, что если поляризация составляет 0.06 В, то осаждаются плотные мелкодисперсные покрытия, кристаллиты которых имеют неправильный холмистый вид с искривленными ребрами, а с увеличением поляризации до 0.12 В размеры кристаллитов возрастают до 5 мкм. При дальнейшем повышении поляризации катода происходит образование неравнозернистой структуры висмута.

Рис. 2. Морфология поверхности пленки SnNi, полученной из электролита № 2

Рис. 3. Морфология поверхности сфероидов SnNi; а - ´800, б -´1000

Рис. 4. Рентгеноспектральный микроанализ пленки SnNi.
Особый интерес представляют осадки SnNi, полученные при повышенных значениях катодной плотности тока (от 4 A/дм2 и выше). В этих условиях электролиза на поверхности покрытий появляются одиночные сфероиды крупных размеров диаметром от 0.1 до 0.2 мм. Из рисунков 3а и 3б видно, что внутреннее строение сфероида сложное.
Видно, что сфероид состоит из множества ему подобных сфероидов, но меньших размеров, что свидетельствует о протекании сложных взаимодействий между медной подложкой, разрежающимися на ней ионами никеля и олова и добавкой ОС-20.
Рентгеноспектральный микроанализ позволил установить, что в центре сфероида образуется фаза, состоящая в основном из никеля, окружающий сфероид слой – из сплава SnNi, а на периферии – олова (рис. 4).
Можно предположить, что никель, который в сравнении с оловом выделяется с большим перенапряжением, является центром зарождения кристаллической фазы никеля, поскольку именно в центре образующегося сфероида возникает повышенная локальная плотность тока. Добавка ОС-20 еще в большей степени ингибирует выделение обоих металлов, что усиливает локализацию катодного тока [8, 9].
Таким образом, можно заключить, что при электроосаждении покрытий олово-никель происходят сложные процессы кристаллизации катодных осадков, сопровождающиеся образованием сфероидов, состав и структура которых зависят от режимов электролиза и присутствия повехностно-активной добавки ОС-20.
Литература
1. Кудрявцев Н.Т., Тютина К.М. Электролитическое осаждение сплавов. - М.: Машгиз. 1961. - 76 с.
2. Вячеславов П.М. Электролитическое осаждение сплавов. М.: Машиностроение. 1977. - 92 с.
3. Гальванические покрытия в машиностроении: справочник в 2-х томах/под ред. Шлугера М.А. М.: Машиностроение. 1985.- 240 с.
4. Спиридонов Б.А., Фаличева А.И. //Защита металлов. 1998. Т. 34. № 4. с. 442-444.
5. Поветкин В.В. Структура электролитических покрытий. В.В. // Поветкин, И.М. Кавенский. М.: Металлургия. 1989. - 136 с.
6. Горбунова К.М., Кузнецова Е.В. //Ранние стадии электрокристаллизации никеля. Черкассы. 1982. 20с. Деп. В ОНИИТЭ хим. 1982. № 970.- 82 с.
7. Спиридонов Б.А., Березина Н.Н. //Защита металлов. 2004. т.40. № 1. - с.93.
8. Левин А.И. Электрохимия цветных металлов. М.: Металлургия. 1982.- 256 с.
9. Федотьев Н.П., Бибиков Н.Н., Вячеславов П.М., Грилихес С.Я. Электролитические сплавы. М.: Машгиз. 1962. 312 с.
10. Михайлов Е.Ф., Власенко С.С. Успехи физических наук. 1995. Т.165. № 3. - 263 с.
Воронежский государственный технический университет
УДК 541.183
В.П. Горшунова, А.В. Рыльков, О.В. Чибисова, В.А. Небольсин
ВЛИЯНИЕ ПРИРОДЫ ПОВЕРХНОСТНЫХ ГИДРОКСИЛЬНЫХ ГРУПП НА СОРБЦИОННЫЕ СВОЙСТВА КРЕМНЕЗЕМНЫХ СОРБЕНТОВ
Приведены результаты исследования поглощения аммиака термически активированными силикагелями разной пористости, выявлено влияние поверхностных структур, содержащих гидроксильные группы, на поглотительные свойства сорбентов
Аммиак на сегодняшний день является основным хладагентом холодильных установок как на пищевых комбинатах большой мощности, так и на малых предприятиях, связанных с производством мясной и молочной продукции. В связи с тем, что концентрация аммиака в вентиляционных выбросах мала, наиболее рациональным (а иногда и единственным) методом очистки служит адсорбционный, с которым ни один из известных методов тонкой очистки большинства жидких и газообразных веществ не может конкурировать ни по стоимости, ни по эффективности.
В качестве адсорбентов используют пористые материалы с высокоразвитой поверхностью. Они могут иметь синтетическое или природное происхождение.
Внутренняя структура наиболее распространенных на практике промышленных сорбентов характеризуются наличием различных размеров и форм пустот или пор, среди которых различают макро-, переходные (мезо-) и микропоры.
Суммарный объем микропор в единице массы или объема адсорбента определяет в решении задач газоочистки как скорость (интенсивность) поглощения целевого компонента, так и адсорбционную способность (величину адсорбции) твердым поглотителем этого компонента. Суммарный объем микропор обычно не превышает 0,5 см3/г. Их размеры условно ограничены величиной эффективного радиуса rэф. = 1,5∙10-9м (1,5 нм) и соизмеримы с rэф. адсорбируемых молекул. Во всем пространстве микропор существует поле адсорбционных сил, что приводит к объемному заполнению пор молекулами адсорбата за счет действия физических сил.
Переходные поры (мезапоры) характеризуются величинами эффективных радиусов от 1,5∙10-9 до 2∙10-7 м (1,5 - 200 нм). В отличие от микропор в них возможна послойная или полимолекулярная адсорбция, так как адсорбционные силы здесь не перекрывают всего объема пор ввиду небольших полей их действия. Завершение заполнения объема переходных пор происходит при определенных условиях по механизму капиллярной конденсации, вызываемой понижением давления пара адсорбируемого вещества над вогнутым под действием сил поверхностного натяжения мениском жидкости в порах (капиллярах). Отнесенная к единице массы удельная поверхность переходных пор промышленных адсорбентов обычно находится в интервале 10 – 400 м2 / г.
Макропоры промышленных адсорбентов обладают размерами эффективных радиусов, превышающими 2∙10-7 м (200 нм). Удельная поверхность этой разновидности пор обычно составляет лишь 0,5 – 2 м2 / г, что предопределяет ничтожную величину адсорбции на их стенках. Капиллярная конденсация в этих порах отсутствует. Макро- и переходные поры выполняют роль транспортных путей, обеспечивающих при адсорбции доступ поглощаемых молекул в микропоры и эвакуацию адсорбата при регенерации адсорбента.
Большинство промышленных адсорбентов являются смешаннопористыми материалами. Однако в соответствии с преобладающим в их структуре размером пор они могут подразделяться на микро- и макропористые.
К основным типам промышленных адсорбентов относятся активные угли, силикагели, алюмогели (активный оксид алюминия), цеолиты и иониты.
В данной работе изучали поглотительные свойства силикагелей разной пористости: крупнопористого (КСКГ) и мелкопористого (КСМГ), которые по своей химической природе являются кремнеземными сорбентами.
Наличие связанных и отдельно стоящих гидроксильных групп, их расположение на поверхности аморфного кремнезема, степень дегидроксилирования поверхности, степень ее упорядоченности обусловливают различие свойств кремнеземов.
По данным Снайдера [1] на поверхности кремнезема в различных соотношениях может находиться 5 видов групп (рис.1):

Рис. 1. Структурные группы на поверхности кремнеземов
а) силанольная (связанная) вода - свободные, отдельно стоящие ОН-группы; б) физически связанная вода – молекулы воды, имеющие водородные связи с силанольными группами; в) дегидратированные оксиды – силоксановые группы; г) близнецовые (геминальные) группы ОН, связанные с одним атомом кремния; д) реакционно- способные вицинальные группы ОН, преобладающие в тонкопористых кремнеземах – соседние, близко расположенные ОН-группы, связанные между собой водородной связью.
Основное значение для адсорбции кремнезема имеют реакционноспособные силанольные группы на поверхности кремнезема. Силанольные группы (рис.1,а) значительно более активны, чем силоксановые группы (рис.1, в), так как протон силанольной группы имеет слабокислый характер и способен вступать в реакции обмена, а также образовывать водородные связи с полярными молекулами. Близкими по свойствам к силанольным группам являются вицинальные гуппы (рис.1, д), образующиеся в тонкопористых кремнеземах при взаимодействии друг с другом двух расположенных рядом силанольных групп. Силикагели относятся к самым распространенным кремнеземным сорбентам.
Исследование сорбции аммиака термически активированными силикагелями разной пористости проводили эксикаторным методом [2]. Для изучения адсорбции в эксикаторах создавали атмосферы с содержанием аммиака 5, 10, 20, 50, 100, 200 и 400 мг/м3, для чего готовили растворы аммиака различной концентрации в соответствии с данными справочника [3]. Поскольку в исследуемых условиях содержание паров воды в 1,3 - 1,6 раз меньше, чем аммиака, то преимущественно сорбируется аммиак. Насыщение сорбента проводили в статических условиях. Получали сначала кинетические зависимости адсорбции от времени, по которым затем строили изотермы адсорбции (рисунок).
Обращает на себя внимание то обстоятельство, что при одинаковых условиях эксперимента лучшими поглотительными свойствами по отношению к аммиаку обладает мелкопористый силикагель (в 2,2 – 3 раза).

Рис. 2. Зависимость адсорбционной способности силикагелей разной пористости от объемной концентрации аммиака в газовой среде: 1 – силикагель марки КСКГ; 2 – силикагель марки КСМГ
Как сказано выше, микропоры имеют размеры, соизмеримые с размерами адсорбируемых молекул. Эффективные радиусы пор находятся в интервале от 1,0 до 1,5 нм. (Диаметр молекул аммиака равен 0,36 нм, диаметр молекул воды – 0,27 нм). Характерной чертой адсорбции в микропорах является существенное повышение энергии адсорбции по сравнению с адсорбцией в более крупных порах [4]. В случае поглощения газов повышение энергии адсорбции в микропорах приводит к резкому возрастанию адсорбционной способности в области малых равновесных концентраций, что и наблюдается на рис. 2. В микропорах происходит физическая адсорбция, т.е. между молекулами адсорбента и молекулами адсорбата действуют силы Ван-дер-Ваальса. Кроме того, следует учитывать образование водородных связей, которыми силанольные и вицинальные группы удерживают молекулы аммиака. Концентрация этих групп в микропорах выше, чем в макропорах, так как сама удельная поверхность микропор превышает удельную поверхность макропор. Этим можно объяснить тот факт, что лучшими поглотительными свойствами по отношению к аммиаку обладает мелкопористый силикагель.
Таким образом, можно заключить, что помимо физической адсорбции, обусловленной межмолекулярными силами Ван-дер-Ваальса, на поверхности силикагелей имеются структуры, содержащие гидроксильные группы ОН (прежде всего силанольные и вицинальные группы), которые играют основную роль в процессе сорбции аммиака, как полярного вещества. Дипольный момент молекулы аммиака равен 1,64 D. Поэтому мелкопористый силикагель имеет большую поглотительную способность по сравнению с крупнопористым. Можно считать, что использование термически активированного мелкопористого силикагеля в качестве сорбента для улавливания аммиака в вентиляционных выбросах является целесообразным.
Литература
Snyder L.R., Ward J.W. – Prinsipls of adsorption cromatography.- N.Y. – Marsel – Dkker. – 1966. - № 12. - P.3941-3952.
Кельцев, Н.В. Основы адсорбционной техники. – М.: Химия, 1981. – 592 с.
Рабинович В.А. Краткий химический справочник / В. А. Рабинович, З. Я. Хавин. – С.-Пб.: Химия, 1997. – 392 с.
Модифицированные кремнеземы в сорбции, катализе и хроматографии / Под ред. Г.В. Лисичкина. – М.: Химия,1986. – 248 с.
Воронежский государственный технический университет
УДК 621. 367. 502.7
И.М. Винокурова
УЧЕТ ГИДРОДИНАМИЧЕСКИХ РЕЖИМОВ АНОДНОЙ ОБРАБОТКИ МЕТАЛЛОВ
Приводятся данные по определению методов расчета процессов обработки с учетом изменения гидродинамических параметров
Природа металла оказывает существенное влияние на скорость его электрохимического растворения, так введение в металл или сплав более пассивирующего легирующего элемента в большей или меньшей степени передаёт свойство повышенной пассивируемости сплаву. Изучение анодного поведения титана говорит о том, что скорость роста оксида и скорость растворения металла контролируется стадией переноса ионов через пленку. По мере приближения потенциала титана к равновесному кислородному, количество адсорбированного кислорода (в виде ионов OH- или О-) возрастает, что приводит к уменьшению дефектности пленок и соответственно снижает ток растворения титана.
Данная модель растворения титана в пассивном состоянии была подтверждена результатами изучения влияния относительно небольших (до 6 %) добавок легирующих элементов (Al, V, Мо, Zr, Nb, Сr, Мn, Sn) на пассивационные характеристики титана. Все сплавы имели α -структуру, за исключением сплавов Тi - Mо и Тi - V, содержащих более 3 % Мо или V, которые имели структуру
α + β.
Рассмотрение стационарных скоростей анодного растворения сплавов в 40 % Н2SО4 при Е = 1,0 В и при 80 °С показало, что Al, V, Мо, Zr и Nb увеличивают, Сr и Мn уменьшают, а Sn (в пределах возможной ошибки опыта) не влияет на скорость анодного растворения титанового сплава в пассивном состоянии.
На скорость растворения сплавов титана в пассивном состоянии легирующие компоненты могут влиять путем изменения скоростей следующих процессов:
1) непосредственного электрохимического перехода ионов металла, мигрирующих через окисную пленку, в раствор
Ti + H2O TiO2+ + 2H+ + 4e;
2) химического растворения пассивной пленки
TiO2 + 2H+ TiO2+ + H2O.
Легирующие элементы могут влиять на эти процессы как путем изменения структуры и толщины образующейся пленки, так и путем изменения ее дефектности и ионной проводимости. Электронографическое исследование структуры окисных пленок в условиях стационарного анодного растворения показало, что на всех сплавах, как и на чистом титане, образуются пленки идентичного состава ТiО2 со смешанной структурой рутила и анатаза.
Применение
импульсного тока обработки металлов
позволяет не только улучшить качество
изделий учитывающих состав металла, но
и расширить область применения этих
технологий. Серия коротких импульсов
(с малым значением
![]() )
маркирует на поверхности зоны травления
(сканирующие импульсы). Вслед за первой
серией логическая интегральная схема
формирует серию импульсов (
)
маркирует на поверхности зоны травления
(сканирующие импульсы). Вслед за первой
серией логическая интегральная схема
формирует серию импульсов (![]() которые в 23
раза выше). С помощью этой серии
осуществляется расширение каналов
(формирующие импульсы). Число таких
последовательно следующих серий
определяется исходя из поставленной
задачи для формирования профиля канала
и качества поверхности рис. 1.
которые в 23
раза выше). С помощью этой серии
осуществляется расширение каналов
(формирующие импульсы). Число таких
последовательно следующих серий
определяется исходя из поставленной
задачи для формирования профиля канала
и качества поверхности рис. 1.
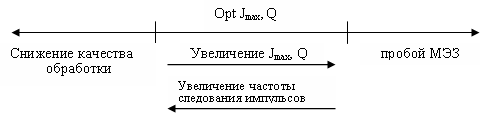
Рис.
1. Область возможных оптимальных значений
![]()
В этом случае задача оптимизации процесса становится реально решаемой и локальные изменения температур, концентраций, токов отдельных участков электрода становится менее заметными. Скорости перемещения ионов-окислитей и продуктов реакции возрастают, что способствует улучшению условий тепломассопереноса в зоне электрохимической реакции.
Приближенное суждение о влиянии легирующих элементов на скорость химического растворения пассивных пленок может быть сделано по времени самоактивации τа электродов в тех же условиях после прекращения анодной поляризации. Все исследованные сплавы, кроме сплавов Тi — А1 и Тi — Zr, имеют одно и то же время самоактивации, близкое к τа титана, независимо от того, увеличивают они или уменьшают скорость анодного растворения. Ток, идущий на возобновление.
При повышении скважности импульсного тока сокращается глубина диффузионного слоя и увеличивается скорость переноса ионов за счёт электрической составляющей суммарного вектора перемещения частиц.
Использование секционированного электрода позволило установить, что эффекты тепловыделения зависят как от порядкового номера элемента электрода, так от технологических параметров режима обработки. Конструкция датчика, его основные узлы и элементы представлены на рис. 2. Для реализации адекватных условий распределения тока по секциям в каждую из ветвей электрода включено балластное сопротивление, исключающее неравномерность распределения тока по секциям за счёт различных значений переходных сопротивлений контактов. Фиксация значений тока и ТS для каждой секции осуществлялось в синхронном режиме.
Распределение плотности тока по секциям зависит от целого ряда причин, главным из которых следует считать химический состав электролита, скорость его протока и характер газонаполнения по длине канала обработки. В зависимости от химического состава электролита изменяется интенсивность газонаполнения межэлектродного зазора, степень пассивации различных участков электрода, а также кинетика и механизм анодного окисления металла. Например, если раствор содержит только хлорид натрия, то наиболее вероятными процессами на электродах будут ниже перечисленные реакции:
анод Tio – ne Ti+ne (1)
2H2O - 4e O2 + 4H+ (2)
катод 2H2O + 2e H2 +2OH- (3)
2H+ + 2e 2Ho H2 . (4)
Следствием электрохимической реакции (1) является процесс химической гидратации иона Ti4+, сопровождающийся выделением тепла в довольно значительном количестве
(~1022
![]() ).
).
Реакция (2) сопровождается последующими химическими процессами молизации атомов кислорода тепловой эффект которой составляет 117 ккал/моль, и процессом гидратации ионов H+ для которого тепловой эффект имеет значение 253 ккал/моль.

Рис. 2. Конструктивный чертёж датчика секторного типа
1- контактные выводы дифференциальных термопар:
2 - рабочий электрод; 3-корпус сектора
На
катоде приоритетность реакции (3 и 4)
определяется кислотностью приэлектродного
слоя рHS,
поэтому суммарный тепловой эффект будет
определяться величиной
![]() ,
и
,
и
![]() .
.
В
растворах содержащих нитрат-ионы (250
г/л) процессы на электродах должны
протекать по аналогичным схемам, но
засчёт сильно пассиви-рующего действия
нитрат-ионов на аноде (в растворимом
металле возможным становится образование
катодных участков). В результате этого
на отдельных элементах анода становится
возможным процесс восстановления
![]() -
иона по схеме
-
иона по схеме
![]() .
(5)
.
(5)
В случае бинарных систем, когда на аноде становится возможным осуществление и окисление анионов и нейтральных молекул и восстановление (на катодных участках) анионов с малыми значениями потенциалов восстановления механизм растворения металла становится весьма сложным.
Согласно другому, возможному механизму восстановления нитрат-ионов на аноде, донором электронов могут быть непосредственно нейтральные атомы титана. Исследованиями авторов [6] установлено, что зависимость токораспределения по длине электрода носит весьма сложный характер и определяется не только химическим составом электролита, но и определяется также продолжительностью электролиза.
На рис. 3 представлены зависимости распределения плотности тока по длине канала обработки изделий из титанового сплава ВТ-3-1.
Авторы дают заключение о том, что такие изменения анодного токораспределения по длине канала не может быть обусловлено лишь изменением электропроводности электролита и степенью газонаполнения межэлектродного зазора. Сопоставляя кривые распределения токов в хлоридных растворах рис. 3 для разного времени обработки они считают, что характер их изменения определяется, прежде всего, различием конвективных факторов для определённых участков канала, а также зависит от динамики, эпюр локальных токов.
В хлорид-нитратных электролитах первоначальное распределения тока монотонно убывает, по длине канала, что отражает влияние концентрационного фактора и частично конвективного переноса. Подобная трактовка характера изменения плотности тока по длине канала может быть принята с некоторыми ограничениями.
Использование секционного электрода с термодатчиками позволило нам установить, что газонаполнение МЭЗ и температура поверхности электродов по секциям также зависят от состава электролита, скорости его протока и продолжительности электролиза.

Рис. 3. Распределение плотности тока по длине канала обработки по [6]: а) =20 с; б) =2 с:
1 - электролит, содержащий NaCl, [C]=150г/л; 2 -электролит, содержащий NaNO3, [C]=250г/л; 3 -электролит, содержащий NaCl , [C]=100г/л.
В реальных электрохимических системах оценить тепломассоперенос можно лишь методом физических и математических моделей, включающих в себя все факторы влияния и закономерности их изменения.
С учётом распространения теплового потока за счёт тепло-проводности, конвективной составляющей и химическаго потенциала дифференциальные уравнения тепло- и массопереноса, определяемые через параметры системы (плотность раствора, температуропроводность, химический потенциал, коэффициент диффузии) для стационарных условий могут быть представлены в виде выражений:
![]()
![]()
![]() ;
(6)
;
(6)

![]()
![]() .
(7)
.
(7)

Рис. 4. К расчёту тепломассопереноса в МЭЗ при электрохимической обработки титана
Анализ экспериментальных зависимостей установленных нами [1] и другими исследователями [5, 6] показывает, что для совместного решения этих уравнений необходимо определить граничные условия и принять необходимые допущения, позволяющие упростить вычисления, не уменьшающие точности определения параметров.
На рис. 4 приведена схема, поясняющая выбор критериев расчёта процесса тепломассопереноса в условиях электрохимической обработки титана. На данной схеме направление протока электролита осуществляется по оси Z, расстояние между электродами отсчитывается по оси X, а высота рабочего сектора –по оси Y. В этом случае для поверхности катода x=0, для поверхности анода x + dx, где d x – МЭЗ.
Тепломассоперенос вдоль оси Z сопровождается интенсивным газонасыщением элементарного объёма электролита, ограниченного плоскостями 1, 2, 3, 4 и 5, 6, 7, 8. На схеме рис. 4 расстояние между электродами условно увеличено для удобства изображения, в реальных условиях он составляет 0,05-0,1 мм. Газораспределение по высоте электрода (ось Y) также будет изменяться по законам, определяемым кинетикой катодного и анодного процессов. Для элементарного объёма электролита ограниченного выше названными плоскостями при работе электродов в непрерывном режиме максимальное газонасышение будет наблюдаться в центре межэлектродного зазора на площадке ограниченной прямоугольником (5, 6, 7, 8) для первой секции электрода.
Так как в процессе обработки металла по мере перемещения элементарного объёма электролита от 1-ой секции к последующей степень дисперсности газа становится ниже за счёт слияния отдельных агрегаций в более крупные, то электропроводность элементарного объёма электролита последней секции за счёт этого фактора должна уменьшиться. С другой стороны температура электролита в последней секции повышается относительно первой на значительную величину, и в зависимости от скорости протока, плотности тока и химического состава электролита.
Поскольку значение и Z для каждой секции электродов будут различными, то в уравнения определяющие тепло- и массоперенос (6 и 7) вместо значений T и необходимо ввести их математические выражения позволяющие определить эти параметры для каждого промежутка времени и координаты.
Например,
если плотность электролита на входе в
сектор первого электрода равна,
![]() то на выход первого сектора значение
то на выход первого сектора значение
![]() будет меньше за счёт увлечения
газонасыщения и повышения температуры
электролита.
будет меньше за счёт увлечения
газонасыщения и повышения температуры
электролита.
Поскольку количество выделяющейся тепловой энергии для каждого сектора электрода будет различным, вследствие перераспределения весовых коэффициентов между отдельными реакциями, то общий тепловой баланс электродной системы может быть определён по формуле
![]() ,
(8)
,
(8)
![]() ,
(9)
,
(9)
где
![]() -
число секций;
-
число секций;
![]() - изменение удельной теплоёмкости по
секциям электрода;
- изменение удельной теплоёмкости по
секциям электрода;
![]() - изменение температуры электролита по
секциям;
- изменение температуры электролита по
секциям;
![]() - объём электролита в межэлектродном
зазоре.
- объём электролита в межэлектродном
зазоре.
Особенностью электрохимической обработки титана является степень газонасыщения электролита в межэлектродном зазоре. При этом скорости протока электролита достигают значений, при которых вносится турбулентное движение электролита. Такой гидродинамический режим обеспечивает интенсивный массоперенос между слоями электролита, способствует более равномерному съёму металла по длине канала.
Таким образом, импульсная электрохимическая обработка металлов позволяет не только улучшить качество изделий, но и расширить область применения этих технологий. Предложенные способы позволяют резко сократить затраты на тепловую электрическую энергию и способствуют стабилизации условий тепломассопереноса в рассматриваемых электродных системах.
Литература
1. Саушкин Б. П. Электрохимическая обработка изделий из титановых сплавов / Б. П. Саушкин, Ю. Н. Петров, А. З. Нистрян, А. В. Маслов // Кишинёв. Штиница. 1988. 200 с.
2. Мандрыкина И. М. Исследование взаимосвязи термокине-тических и электрохимических параметров при импульсных режимах обработки титановых сплавов. Дис… Воронеж. 1998. 210 с.
3. Шалимов Ю. Н. Оптимизация электрохимического процесса обработки алюминиевой фольги в производстве конденсаторов / Ю. Н. Шалимов, И. М. Мандрыкина, Ю. В. Литвинов Воронеж: Изд-во ВГТУ, 2000. 343 с.
4. Винокурова И. М., В. П. Смоленцев. Математическое описание процессов переноса в турбулентных потоках при электрохимиической обработке металлов. Современная электротехнология в промышленности центра России. Сб. тр. VIII региональ. научно-техн. конф. Тула, 1 июня 2006. –Тула:ТулГУ С. 22-26.
Воронежский государственный технический университет
УДК 541.183
В.П. Горшунова, А.В. Рыльков, О.В. Чибисова, В.А. Небольсин
СРАВНИТЕЛЬНЫЕ АДСОРБЦИОННЫЕ СВОЙСТВА ТЕРМОХИМИЧЕСКИ МОДИФИЦИРОВАННЫХ КРЕМНЕЗЕМНЫХ СОРБЕНТОВ И АЛЮМОГЕЛЯ
Проведено сопоставление поглотительных свойств термохимически активированных силикагелей разной пористости и активного оксида алюминия по отношению к аммиаку
Известно, что разнообразное применение в промышленности нашли эффективные кремнеземные адсорбенты и избирательные поглотители. Большое развитие получило химическое модифицирование поверхности дисперсной фазы, что дает возможность направленно изменять свойства сорбентов и расширяет возможности их практического применения. [1]. Наиболее распространенными кремнеземными сорбентами являются силикагели. Из оксидных сорбентов широко используется активный оксид алюминия (алюмогель).
Силикагели имеют корпускулярное строение: их поры образованы промежутками между частицами SiO2. Эти частицы имеют сферическую форму глобул. Свойства глобульных частиц определяются их размером и средним числом касаний, приходящихся на каждую частицу. Мелкие частицы при плотной упаковке образуют структуру мелкопористых силикагелей, крупные частицы при рыхлой упаковке – структуру крупнопористых силикагелей. Адсорбционные свойства силикагелей существенно зависят от наличия на их поверхности силанольных групп ≡ Si – OH, способных к образованию водородных связей с молекулами сорбата. На адсорбционные свойства большое влияние оказывает структура сорбента. Микропористые силикагели имеют большую удельную поверхность – от 600 до 800 м2/г, макропористые – от 120 до 500 м2/г.
Алюмогель – это аморфное вещество, как и силикагели, является хорошим гидрофильным адсорбентом с сильно развитой пористой структурой. Активный оксид алюминия получают из технического гидроксида алюминия обработкой его едким натром и осаждением азотной кислотой. Как и силикагели, оксид алюминия является полярным адсорбентом и вследствие наличия поверхностных гидроксильных групп проявляет склонность к образованию водородных связей с молекулами сорбата.
Основные марки выпускаемого отечественной промышленностью активного оксида алюминия представляют собой шариковые гранулы со средним диаметром 3-4 мм. Удельная поверхность алюмогелей составляет 170-220 м2/г, суммарный объем пор находится в пределах 0,6-1,0 см3/г, средний радиус пор и гравиметрическая плотность гранул шариковой формы составляют соответственно 6-10 нм и 600-900 кг/м3. В отличие от силикагелей алюмогели стойки к воздействию капельной влаги.
Поскольку молекулы воды и аммиака имеют большое сходство (диаметр молекулы воды равен 0,27 нм, а аммиака – 0,36 нм, а их дипольные моменты 1,84 D и 1,64 D соответственно), то интересно было изучить поглотительные свойства силикагелей и алюмогеля по отношению к аммиаку.
Целью данной работы явилось изучение адсорбции аммиака силикагелями разной пористости и алюмогелем, предварительно активированными раствором сульфата меди. Обработку сорбентов проводили 0,1 М раствором медного купороса в течение 24 часов при комнатной температуре, после чего высушивали в сушильном шкафу при температуре 120 – 130 оС до постоянной массы. Опытным путем, используя фотоколориметрический метод, установили время, в течение которого происходило насыщение сорбентов активирующим раствором. Результаты представлены на рис.1. Видно, что для насыщения сорбентов раствором медного купороса достаточно десяти часов. Значит, 24 часа выдержки сорбентов в активирующем растворе обеспечивают полную их пропитку данным раствором.
Рис.1. Зависимость массы катионов меди на сорбентах в процессе пропитки их раствором CuSO4 от времени: 1 – КСКГ; 2 – КСМГ; 3 - алюмогель
Далее
изучали адсорбцию паров аммиака
эксикаторным методом [2], сущность
которого состоит в насыщении помещенной
в бюкс навески сорбента парами адсорбтива
до установления равновесия при заданной
температуре. В эксикаторах создавали
среду аммиака с объемными концентрациями
5, 10, 20, 50, 100, 200 и 400 мг/м3.
растворы готовили в соответствии со
справочными данными [3]. По кинетическим
кривым, полученным для каждой объемной
концентрации, строили изотерму адсорбции
в координатах а, мг/г –
![]() ,
мг/м3.
,
мг/м3.
На рис. 2 представлена кинетическая зависимость адсорбции от времени для объемной концентрации аммиака 100 мг/м3.
На рис.3 показана изотерма адсорбции для химически модифицированных сорбентов.
На основании анализа результатов опыта можно сделать вывод о том, что адсорбция аммиака на химически модифицированном силикагеле марки КСМГ (мелкопористом) значительно выше, чем на крупнопористом силикагеле (от 1,7 до 2,0 раз). Это хорошо согласуется с особенностями структуры силикагелей. Как известно, на поверхности силикагелей имеются силанольные группы ≡ SiOH , которые при сближении друг с другом на расстоянии 0,3 нм могут взаимодействовать друг с другом, образуя водородную связь. При этом образуется вицинальные группы [2].

Рис.2. Зависимость адсорбции аммиака от времени на химически модифицированных сорбентах: 1 – силикагель марки КСКГ; 2 – силикагель марки КСМГ; 3 – алюмогель
Эти поверхностные группы являются очень активными. Они могут образовывать водородную связь с полярными молекулами, в том числе с аммиаком. Так как удельная поверхность мелкопористого силикагеля значительно больше, чем крупнопористого (у КСМГ –550 – 900 м2/г, а у КСКГ – 210 до 350 м2/г), то таких активных групп у крупнопористого силикагеля будет значительно больше, чем у мелкопористого силикагеля. Кроме того, в результате пропитки силикагелей раствором медного купороса их поры содержат аквакомплекс [Cu(H2O)4]2+. Характерный голубой цвет появляется после обработки раствором CuSO4 на гранулах крупнопористого силикагеля. У мелкопористого силикагеля голубой цвет выражен слабее. После проведения процесса сорбции на силикагеле марки КСКГ наблюдается интенсивный синий цвет,

Рис. 3. Изотерма адсорбции химически модифицированных сорбентов: 1 – силикагель марки КСКГ; 2 – силикагель марки КСМГ; 3 - алюмогель
характерный для амминокомплексов меди [Cu(NH3)4]2+. У мелкопористого силикагеля цвет изменяется в меньшей мере, преимущественно при больших объемных концентрациях аммиака. Значит, происходит реакция
[Cu(H2O)4]2+ + 4NH3 = [Cu(NH3)4]2+ + 4H2O
Это свидетельствует о том, что в процессе поглощения аммиака силикагелями наряду с образованием водородной связи аммиака с силанольными и вицинальными группами происходит образование донорно-акцепторной связи с катионом меди. Прочность этого комплекса сравнительно велика. Она определяется на основании расчета константы диссоциации аммиачного комплекса меди:
[Cu(NH3)4]2+ = Cu2+ + 4 NH3
Kнест.
 =
9,33∙10-13,
=
9,33∙10-13,
рК = - lg Kнест. = 12,03 [3].
Аналогичная картина наблюдалась у алюмогеля. После пропитки раствором медного купороса гранулы алюмогеля окрашивались в голубой цвет, который после насыщения аммиаком становился более интенсивным, особенно при выдерживании в атмосферах аммиака с большой объемной концентрацией. Значит, в порах алюмогеля происходит образование амминокомплекса синего цвета по приведенной выше реакции.
Изучение процесса пропитки сорбентов раствором сульфата меди подтвердило влияние размера пор на насыщение твердых сорбентов катионами меди. Так как в растворе присутствуют объемные аквакомплексы меди, то концентрации катионов меди на поверхности крупнопористого силикагеля больше, чем у мелкопористого, и самая меньшая концентрация у алюмогеля (рис. 1).
Таким образом, исследование поглотительных свойств химически модифицированных кремнеземных сорбентов (силикагелей) разной пористости и алюмогеля (активного оксида алюминия) по отношению к аммиаку показало, что большей адсорбционной способностью обладает мелкопористый силикагель марки КСМГ, далее следует алюмогель. Меньшими поглотительными свойствами обладает термохимически модифицированный силикагель марки КСКГ.
Литература
1. Модифицированные кремнеземы в сорбции, катализе и хроматографии / Под ред. Г.В. Лисичкина. – М. : Химия,1986. – 248 с.
2. Кельцев, Н.В. Основы адсорбционной техники. – М.: Химия, 1981. – 592 с.
3. Рабинович В.А. Краткий химический справочник / В.А. Рабинович, З.Я. Хавин. – С.- Пб.: Химия, 1997. – 392 с.
Воронежский государственный технический университет
