
- •Теоретическое введение
- •Дисперсные системы
- •Способы выражения концентрации растворов
- •Давление пара растворов
- •Осмотическое давление
- •Образцы решения задач
- •Диссоциация электролитов. Константа диссоциации
- •Ионное произведение воды. Водородный показатель
- •Произведение растворимости
- •Реакции обмена в растворах электролитов. Ионно-молекулярные уравнения реакций
- •Гидроли3 солей
- •Варианты контрольных заданий Вариант 1
- •Вариант 2
- •Вариант 3
- •Вариант 4
- •Вариант 5
- •Вариант 6
- •Вариант 7
- •Вариант 8
- •Вариант 9
- •Вариант 10
- •Вариант 11
- •Вариант 12
- •Вариант 13
- •Вариант 14
- •Вариант 15
- •394026 Воронеж, Московский просп., 14
ФГБОУ ВО «Воронежский государственный технический
университет»
Кафедра химии
РАСТВОРЫ
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
для самостоятельной работы и контрольные задания для проверки знаний по теме «Растворы и их свойства» дисциплины «Химия» для студентов направлений 11.03.01, 11.03.04, 12.03.04, 14.03.01, 16.03.01, 22.03.01, 22.03.02, 27.03.01, 27.03.02 специальности 11.05.01 очной формы обучения
0
4
7
100
14
PH
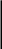

[H]
100
10
-4
10
-7
10
-10
10
-14
Реакция кислая → нейтральная → щелочная
Воронеж 2015
Составители: канд. техн. наук В.В. Корнеева, канд. техн. наук А.Н. Корнеева, д-р физ.-мат. наук В.А. Небольсин
УДК 546 + 541.8
Растворы: методические указания для самостоятельной работы и контрольные задания для проверки знаний по теме «Растворы и их свойства» дисциплины «Химия» для студентов направлений 11.03.01, 11.03.04, 12.03.04, 14.03.01, 16.03.01, 22.03.01, 22.03.02, 27.03.01, 27.03.02 специальности 11.05.01 очной формы обучения / ФГБОУ ВО «Воронежский государственный технический университет»; сост. В.В. Корнеева, А.Н. Корнеева, В.А. Небольсин. 2015. 35 с.
Методические указания содержат теоретические и практические сведения по теме «Растворы и их свойства», образцы решения задач для самостоятельной работы, а также, контрольные задания для проверки усвоения этого материала.
Предназначены для студентов первого и второго курсов.
Методические указания подготовлены в электронном виде в текстовом редакторе MS Word 2003 и содержатся в файле Мет.указ.Растворы.doc.
Библиогр.: 6 назв.
Рецензент канд. хим. наук, доц. В.П. Горшунова
Издается по решению редакционно-издательского совета Воронежского государственного технического университета
© ФГБОУ ВО «Воронежский государственный
технический университет», 2015
Содержание
Теоретическое введение 2
Дисперсные системы 2
Способы выражения концентрации растворов 6
Давление пара растворов 9
Осмотическое давление 11
Образцы решения задач 13
Диссоциация электролитов. Константа диссоциации 16
Ионное произведение воды. Водородный показатель 17
Произведение растворимости 19
Реакции обмена в растворах электролитов. Ионно-молекулярные уравнения реакции 20
Гидролиз солей 21
Варианты контрольных заданий 24
Библиографический список 35
Теоретическое введение
В окружающем нас мире растворы встречаются повсеместно: воздух представляет собой газообразный раствор кислорода, диоксида углерода и других веществ в азоте; морская вода – водный раствор целого ряда веществ (минеральных солей, газов, органических соединений); чугун – твёрдый раствор углерода в железе и т.д. Множество различных растворов содержится в организме человека и животных.
Если мы проанализируем известные нам химические реакции, то обнаружим, что большинство из них протекает в растворах. Поэтому изучение природы растворов важно со всех точек зрения: научной, экономической, экологической и других. Что же такое растворы? Чем определяются их свойства, каковы области применения растворов? На эти и другие вопросы мы постараемся ответить в этой главе. Так как растворы являются частным случаем дисперсных систем, то с них и начнем рассмотрение.
Дисперсные системы
Дисперсными называют такие системы, в которых одно или несколько веществ в виде мелких частиц распределены в другом веществе. При этом распределяемое вещество принято называть дисперсной фазой (понятие «фаза» здесь не строгое), вещество, в котором происходит распределение, – дисперсионной средой.
Дисперсные системы можно классифицировать по степени их дисперсности и устойчивости (табл. 1), а также по типу агрегатного состояния, так как и дисперсная фаза, и дисперсионная среда могут быть газообразными, жидкими или твердыми (табл. 2).
Таблица 1
Дисперсные системы |
Размеры частиц дисперсной фазы |
Устойчивость и гомогенность системы |
Грубодисперсные (суспензии, взвеси) |
10-3 … 10-5 см (10 … 0,1 мкм) |
Неустойчивы, гетерогенны |
Тонкодисперсные (коллоидные растворы) |
10-5 … 10-7 см (0,1 … 0,001 мкм) |
Довольно устойчивы, микрогетерогенны |
Молекулярно-дисперсные(истинные растворы) |
~ 10-8 см |
Весьма устойчивы, гомогенны |
Таблица 2
Дисперсионная среда |
Дисперсная фаза |
Примеры |
Газ |
Газ Жидкость Твердое тело |
Газовые смеси
аэрозоли Пыль, дым |
Жидкость |
Газ Жидкость Твердое тело |
Пена Эмульсии (молоко, кремы, мази) Суспензии, взвеси (глина в воде) |
Твердое тело |
Газ
Жидкость
Твердое тело |
Твердые пены (пенопласты, пемза, пеностекло) Твердые эмульсии (вода в парафине, жемчуг, цеолит) Сплавы, твердые растворы |
Из табл. 1 следует, что для грубодисперсных систем размер частиц дисперсной фазы значительный, что позволяет им сохранять все свойства фазы, поэтому такие системы и рассматриваются как гетерогенные. В истинных растворах степень «дробления» вещества соответствует размерам молекул (ионов), следовательно, исчезает поверхность раздела и система становится гомогенной (однородной). Исходя из этого, раствором можно назвать однородную, гомогенную систему переменного состава, состоящую из двух или более компонентов.
Растворы могут существовать в любом агрегатном состоянии – твердом, жидком или газообразном. Общим признаком для них является однофазность, так что в растворе нельзя различить частицу одного компонента от другого.
Растворы однородны в различных частях объёма. Этим они напоминают химические соединения. Однако, в отличие от химических соединений, состав растворов может быть переменным.
Растворимостью вещества называется его способность образовывать однородную систему с другим веществом, выполняющим функцию растворителя.
Растворение следует рассматривать как совокупность физических и химических явлений, выделяя три основных процесса:
Разрушение химических и межмолекулярных связей в растворяющихся газах, жидкостях или твердых телах, требующих затраты энергии: ΔH1 > 0.
Химическое взаимодействие растворителя с растворяющимся веществом с образованием новых соединений – сольватов (гидратов), т.е. продуктов взаимодействия с растворителем, сопровождающееся выделением энергии, следовательно, ΔH2 < 0.
Самопроизвольное перемешивание раствора или равномерное распределение сольватов (гидратов) в растворителе, связанное с диффузией и требующее затраты энергии и ΔH3 > 0.
Суммарный тепловой эффект процесса растворения ΔH = ΔH1 + ΔH2 + ΔH3 может быть положительным (эндотермическое растворение) и отрицательным (экзотермическое растворение).
Растворение большинства кристаллических тел в воде идет с поглощением энергии ΔH > 0, эндотермический эффект, что связано, как указывалось ранее, с затратой большого количества энергии на разрушение кристаллической решетки твердого тела, которая во многих случаях полностью не компенсируется за счет образования сольватов (гидратов).
При растворении газов и жидкостей энергия затрачивается на разрыв межмолекулярных связей, она невелика и процесс растворения идет с выделением энергии (ΔH < 0, экзотермический процесс), поэтому при повышении температуры растворимость газов уменьшается, а при кипении газ практически полностью удаляется из раствора.
Растворение - процесс обратимый: в зависимости от условий происходит или растворение, или выделение из раствора растворенного вещества. Вследствие обратимости процесса растворения к нему применим принцип Ле Шателье: Если растворение вещества происходит с поглощением теплоты, то повышение температуры должно приводить к увеличению растворимости. Наоборот, если при растворении вещества теплота выделяется, то повышение температуры приведет к уменьшению растворимости.
Под растворимостью вещества понимается его способность образовывать однородную систему с растворителем.
Количественно растворимость вещества определяется его концентрацией в насыщенном растворе.
Предельная растворимость веществ может быть охарактеризована коэффициентом растворимости, который показывает число граммов вещества, растворяющегося в 100 г воды при данной температуре.
Насыщенным раствором называется такой раствор, который находится в равновесии с твердой фазой растворенного вещества и содержит максимально возможное при данных условиях количество этого вещества. В насыщенном растворе в единицу времени одинаковое число молекул переходит в раствор и выделяется из него в твердую фазу.
Раствор, концентрация которого ниже концентрации насыщенного раствора, называется ненасыщенным. В таком растворе можно при тех же условиях растворить дополнительное количество того же самого вещества.

 уманы,
облака
уманы,
облака