
- •Содержание предыдущей лекции
- •Контрольный вопрос
- •Содержание сегодняшней лекции
- •Зона проводимости
- •Зона проводимости
- •Собственные полупроводники
- •Собственные полупроводники
- •Зона проводимости
- •Собственные полупроводники
- •Собственные полупроводники
- •Собственные полупроводники
- •Примесные полупроводники n-типа
- •Примесные полупроводники n-типа
- •Примесные полупроводники n-типа
- •Примесные полупроводники p-типа
- •Примесные полупроводники p-типа
- •Зона
- •Примесные полупроводники
- •Сверхпроводимость
- •Сверхпроводимость
- •Сверхпроводимость
- •Сверхпроводимость
- •Сверхпроводимость
- •Сверхпроводимость
- •Сверхпроводимость
- •Эффекты Джозефсона
- •Эффекты Джозефсона
- •Эффекты Джозефсона
- •Высокотемпературная сверхпроводимость
- •СТРОЕНИЕ ЯДРА
- •Содержание сегодняшней лекции
- •Некоторые свойства ядер
- •Некоторые свойства ядер
- •Некоторые свойства ядер
- •Некоторые свойства ядер
- •Некоторые свойства ядер
- •Некоторые свойства ядер
- •Некоторые свойства ядер
- •Некоторые свойства ядер
- •Некоторые свойства ядер
- •Некоторые свойства ядер
- •Контрольный вопрос
Содержание сегодняшней лекции
Некоторые свойства ядер. Энергия связи ядра. Модели строения ядра.
31
Некоторые свойства ядер
Строение ядер
Все ядра состоят из двух типов частиц: протонов и нейтронов. Атомное (зарядовое) число Z – число протонов в ядре.
Нейтронное число N – число нейтронов в ядре.
Массовое число – число нуклонов (нейтронов и протонов) в ядре.
32
Некоторые свойства ядер
Обозначение ядра
Массовое число
Зарядовое число
AZ X
Химический
символ
элемента
5626 Fe - ядро железа с 26 протонами и 30 нейтронами.56 Fe - “железо-56”.
33
Некоторые свойства ядер
Изотопы
Ядра атомов конкретного химического элемента – одинаковое число протонов, но часто различное число нейтронов.
Изотопы химического элемента - одинаковое Z, но разные N и A.
34
Некоторые свойства ядер
Изотопы
Частоты, с которыми встречаются в Природе четыре изотопа углерода
116 C, 126 C, 136 C и 146 C,
- 0%, ~98.9%, 1.1% и 0%.
116 C и 146 C
- возможность получения только в результате ядерных реакций,
осуществляемых в лабораторных условиях, или обнаружения в космических лучах.
11 H- обыкновенное ядро атома водорода, 12 H - ядро дейтерия, 13 H - ядро трития.
35
Некоторые свойства ядер
Заряд и масса ядра
Протон обладает элементарным положительным зарядом e, равным по величине заряду -e электрона (e = 1,6 × 10-19 Кл).
Нейтрон электрически нейтрален.
Масса протона примерно в 1836 раз больше массы электрона.
Приблизительное равенство масс протона и нейтрона.
Атомная единица массы (а.е.м.) - 1/12 массы одного атома изотопа 12C,
1 а.е.м. = 1.660539 × 10-27 кг.
36
Некоторые свойства ядер
Заряд и масса ядра
Ядро атома 12C - меньшая энергия покоя,
чем у шести протонов и шести нейтронов, взятых по отдельности.
Соответствие меньшей энергии покоя ER = mc2
меньшей массе связанной системы.
Соотнесение избытка массы индивидуальных частиц с энергией связи при формировании ядра атома из этих частиц.
Возможность выражение единицы атомной массы в единицах энергии покоя.
Одна атомная единица массы
ER mc2 1,660539 10 27 кг 2,99792 108 м/с 2 931,494 МэВ,
где 1 эВ 1,602176 10 19 Дж
Возможность представления массы в MэВ/c2.
37

Некоторые свойства ядер
Заряд и масса ядра
Массы некоторых частиц в различных единицах Масса
Частица |
кг |
а.е.м. |
МэВ/с2 |
Протон
Нейтрон
Электрон
атом
ядро
атом
38
Некоторые свойства ядер
Размер и строение ядра
1 mv2 |
ke |
q1q2 |
ke |
2e Ze |
|
r |
d |
||||
2 |
|
|
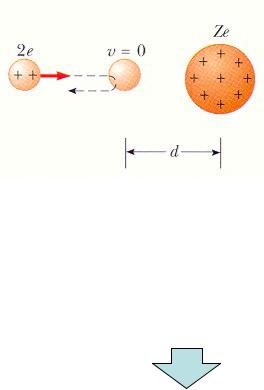
Эксперименты Резерфорда: рассеивание положительно заряженных ядер
атомов гелия ( -частиц)
положительно заряженными ядрами металла.
Зависимость расстояния d,
на которое -частица сближается с ядром,
от кулоновской силы отталкивания.
m- масса -частицы, v - ее исходная скорость,
Z - атомное число ядер атомов мишени.
|
|
|
Ze2 |
Резерфорд: концентрация положительного заряда в атоме |
|
d |
4k |
e |
внутри маленькой сферы, названной ядром, |
||
|
|
чей радиус не превышает примерно 10-14 м = 10 ферми. |
|||
mv2 |
|||||
|
|
||||
39
Некоторые свойства ядер
Размер и строение ядра
Резерфорд: каждое ядро должно содержать A - Z нейтральных частиц - нейтронов.
1932: английский физик Джеймс Чедвик (1891-1974) – открытие нейтрона (Нобелевская премия).
40
