
- •Биохимия – наука о молекулярных основах жизни
- •Направления биохимии
- •Медицинская биохимия
- •Белки
- •Структурная организация белковой молекулы
- •Классификация белков
- •Ферменты
- •Существуют простые и сложные
- •Сложные ферменты – большинство ферментов
- •Коферменты
- •Сходство ферментов и неорганических катализаторов
- •Отличия ферментов от неорганических катализаторов
- •Структура ферментов
- •Активный центр фермента
- •Активный центр фермента
- •Аллостерический центр
- •Изоферменты
- •Мультиферментные комплексы
- •Мультиферментные комплексы
- •Преимущества мультиферментных комплексов:
- •Классификация ферментов
- •I.Оксидоредуктазы
- •II.Трансферазы
- •III.Гидролазы
- •IV. Лиазы
- •V.Изомеразы
- •VI. Лигазы (синтетазы)
- •Шифр фермента имеет 4 цифры:
- •Общие свойства ферментов
- •Специфичность
- •Виды специфичности:
- •Виды специфичности:
- •Ферментативная кинетика
- •Влияние температуры
- •Зависимость активности фермента от температуры
- •Влияние рН
- •Зависимость активности ферментов от рН среды
- •Влияние концентрации фермента на скорость ферментативной реакции.
- •Влияние концентрации субстрата на скорость ферментативной реакции.
- •Кm – константа Михаэлиса
- •Зависимость скорости реакции от присутствия активаторов или ингибиторов
- •Виды активации ферментов
- •Ковалентная модификация ферментов
- •ограниченный протеолиз
- •Ковалентная модификация ферментов
- •Аллостерическое активирование
- •Аллостерическое активирование
- •Активация ионами
- •Роль металлов в ферментативном катализе
- •ИНГИБИТОРЫ
- •Виды ингибирования ферментов
- •Специфическое и неспецифическое ингибирование ферментов
- •Необратимое и обратимое ингибирование ферментов
- •Конкурентное и неконкурентное ингибирование ферментов
- •Конкурентное ингибирование
- •Конкурентное ингибирование
- •Неконкурентное ингибирование
- •Аллостерическое ингибирование
- •Конкурентное и неконкурентное ингибирование ферментов
- •Регуляция ферментативной
- •Принципы определения активности ферментов:
- •Единицы активности ферментов
- •Применение ферментов в медицине
- •Энзимопатология
- •Энзимодиагностика
- •Энзимодиагностика заболеваний
- •Энзимодиагностика заболеваний.
- •Энзимотерапия
- •Энзимотерапия
- •Энзимотерапия
- •Энзимотерапия
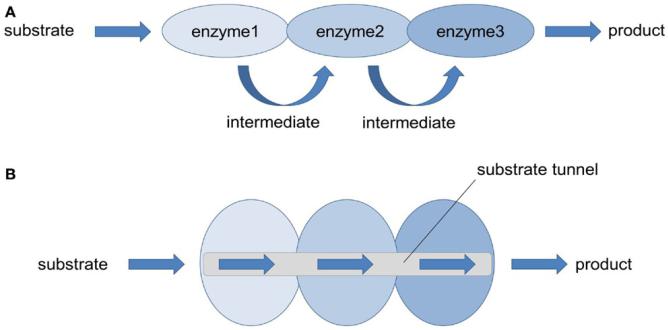
Преимущества мультиферментных комплексов:
•Резко сокращаются расстояния, на которые молекулы промежуточных продуктов должны перемещаться при действии изолированных ферментов;
•увеличивается скорость прохождения необходимых реакций.
Классификация ферментов
•По международной классификации все ферменты делятся на 6 классов в зависимости от типа катализируемой реакции.
•Имеют окончание «-аза»
I.Оксидоредуктазы
•Катализируют окислительно-восстановительные реакции. Перенос водорода, транспорт электронов, окисление молекулярным кислородом, перекисью водорода.
•17 подклассов.
•Дегидрогеназы – перенос водорода,
•Оксигеназы – перенос кислорода к субстрату,
•Пероксидазы – акцептор водорода Н2О2.
II.Трансферазы
•Осуществляют реакции межмолекулярного переноса разных радикалов (отдельных функциональных групп).
•8 подклассов.
• |
метилтрансферразы – |
-СН3, |
• |
аминотрансферазы – |
-NН2, |
• |
транскетолазы – кетонные группы |
|
III.Гидролазы
•Реакции гидролитического расщепления внутримолекулярных (ковалентных) связей при участии воды.
•11 подклассов.
•Пептидазы – гидролиз пептидных связей в белках
•Гликозидазы – гидролиз гликозидных связей в полисахарах, олигосахарах
•Эстеразы – гидролизуют сложноэфирные связи
IV. Лиазы
•Реакции негидролитического разрыва связей (С-С, С-N, С-О, С-S) с образованием двойной связи или реакции присоединения групп по месту двойной связи.
•7 подклассов.
•Альдолазы – расщепление или образование связей С-С
•Гидратазы – отщепление Н2О от субстрата
V.Изомеразы
•Реакции внутримолекулярного переноса различных групп.
•6 подклассов.
•Рацемазы – превращение L-изомеров в D-изомеры,
•Мутазы – перемещение группировок с одной части молекулы на другую,
VI. Лигазы (синтетазы)
•Реакции соединения двух молекул (реакции синтеза), сопряженных с расщеплением макроэргических связей АТФ, ГТФ.
•5 подклассов (ферменты анаболических стадий обмена веществ).
Шифр фермента имеет 4 цифры:
1.Класс фермента,
2.Подкласс,
3.Подподкласс,
4.Порядковый номер в подподклассе
•ЛДГ (К.Ф. 1.1.1.27)
•2 и 3 цифры уточняют тип субстратов, переносимых группировок, тип связи и другие детали

Общие свойства ферментов
как катализаторов белковой природы
•Специфичность
•Оптимум температуры (термолабильность)
•Оптимум рН
