
- •ХИМИЧЕСКАЯ
- •Теоретические основы химической технологии
- •Теоретические основы химической технологии
- •Теоретические основы химической технологии
- •Теоретические основы химической технологии
- •Теоретические основы химической технологии
- •Теоретические основы химической технологии
- •Теоретические основы химической технологии
- •Теоретические основы химической технологии
- •Теоретические основы химической технологии
- •Теоретические основы химической технологии
- •Теоретические основы химической технологии
- •Теоретические основы химической технологии

ХИМИЧЕСКАЯ
ТЕХНОЛОГИЯ
Лекция №9

Теоретические основы химической технологии
Энергия в химическом производстве. Тепловой эффект реакции в технологических расчетах. Направленность реакции в технологических расчетах
Изменение химического состава реагирующей смеси приводит к изменению ее теплосодержания ∆ НТ которое можно рассчитать через энтальпии образования
компонентов (∆ НТ )обр: ∆ НТ = Σvi(∆ НТ )обр.i
Если энтальпия образования продуктов меньше, чем энтальпия образования исходных веществ, (∆ НТ < 0), то выделяется теплота Qр = -∆ НТ, называемая теплотой реакции. Если
при химическом превращении теплосодержание смеси увеличивается (∆НТ > 0), то
происходит поглощение теплоты.
В зависимости от знака ∆ Н (или Qр) реакции бывают экзотермические (∆ Н< 0, Qр > 0) и эндотермические (∆ Н >0, Qр < 0). Тепловой эффект реакции входит в запись
термохимического уравнения, представляющего собой стехиометрическое уравнение с указа нием его теплового результата
VАА + vВВ + … = vRR + vSS + … + Qр.
Значение Qр в уравнении зависит от записи химического уравнения. Например, тепловой эффект реакции, записанной следующим образом: N2 + 3Н2 = 2NН3 в два раза больше, нежели для той же реакции, записанной по-другому: 0,5N2 + 1,5Н2 = NН3, поэтому в справочной литературе Qр приводят прямо в уравнениях, как это сделано в, или указывают изменение энтальпии, соответствующее превращению 1 моля вещества.
2

Теоретические основы химической технологии
Тепловой эффект реакции в технологических расчетах
Знание теплового эффекта реакции необходимо для определения тепловых явлений в технологических процессах. Количество выделившейся (или поглощенной) теплоты qр
зависит от количества превращенного вещества ∆N:
qр = Qр ∆NА/vА
В зависимости от знака Qр (экзо- или эндотермическая реакция), теплота в ходе протекания процесса будет выделяться или поглощаться.
Возможность химического превращения
Химический процесс принципиально осуществим, если реакция протекает с уменьшением химического потенциала, называемого также изобарным потенциалом, или энергией Гиббса, т.е. возможность протекания реакции определяется из следующих условий:
•при ∆GТ,Р < 0 протекание реакции возможно;
•при ∆GТ,Р < 0 протекание реакции невозможно;
•при ∆GТ,Р = 0 реакционная система находится в термодинамическом равновесии,
где ∆GТ,Р - изменение энергии Гиббса при превращении исходных веществ в продукты при температуре Т и давлении Р.
Изменение энергии Гиббса реакции можно рассчитать по уравнению:
G298o i ( G2980 )îáð .i i
3

Теоретические основы химической технологии
Тепловой эффект реакции в технологических расчетах
Значения стандартной энергии Гиббса образования веществ при стандартных температуре 298 К и давлении Р = 1 атм приведены в справочной литературе по термодинамике и означают изменение энергии Гиббса при превращении такого количества вещества, находящегося в стандартном состоянии, которое записано в стехиометрическом уравнении.
Для расчета в условиях, отличающихся от стандартных, используют зависимость энергии Гиббса от температуры: GT0 HT0 T S
где HT0 ,S изменение энтальпии и энтропии при стандартном давлении, которые можно рассчитать по формулам, аналогичным. Зависимость энергии Гиббса от состава реакционной смеси отражает уравнение Вант-Гоффа:
GP,T GT0 RT ln Civi,
где R — универсальная газовая постоянная, равная 8,314iДж/моль∙К;
П - знак произведения; Сi- концентрации компонентов; vi - стехиометрические коэффициенты уравнения реакции в алгебраической форме.
4
Теоретические основы химической технологии
Направленность реакции в технологических расчетах
Использование условий позволяет определить возможность получения желаемого продукта — с этого начинают разработку нового способа производства. Другой вариант применения заключается в поиске возможностей, предотвращающих протекание нежелательных реакций.
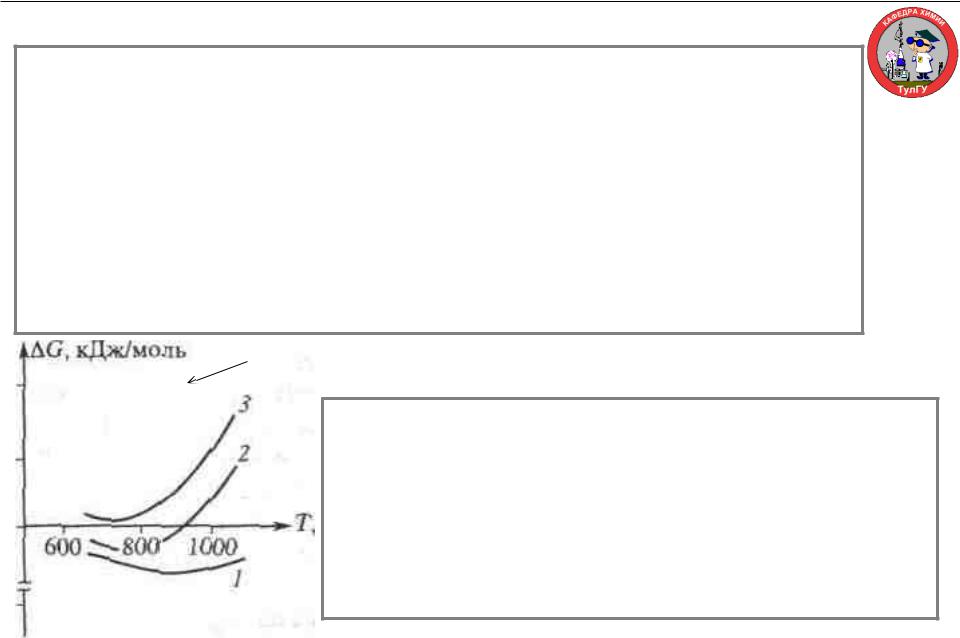
Продемонстрируем это на следующем примере. При конверсии метана водяным паром возможно образование сажи. Одна из вероятных реакций: СО + Н2 = С + Н2О
Из справочных данных и формул для этой реакции полученоGT0 = 132 + 0,133/Т (кДж/моль).
Конверсия метана в промышленном реакторе протекает вблизи равновесия. Соответствующее содержание СО, Н2 и Н2О, ответственных за образование сажи (углерода), для исходной смеси с
стехиометрическим соотношением пар:
метан = 2:1 при температуре 873 К и давлении 0,1 МПа следующее:
ССО = 0,071, СН2 = 0,53, СН2О = 0,24.
Зависимость энергии Гиббса ∆G от температуры Т для реакции образования углерода в реакторе конверсии метана при начальном соотношении пар : газ = 1:1 (1); 2:1 (2); 4:1 (3)
Такие данные можно получить и для других температур и соотношения исходного состава. Далее для этих температур и составов смеси по формуле (3.32) рассчитывают ∆GР,Т по реакции. Результаты
представлены на рис. При исходном соотношении пар : газ = 1 : 1 во всем температурном интервале ∆GР,Т < 0, и потому возможно выделение
сажи. При соотношении пар : газ = 2:1 при температурах ниже 900 К, т.е. в какой-то части реактора, также возможно сажеобразование. И только при четырехкратном избытке водяного пара выделение сажи становится
невозможным (∆GР,Т > 0 во всем интервале температур).
5

Теоретические основы химической технологии
Массообменные процессы. Основные принципы массообменных процессов. Моделирование процессов теплообмена
Для математического описания того или иного массообменного процесса предложены несколько теоретических моделей. Общепринятыми считаются две теории:
1.Двухпленочная модель Льюиса и Уитмена;
2.Теория граничного диффузионного слоя Ландау и Девиса.
Эти теории имеют много общего. В соответствии с ними процесс переноса вещества из одной фазы в другую можно представить происходящим в три последовательные стадии.
Пусть вещество переходит из фазы Фу в фазу Фх (например, аммиак из воздуха в воду). Движение фаз
турбулентное. Между фазами существует поверхность раздела фаз (ПРФ), которая обусловлена тормозящим действием сил трения, возникающих при движении фаз относительно друг друга и действием сил поверхностного натяжения, имеющих место на поверхности жидкой фазы.
С0у |
С*у |
|
|
||
Фаза Фу |
Фаза Фх |
|
|
||
С*х |
С0х |
|
Ядро фазы Фу |
|
|
Ядро фазы Фх |
||
|
||
|
Пограничный диффузионный слой |
|
|
(пленка) |
Схема распределения концентраций в фазах в процессе массообмена
Турбулентный поток каждой фазы имеет следующую структуру: ядро потока (основная масса фазы) и пограничный диффузионный слой у границы фазы (пограничная пленка). В ядре потока вследствие интенсивного перемешивания концентрация вещества постоянная. Здесь преобладает конвективная (турбулентная) диффузия. В пограничном слое движение потока замедляется, так как турбулентный поток заменяется ламинарным.
6

Теоретические основы химической технологии
Массообменные процессы. Основные принципы массообменных процессов. Моделирование процессов теплообмена
Конвективная диффузия уступает место молекулярной диффузии. Вследствие этого в пограничном слое происходит резкое изменение концентрации от С0у до Су* и от Сх* до С0х. Перенос вещества
замедляется. Вот почему у границы раздела наблюдается почти линейное изменение концентрации вещества.
Согласно названных выше моделей процесс массопередачи представляет сумму процессов массоотдачи из основной массы фазы Фу к поверхности раздела фаз и процесса массоотдачи от поверхности раздела к основной
массе фазы Фх.
В итоге в основе пленочной и других теорий массообмена предложены следующие допущения:
•Общее диффузионное сопротивление переносу из фазы в фазу складывается из диффузионного сопротивления двух фаз и сопротивления поверхности раздела фаз. Причем сопротивление на поверхности раздела фаз принимается равным нулю. Таким образом, общее сопротивление переносу массы можно рассматривать как сумму фазовых сопротивлений.
•На поверхности раздела фазы находятся в равновесии.
Предложены и другие модели механизма массопереноса. Но вследствие большой сложности турбулентных двухфазных потоков практически невозможно определение с концентраций (угр, хгр, у*, x*) в фазах, поверхности
контакта и т.д.
Молекулярная диффузия обусловлена беспорядочным перемещением молекул вещества в неподвижной среде. Конвективная диффузия имеет место в движущейся среде и осуществляется движущимися частицами носителя или распределяемого вещества.
При турбулентном движении перенос происходит главным образом путем турбулентной диффузии, а роль |
|
молекулярной диффузии незначительна, за исключением области вблизи поверхности раздела фаз. |
7 |

Теоретические основы химической технологии
Молекулярная диффузия. Первый закон Фика
Молекулярная диффузия описывается первым законом Фика: |
|
Размерность [D]: |
|
|
|
|
|
|||||
dM D dF d dc |
|
|
|
|
|
|
||||||
|
|
M dn |
|
кг м м3 |
|
м2 |
||||||
dn |
[D] |
|
|
|
с м |
2 |
|
|
|
|
|
|
|
|
|
||||||||||
Количество вещества dM, продиффундировавшего за время d через |
|
|
F dc |
|
|
кг |
|
с |
||||
элементарную поверхность dF (нормальную к направлению диффузии) |
|
Физический смысл D можно |
|
|
||||||||
пропорционально градиенту концентрации dc/dn этого вещества. |
|
|
|
|||||||||
|
выяснить из предыдущего выражения. |
|||||||||||
Или через всю поверхность F диффундирует количество вещества: |
|
|||||||||||
|
Коэффициент диффузии показывает, |
|||||||||||
dc |
|
|||||||||||
|
какое количество вещества |
|
|
|||||||||
М D F |
|
диффундирует в единицу времени |
||||||||||
dn |
|
через единицу поверхности при |
||||||||||
dc - градиент концентрации характеризует изменение концентрации |
|
|||||||||||
|
градиенте концентрации, равном |
|||||||||||
dn диффундирующего вещества на единицу длины нормали между |
|
|
|
единице. |
|
|
|
|
|
|||
двумя поверхностями постоянных концентраций; D – коэффициент |
|
Коэффициент диффузии D - |
|
|
||||||||
пропорциональности, который называют коэффициентом |
|
|
|
|||||||||
|
физическая константа, которая |
|||||||||||
молекулярной диффузии. Знак (-) перед D указывает на то, что |
|
|||||||||||
|
характеризует способность данного |
|||||||||||
молекулярная диффузия всегда протекает в направлении |
|
|||||||||||
|
|
вещества проникать в |
|
|
|
|
||||||
уменьшения концентрации распределяемого компонента. |
|
|
|
|
|
|
||||||
|
неподвижную среду. Величина D не |
|||||||||||
|
|
|||||||||||
|
|
зависит от гидродинамических |
||||||||||
|
|
|||||||||||
Коэффициент D есть функция свойств распределяемого вещества, свойств |
условий, в которых протекает |
|
|
|||||||||
|
|
процесс. |
|
|
|
|
|
|
||||
среды, через которую оно диффундирует, температуры, t, и давления, р. |
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
Например, коэффициент D для газов возрастает c увеличением |
|
|
|
|
|
|
|
|
|
|
|
|
температуры и понижением давления. |
|
|
|
|
|
|
|
|
8 |
|
|
|

Теоретические основы химической технологии
Турбулентная диффузия
Количество вещества dMТ, которое переносится в пределах фазы турбулентной диффузией, может быть рассчитано по уравнению: dMТ D dF d dndc
Или для всей поверхности (F = dF) MТ D F dndc
Коэффициент турбулентной диффузии , D, показывает, какое количество вещества передается
посредством турбулентной диффузии в единицу времени через единицу поверхности при градиенте концентраций, равном единице.
Коэффициент D не является физической константой, он зависит от гидродинамических условий (скорости потока и масштаба турбулентности).
Уравнение массоотдачи
В связи с большой сложностью процессов массопереноса при расчетах принимают, что количество вещества, перенесенного от границы раздела фаз в другую фазу, пропорционально движущей силе, которая равна разности концентраций в ядре и на границе фазы, поверхности контакта фаз и времени.
Тогда если массоперенос происходит из фазы Фу в фазу Фх, то количество вещества М, переносимого в единицу времени в каждой из фаз (к границе раздела фаз и в обратном направлении), может быть посчитано по основному уравнению массоотдачи:
для фазы Фу: М у F y yгр
для фазы Фх : М х F хгр х 9

Теоретические основы химической технологии
Уравнение массоотдачи
у |
М |
х |
М |
|
|
|
|||
F (y yгр ) |
F (хгр. х ) |
|||
|
|
Если принять F = 1м2; = 1с; у-угр. = 1 (или хгр. – х = 1), то физическую сущность коэффициентов массоотдачи
выразим следующим образом: они показывают, какое количество вещества переходит от поверхности раздела фаз в ядро фазы (или в обратном направлении) через единицу поверхности в единицу времени при движущей силе, равной 1.
Коэффициенты массоотдачи не являются физической константой. Это кинетическая характеристика. Они зависят от следующих факторов:
1.физико-химических свойств фазы ( , и других):
2.гидродинамических условий в ней (ламинарный или турбулентный режимы движения жидкости);
3.геометрических факторов, в том числе конструкция и размеры аппарата.
Коэффициент массоотдачи учитывает перенос вещества как конвективной, так и молекулярной диффузией. Размерность коэффициента массоотдачи находим:
|
М |
|
|
|
|
кг |
|
|
|
|
2 |
|
|
||
|
|
|
м |
|
|||
|
F ед. движ.силы |
|
|
с (ед.движ.силы) |
|||
Коэффициент массоотдачи определяется при помощи теории подобия.
10
