
- •ХИМИЧЕСКАЯ
- •Электрохимические производства. Теоретические основы электролиза водных растворов и расплавленных сред. Технология электролиза раствора
- •Электрохимические методы все более широко внедряются в технику очистки сточных вод, в частности
- •Электролиз раствора хлорида натрия
- •Электролиз раствора NaCl с твердым катодом и фильтрующей диафрагмой
- •Побочные реакции снижают выход по току основных продуктов и повышают расходные коэффициенты по
- •Электролиз раствора хлорида натрия с ртутным катодом
- •Схема электролизера с ртутным катодом

ХИМИЧЕСКАЯ
ТЕХНОЛОГИЯ
Лекция №10

Электрохимические производства. Теоретические основы электролиза водных растворов и расплавленных сред. Технология электролиза раствора хлорида натрия.
Основные направления применения электрохимических производств
При электролизе водных растворов и расплавленных сред могут быть получены химические продукты: водород, хлор, гидроксиды натрия и калия. Методом электролиза водных растворов осуществляют энергохимический синтез многих неорганических и органических веществ – гипохлоритов, хлоратов, перхлоратов, хлорной кислоты, перманганатов, диоксида марганца, а также адипонитрила, антидетонаторов. На электролизе водных растворов основаны гидроэлектрометаллургия и гальванотехника. Гидроэлектрометалургия –извлечение металлов из водных растворов их солей путем электролиза.
Важнейшая область электрохимии –
получение и эксплуатация химических источников тока. Химические источники тока подразделяются на первичные и вторичные.
Первичные:источникиэнергии,которые могутбытьиспользованылишьооднократно: батареииигальваническиеэлементыенты..
Вторичные:е: аккумуляторы,улятор , работоспособность которыхх восстанавливаетсяпропусканием электрическоготока..
2

Электрохимические методы все более широко внедряются в технику очистки сточных вод, в частности для опреснения сильно минерализированных вод электролизом с регенерацией индивидуальных солей, кислот и щелочей.
Преимущества электрохимических методов
•В электрохимических процессах аппаратура во многих случаях проще и компактнее по сравнению с альтернативными химическими процессами;
•Электрохимические методы получения ряда продуктов характеризуются меньшим числом производственных стадий и операций, более дешевым сырьем и большей глубиной его превращения, одновременным образованием (причем в раздельном виде) ценных продуктов.
Эти преимущества часто обусловливают более низкую себестоимость получаемой продукции.
Одно из главныха достоинствств электрохимическихе т ес методов – чистотата получаемых продуктов..
Основной недостаток электрохимическихе т ес процессов – высокая энергоемкость,е г е сть, поэтому энергетическиее гет ес е затратыаты составляютста я т главнуюа статью себестоимостиест сти продуктов..
Поэтому для электрохимическихе т ес производств особенное важно снижениее е энергопотребленияе г т е е я путем совершенствованияе е ст а я технологии,г , аа также рационального,а ь г , экономичногого использованияа я электроэнергиит э е г ..
3

Электролиз раствора хлорида натрия
Электролиз раствора NaCl – наиболее простой и экономичный метод одновременного получения трех важнейших химических продуктов – хлора, водорода и гидроксида натрия с использованием дешевого и доступного природного сырья. Это самое крупномасштабное электрохимическое производство.
Хлор применяют как сырье для производства хлорорганических растворителей и пластмасс, синтетических каучуков, химических волокон, ядохимикатов. В металлургии : для хлорирующего обжига руд, в текстильной и целлюлозно- бумажной промышленности – для очистки и отбеливания целлюлозы, бумажной массы и тканей. Большие количества хлора идут на очистку и стерилизацию сточных вод и питьевой воды.
2 NaCl + 2 H2O |
|
2 H2 + 2 NaOH + Cl2 |
|
Гидроксид натрия используется в производстве многих химических продуктов, прежде всего в промышленном органическом синтезе, в целлюлозно-бумажном производстве, в производстве искусственных волокон, в металлургии (производство алюминия), в нефтехимической промышленности и др.
Электролиз раствора NaCl осуществляется двумя методами:
•электролиз с твердым катодом и фильтрующей диафрагмой;
•электролиз без диафрагмы с жидким ртутным катодом.
Благодаря чистоте получаемых продуктов, компактному аппаратурному оформлению, а также одностадийности процесс электролиза раствора NaCl является единственным в мире способом
производства хлора и основным способом получения гидроксида натрия.
4

Электролиз раствора NaCl с твердым катодом и фильтрующей диафрагмой
При реализации этого процесса на катоде в соответствии с значениями электродных потенциалов протекают следующие процессы:
K : 2 |
H 2 O + |
2 e - |
|
2 O H - + 2 H (ад c) (1) |
|
|
|||||
2 |
H (ад c) |
|
|
H 2 |
(2) |
|
|
||||
Материалами для катода служит сталь, на которой водород выделяется с относительно невысоким перенапряжением (0,3 В). В реальных условиях электролиза (концентрированный раствор NaCl, содержащий NaOH, температура 90 С) фактический потенциал выделения водорода составляет около – 0,845 В. Снижение потенциала до 0,3 – 0,4 В можно достичь применением пористых графитовых катодов, для упрочнения и гидрофобизации пропитанных политетрафторэтиленом и активированных солями меди или серебра.
Вобъеме электролита анодного пространства в результате гидролиза хлора идут побочные химические реакции:
Cl2 |
+ |
H2O |
|
|
|
HOCl |
+ |
HCl |
(6) |
|
|
|
|
||||||||
|
|
|
||||||||
Cl2 |
+ |
OH - |
|
|
HOCl |
+ |
Cl - |
(7) |
||
|
|
|||||||||
|
|
|||||||||
HOCl |
|
+ OH - |
|
|
|
OCl |
+ |
H2O |
(8) |
|
|
|
|
|
|||||||
Накапливающиеся в катодном пространстве гидроксид-ионы образуют нейтральные молекулы гидроксида натрия:
OH - + |
Na + |
|
|
NaOH (3) |
|
|
|
||||
|
На аноде выделяется хлор: |
||||
A: 2 Cl - |
- 2 e- |
|
|
Cl2 (4) |
|
|
|
||||
Материалом анода служит оксидно-рутениевая система, обладающая прочностью и химической инертность по отношению к кислороду являющемуся побочным продуктом, образующемся на аноде:
A: 4 OH - - 4 e- |
|
O |
2 |
+ 2 H O (5) |
|
||||
|
|
|
2 |
Образующийся в результате этой последовательной реакции гипохлорит анион претерпевает анодное окисление
A: 6 OCl - + 3 H O - 6 e- |
|
2 OCl3- + 4 Cl - + 3 O2 + 6 H + (9) |
|
||
2 |
|
|
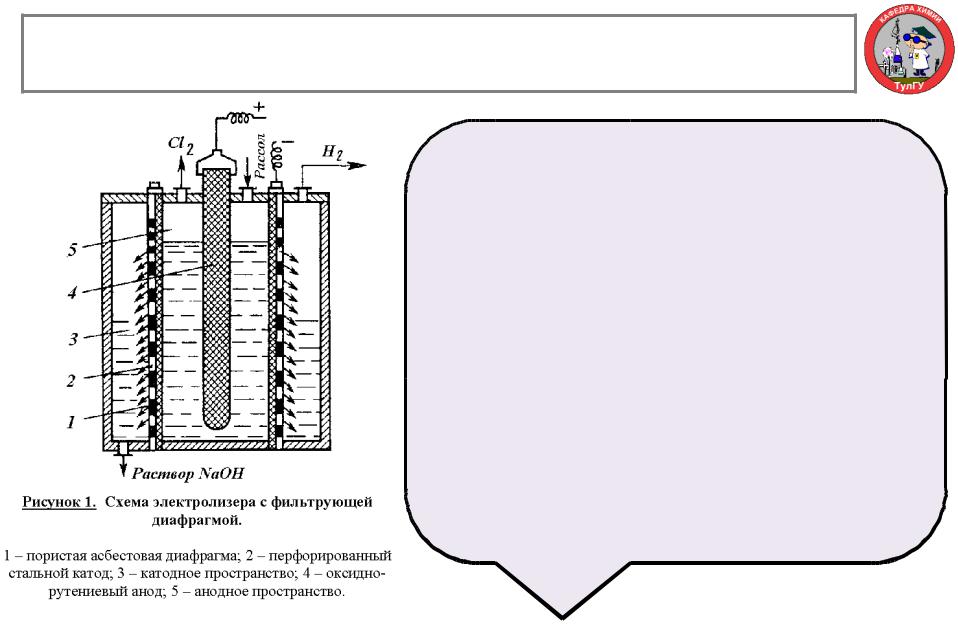
Побочные реакции снижают выход по току основных продуктов и повышают расходные коэффициенты по энергии. Электролиз реализуют в электролизерах непрерывного действия с вертикальными фильтрующими диафрагмами при противотоке движения электролита и OH –ионов.
Корпус ванны разделен на катодное и анодное пространства пористой диафрагмой из асбеста. Диафрагма плотно прилегает к перфорированному стеклянному катоду. В анодном пространстве расположен оксидно-рутениевый анод. Очищенный рассол подают в анодное пространство и вследствие гидростатического давления он фильтруется через диафрагму и катод в катодное пространство. Из катодного пространства непрерывно отводят водород и раствор гидроксида натрия, а из анодного – хлор. В образующемся хлор-газе содержится 95 – 96% Cl2. Хлор-газ охлаждают до
20 С (при этом конденсируется вода) и дополнительно сушат промывкой концентрированной серной кислотой. Катодный продукт – раствор гидроксида натрия содержит 120 – 140 г/л NaOH и 170 – 180 г/л неразложившегося NaCl. Раствор выпаривают, при этом NaCl переходит в твердую фазу, т.к. его растворимость резко снижается с увеличением концентрации NaOH. После выпарки и плавки щелоков получают безводны гидроксид натрия, содержащий 92 – 95% NaOH и 2 – 4% NaCl.
Благодаря противотоку электролита и ионов OH -, последние практически не попадают в анодное пространство и побочные реакции (5), (7) – (9), за которые они ответственны, предельно минимизированы.
6
Электролиз раствора хлорида натрия с ртутным катодом
На ртутном катоде электродные реакции идут с большим перенапряжением – потенциал разряда составляет 1,7 – 1,8 В. Натрий выделяется на ртутном катоде с большим эффектом деполяризации и потенциал разряда Na + на ртути много ниже стандартного и равен 1,23 В. На перфорированном графитовом (или оксидно- рутениевом) аноде выделяется хлор.
K: |
Na + + n Hg |
+ e- |
|
|
|
NaHg n |
|
|
|||||
A: |
2 Cl - - |
2 e- |
|
|
|
Cl2 |
|
|
|
Амальгаму натрия, содержащую 0,1 – 0,3% Na,
выводят из электролизера и разлагают нагретой
водой в отдельном реакторе-разлагателе. В
разлагателе идет электрохимическая реакция,
соответствующая процессу в короткозамкнутом
гальваническом элементе NaHg n [NaOH] С в котором амальгама служит катодом.
Na + H O + 2 e- |
|
Na + + OH- + 1/2 H2 |
|
||
2 |
|
|
Na + + OH-  NaOH
NaOH
7
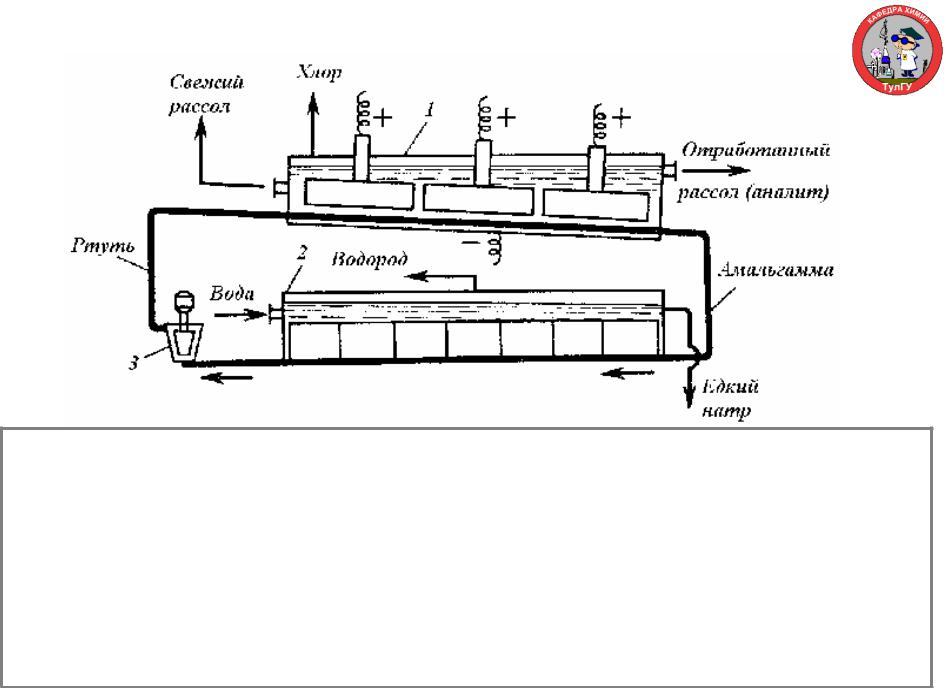
Схема электролизера с ртутным катодом
1-электролизер; 2-разлагатель; 3-насос.
Глубоко очищенный концентрированный раствор NaCl подают в наклонный удлиненный электролизер, по дну которого самотеком, противотоком рассолу, движется ртуть, служащая катодом. Над ртутью расположен горизонтальный оксидно-рутениевый анод, погруженный в рассол. Анодная жидкость, содержащая непрореагировавший NaCl, выводится из электролизера совместно с хлор-газом, от которого отделяется в сепараторах и продувочных колоннах. Хлор подают на осушку, а обесхлоренный рассол после очистки от ртути и примесей насыщается каменной солью и возвращается в электролизер. Амальгама натрия из электролизера перетекает в наклонный реактор-разлагатель, где движется противотоком дистиллированной воде, подаваемой в количестве, обеспечивающем получение 45%-ого раствора NaOH. На дне разлагателя размещены гребенчатые графитовые плиты, образующие с амальгамой короткозамкнутый гальванический элемент NaHg n
[NaOH] С. Отводимый гидроксид натрия отделяют в сепараторах от водорода и передают потребителям. Ртуть, вытекающую из разлагателя, ртутным насосом перекачивают в электролизер.
8
