
- •ХИМИЧЕСКАЯ
- •Производство серной кислоты
- •Для контактного способа требуется дополнительная очистка (96/98 Н2SO4)
- •Стадия 3
- •Технология контактного окисления SO2
- •Важнейшаяней ая задачапроизводствасернойкислоты––увеличениестепенипревращенияения диоксидасерыиисниженияения его ввыбросоввватмосферуос еру...Одинизнаиболеерациональныхметодоврешенияения этойзадачи––методдвойного контактированияиидвойнойабсорбции((ДКДА)::реакционнуюссмесь, ввкоторойстепеньпревращенияSO22
- •Нитрозный способ (башенный) производства серной кислоты
- •Производство серной кислоты по методу «мокрого катализа»
- •Схемы предусматривают генерирование водяного пара (4 Мпа) за счет тепла газов обжига, который

ХИМИЧЕСКАЯ
ТЕХНОЛОГИЯ
Лекция №5

Производство серной кислоты
Стадия 2
Схема очистки и дополнительной очистки обжигового газа:
Очистка включает в себя в основном избавление от пыли. Применяют циклон-аппараты:
|
Очищенный |
Обжиговый газ с высокой скоростью входит в первую трубу |
|
|
обжиговый |
циклон-аппарата, выходит через ее наибольшее сечение с |
|
|
большой скоростью и закручивается вокруг вертикальной |
||
Обжиговый газ |
газ |
||
трубы. Центробежная сила отбрасывает пылинки к |
|||
|
|||
|
|
стенкам, которые ссыпаются в его нижнюю часть и |
|
|
|
утилизируются с огарком. Очищенный обжиговый газ |
|
|
|
уходит сверху циклон-аппарата. |
М = 1000 В
Газ
Пыль
Далее обжиговый газ попадает в электрофильтры, в центре которых находится коронный электрофильтр, на который
попадает высокое напряжение (1000 В). Молекулы воздуха ионизируются, притягиваются к частичкам пыли, укрупняя их. При снятии напряжения они ссыпаются в нижнюю часть
электрофильтра, а очищенный газ выходит в верх. Пыль теперь:2-7г/м3. Газ может идти на нитрозные способ.
Пыль 2
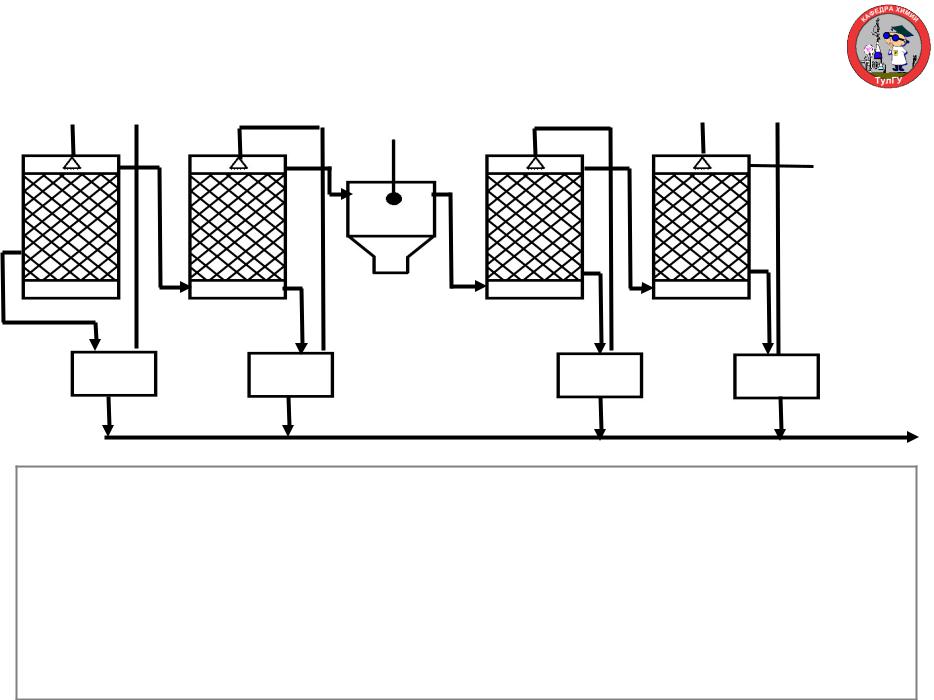
Для контактного способа требуется дополнительная очистка (96/98 Н2SO4)
70% H2SO4 |
30% H2SO4 |
5% H2SO4 |
96-98% H2SO4 |
Очищенный  обжиговый газ
обжиговый газ
ЭФ
Обжиговый газ поступает в первую поглотительную колонну, орошаемую 70% серной кислотой. Колонна изнутри выложена огнеупорным кирпичом. Затем, выйдя из первой, газ входит во вторую орошаемую 30% серной кислотой. Эта колонна внутри выложена свинцовыми пластинами. Для увеличения поверхности контакта все или некоторые колонны этой схемы содержат насадку колец Раминга. Поглощаются оксиды железа, огарки, остаток и пыль поступают в электрофильтр ЭФ, где очищаются от тумана, влаги и частично унесенных твердых частиц («мокрый ЭФ»). Следующая колонна – увлажнительная. Окончательно очищает. Затем опять в «мокрый ЭФ» и в 4 колонну. Здесь обжиговый газ очищается от паров влаги и может направляться в стадию 3. Внизу стекает отработанная кислота. Здесь ее концентрируют, очищают от примесей и возвращают в производство. Шлам, содержащий селен, теллур, отправляют в
производство. |
3 |

Стадия 3
|
|
Контактное окисление SO2 → SO3 |
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
Реакция |
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
2 SO2 |
+ O2 |
|
|
|
2 SO3 |
+ |
94,2 кДж |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
является обратимой и экзотермической и протекает с уменьшением объема. Она осуществляется на |
|
|
|
||||||||||||||||
катализаторах, основой которых является V2O5 с добавлением оксидов щелочных металлов, нанесенных на |
|
|
|||||||||||||||||
|
|
|
оксид кремния. |
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
Обоснование роли параметров и их выбор |
|
|
|
|
|
|
|
|
|
|||||||||
Температура |
проходит |
максимум |
производительности, |
|
Катализаторы |
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
||||||||||
характерный для обратимых экзотермических реакций. Следует |
|
1. Пентооксид ванадия V2O5, модифицированный оксидами |
|||||||||||||||||
иметь в виду, что чрезмерное увеличение температуры может |
|
щелочных металлов, нанесенных на оксид кремния |
|||||||||||||||||
привести к диффузионному торможению процесса и это может |
|
(старый). |
|
|
|
|
|
|
|
|
|
|
|||||||
повлиять на положение экстремума производительности и его |
|
2. Сульфованадат атрия, нанесенный на диатомит (СВД – |
|||||||||||||||||
величину. |
|
|
|
|
|
|
новый.) |
|
|
|
|
|
|
|
|
|
|
|
|
В значительной степени выбор температуры определяется |
|
3. Бария алюмованадат – новый. |
|
|
|
|
|
|
|
||||||||||
верхним и нижним пределом этого параметра. При Т<400 0C |
|
Катализатор не активен до температуры 400 0С. Выше 600 0С |
|||||||||||||||||
активность катализаторов весьма мала, а выше 600 0С происходит их |
|
просиходит |
термическая |
дезактивация |
катализатора. |
||||||||||||||
термическая дезактивация. Оптимальными являются температуры, |
|
Оптимальные температуры работы катализатора 4000С – 600 0С |
|||||||||||||||||
лежащие внутри этих пределов. |
|
|
|
|
|
Соотношение O2:SO2. является фактором смещения |
|||||||||||||
Давление является фактором скорости процесса и фактором |
|
||||||||||||||||||
|
равновесия, а также фактором скорости процесса в |
||||||||||||||||||
смещения равновесия, однако на практике исходя из соображений |
|
соответствии с уравнением Борескова: |
|
CSO |
CSO , P |
0,8 |
CSO2 |
||||||||||||
экономии энергозатрат, а также |
благодаря возможности достичь |
|
Однако сверху это соотношение |
|
r |
k |
2 |
2 |
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
высокой производите и степени превращения за счет использования |
|
ограничивается замедлением роста |
|
|
|
CSO2 |
|
|
|
||||||||||
|
|
|
|
|
|
|
|
||||||||||||
других факторов предпочитают работать при давлениях, близких к |
|
скорости |
при |
высоких |
С0 |
и |
значительным снижением |
||||||||||||
атмосферному. Некоторое избыточное давление необходимо для |
|
содержания SO2 в контактных газах, поступающих на |
|||||||||||||||||
преодоления гидравлических сопротивлений установки при |
|
абсорбцию, |
что |
снижает |
эффективность последней. |
На |
|||||||||||||
организации транспортных потоков реагентов. |
|
|
|
|
практике используют избыток О2 более чем полтора по |
||||||||||||||
|
|
|
|
|
|
|
|||||||||||||
Время контакта выбирается, исходя из максимально достижимой |
|
отношению к стехиометрическому. |
|
|
|
|
|
|
|
||||||||||
конверсии. Пределом такой конверсии является максимальная степень превращения, при которой скорость процесса близка к нулю. |
|
|
|||||||||||||||||
Поэтому за время реакции выбирается то минимальное время, при котором степень конверсии практически близка равновесной. |
|
|
|
||||||||||||||||
Обычно эта величина равна 90-95 %, а соответствующее ей время – несколько секунд. |
|
|
|
|
|
|
4 |
|
|
||||||||||

Технология контактного окисления SO2
Полочный контактный аппарат:
Контактный газ
 Kt
Kt
Решетка |
Кварц |
|
Обжиговый газ
Обжиговый газ поступает в нижнюю часть. Кварц – для равномерного распределения потока. Газ последовательно проходит полки со слоями катализатора, где потом идет окисление SO2 →
SO3 и одновременно разогревается от 300 0С внизу до 800 0С – 900 0С вверху за счет экзотермичности. Степень окисления SO2 → SO3 в полочном аппарате достигает 90%. Для доокисления SO2 → SO3
используется второй контактные аппарат, включенный в схему. Недостаток – невозможность терморегуляции. Схема с двумя контактными аппаратами позволяет частично минимизировать недостаток полочного аппарат.
ОГ
Подогреватель |
1-й |
2-й |
~300о |
теплообменники |
|
Контакт. газ
Змеевик
Кварц
~430о |
КГ |
|
|
|
|
Kt |
|
|
|
|
Кварц |
II |
I |
~590о |
300о |
Спираль |
Г |
||||
|
|
|
|
|
|
|
|
|
Кварц |
|
|
ОГ |
|
Решетка |
|
|
|
Полочный контактный |
|
|
|
|
аппарат с двойными |
|
|
|
Kt |
теплообменными |
|
|
|
трубками |
5 |
|
|
|
|

Важнейшаяней ая задачапроизводствасернойкислоты––увеличениестепенипревращенияения диоксидасерыиисниженияения его ввыбросоввватмосферуос еру...Одинизнаиболеерациональныхметодоврешенияения этойзадачи––методдвойного контактированияиидвойнойабсорбции((ДКДА)::реакционнуюссмесь, ввкоторойстепеньпревращенияSO22
составляет90––95%,, охлаждаютда т иинаправляютввпромежутое уточныйй абсорбердляввыделенияSO33;;ввоставшемсяе ся реакционномгазесоотношениеO22::SO22существенноественно повышается,ается, чтоприводитккссмещениюению равновесияреакции
вправо..Вновьнагретыйреакционныйгазопятьподаютввконтактныйй аппарат,гденадостигается95%степень превращенияения оставшегосяегося SO22..Суммарнаяарная степеньпревращенияSO22ввтакомпроцесседостигает99,5––99,8%..
Абсорбция триоксида серы
H2SO4 + H2O |
|
H2SO4 + Q |
|
Абсорбция триоксида серы – последняя стадия процесса на которой образуется серная кислота. Реакция протекает достаточно интенсивно как в жидкой, так и в газовой фазе. Кроме того H2SO4 может растворять в себе
SO3, образуя олеум. Этот продукт удобен для транспортировки, поскольку
он не вызывает коррозии даже обычных сталей. В то же время растворы серной кислоты чрезвычайно агрессивны.
Газ, содержащий SO3 после реактора проходит последовательно олеумый
(1) и моногидратный (2) абсорберы. Другой компонент реакции (H2O)
подается противотоком через сборник в моногидратный абсорбер. За счет интенсивной циркуляции жидкости (абсорбата) в ней можно поддерживать близкую к оптимальной концентрацию H2SO4 – 98,3% (увеличение
концентрации за проход жидкости не более 1 – 1,5%). Концентрационные условия абсорбции обеспечиваю полное поглощение SO3 и минимальное
образование сернокислого тумана. Кислота из моногидратного абсорбера поступает в олеумный. В нем циркулирует 20% раствор Н2SO4, который
частично отбирается как конечный продукт – олеум. Кислота из предыдущего абсорбера – моногидрат – также может быть продуктом. В системе циркуляции предусмотрены холодильники для съема тепла реакции и обеспечения более эффективной абсорбции. При температурах меньше 100 С SO3 поглощается практически полностью, диоксид серы –
практически не поглощается.

Нитрозный способ (башенный) производства серной кислоты 
HNO3 |
NO |
|
|
H2O |
7 |
||
5 |
1 |
2 |
4 |
2 |
6 |
|
|
|
|
|
|
Обж. 1/3 |
2/3 |
|
NO |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
газ |
|
3 |
|
|
12 |
|
|
|
|
|
11 |
8 |
11 |
8 |
8 |
|
|
|
|
|
|
нитроза |
|
|
|
9 |
10 |
|
||||
75-76% |
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
||
|
H2SO4 |
|
|
|
|
|
|
|
|
|
|
продукц. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
Около 1/3 обжигового газа поступает в 1, остальные 2/3 в 2. На выходе из башни 1 и 2 |
|
|
|
|
|
||||
|
|
1. |
Башня-денитратор |
|
|
|||||
|
газовые потоки объединяются и идут в 3. Затем в 4 и последовательно в 5, 6, 7. |
|
|
|
||||||
|
|
2. |
Башня-концентратор |
|
|
|||||
|
Между 6 и 7 поставлен трубокомпрессор. В 9 происходит отделение тумана мелких |
|
|
|
||||||
|
|
3. |
Продукционная башня |
|
|
|||||
|
капелек серной кислоты и газ идет в трубу на выброс в атмосферу. |
|
|
|
|
|||||
|
|
|
4. |
Окисленная башня |
|
|
||||
|
В денитраторе происходит гидролиз нитрозилсерной кислоты |
|
|
|
|
|||||
|
|
|
5. |
- 7. Асборбционные башни |
|
|||||
|
с образованием серной и азотистой кислот: HNSO5 + H2O ↔ H2SO4 + HNO2 |
– Q (эндо) |
|
|
||||||
|
|
8. |
Сборники |
|
|
|||||
|
Одновременно: SO2 + H2O ↔ H2SO3 + Q (экзо) |
|
|
|
|
|
||||
|
|
|
|
9. |
Электрофильтр |
|
|
|||
|
Окисление сернистого газа протекают преимущественно в жидкой фазе: |
|
|
|
|
|||||
|
|
|
10. |
Трубы для отходящих газов |
|
|||||
|
H2SO3(ж.) + HNO3(ж.) ↔ H2SO4(ж.) + NO(г.) + Q |
|
|
|
|
|||||
|
|
|
|
11. |
Холодильники |
|
|
|||
|
Недостаток: недостаточная концентрация 2NO + O2 ↔ 2NO2 |
|
|
12. |
Компрессор |
|
|
|||
|
|
|
NO: NO2 = 1:1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Азотистый ангидрид NO + NO2 = N2O3
Растворяясь в серной кислоте, орошается в абсорбционные колонные 5 – 7, образуя нитрозил, который прекрасно растворяется в
серной кислоте , давая нитрозу, поступающую в 1.
N2O3 + H2SO4 ↔ 2HNSO5 + H2O + Q
Недостаток метода: разбавленная кислота. Достоинство: нет очистки обжигового газа.

Производство серной кислоты по методу «мокрого катализа»
Позволяет утилизировать газы сероочистки, получаемые при очистке коксового газа, газов нефтепереработке, которые очень богаты H2S (85 – 95%). Это экологически выгодно. Около 10%
серной кислоты получают по этому методу. Процесс состоит из 3х стадий:
Стадия 1: Сжигание H2S до SО2 : 2H2S + 3O2 = 2H2O + 1038 кДж Стадия 2: Контактное окисление SO2 → SO3 (любой контактный аппарат)
Стадия 3: Улавливание SO3 с образованием H2SО4:
Достоинства: получается высокочистая серная кислота и используются отходы производства.
Перспективы развития сернокислотных производств
|
|
Получение высококонцентрированного сернистого газа позволяет создать |
Мощным средством |
|
|
повышения |
|
энерготехнологические циклические производства серной кислоты из серы и |
производительности |
|
колчедана. Диоксид серы, полученный с применением технического кислорода |
сернокислотных |
|
окисляют на 90% в контактном аппарате с «кипящем слоем» катализатора. При |
производств является |
|
абсорбции SO3 получают высококонцентрированный олеум и моногидрат. Газ |
увеличение концентрации |
|
после абсорбции возвращают на контактирование. В реакторе общая степень |
диоксида серы. |
|
превращения составляет 99,995%. Для отвода накапливающегося в результате |
Высококонцентрированные |
|
многократного рецикла азота часть газа после абсорбции пропускают через |
газы, содержащие до 80% |
|
малогабаритную сернокислотную установку, из которой азот выбрасывается в |
SO2 уже начали получать в |
|
атмосферу. Интенсивность работы циклической системы, работающей под |
производствах цветных |
|
давлением около 1 МПа, с применением кислорода в десятки раз превышает |
металлов из их сульфидных |
|
интенсивность обычных систем. Потери серы с отходящими газами и |
руд с применением |
|
соответственно выбросы SO2 и SO3 в окружающую среду также снижены в |
технического кислорода. |
|
десятки раз. |
|
|
|

Схемы предусматривают генерирование водяного пара (4 Мпа) за счет тепла газов обжига, который может быть использован как в самой установке для компенсации затрат энергии на работу компрессоров и насосов, так и в других цехах завода. Тепло сернистых газов после прохождения очередного каталитического слоя можно использовать для предварительного подогрева реагентов на входе в контактный аппарат. Тепло сорбции используется для бытовых нужд.
Важнейшие направления развития производства серной кислоты
1.Увеличение мощности аппаратуры при одновременной комплексной автоматизации производства.
2.Интенсификация процессов путем применения реакторов «кипящего слоя» (как на
стадии обжига, так и при контактном окислении SO2), более активных катализаторов, повышенных давлений и использование технического кислорода в процессе окисления.
3.Разработка энерготехнологических схем с максимальным использованием теплоты экзотермических реакций, в том числе циклических систем под давлением.
4.Увеличение степеней превращения на всех стадиях производства для снижения расходных коэффициентов по сырью и материалам и снижение вредных выбросов.
5.Утилизация вредных выбросов из отходящих газов, а также твердых отходов (огарок). Например, нежелательные вредные примеси H2S и SO2 из разных потоков
можно объединить и подвергнуть концентрированию с целью перевода их в
элементарную серу. SO |
|
+ 2 H S |
|
3 S + 2 H O |
|
2 |
2 |
|
|
|
|
|
2 |
|
Твердый огарок, содержащий оксид железа можно использовать в качестве сорбента для улавливания газов и очистки сточных вод. 9
