
Лекции / Лекции_49-50(б)
.DOC
Малые циклы
Циклопропан
Циклопропан проявляет двойственную реакционную способность. В силу некоторого -характера и непрочности «банановых» связей он, подобно алкенам, вступает в реакции присоединения с раскрытием цикла. С другой стороны, подобно алканам, циклопропан вступает в реакции замещения водорода.
Г
 идрогенолиз
идрогенолиз
Циклопропан присоединяет водород легче других циклоалканов, но в более жестких условиях, чем алкены.
Гидрогалогенирование
Ц иклопропан
взаимодействует с водными растворами
HCl и HBr с образованием
пропилгалогенидов.
иклопропан
взаимодействует с водными растворами
HCl и HBr с образованием
пропилгалогенидов.
М еханизм
реакции до конца не установлен. Вероятнее
всего, это электрофильное присоединение.
еханизм
реакции до конца не установлен. Вероятнее
всего, это электрофильное присоединение.
Такой механизм объясняет направление присоединения к замещенным циклопропанам, которое обычно протекает по правилу Марковникова. Электрофил (Н+) присоединяется к более гидрогенизированному атому углерода, а нуклеофил (Hal-) – к атому углерода, способному лучше стабилизировать положительный заряд.
П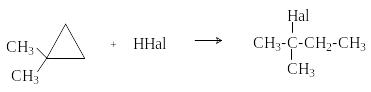
 рисоединение
галогеноводородов к бензоилциклопропану
протекает против правила Марковникова
(по аналогии с ,-непредельными
карбонильными соединениями), что
подтверждает наличие сопряжения
циклопропанового кольца с -связью
карбонильной группы.
рисоединение
галогеноводородов к бензоилциклопропану
протекает против правила Марковникова
(по аналогии с ,-непредельными
карбонильными соединениями), что
подтверждает наличие сопряжения
циклопропанового кольца с -связью
карбонильной группы.
Присоединение хлороводорода к сабинену протекает по концам сопряженной системы (1,5-присоединение).
Гидрокси- и алкоксимеркурирование
Ц
 иклопропаны,
подобно алкенам, легко присоединяют
соли ртути(II) в среде протонных
растворителей (вода, спирты). Как и в
случае алкенов, процесс протекает как
сопряженное присоединение.
иклопропаны,
подобно алкенам, легко присоединяют
соли ртути(II) в среде протонных
растворителей (вода, спирты). Как и в
случае алкенов, процесс протекает как
сопряженное присоединение.
Галогенирование
Х![]() лор
и бром реагируют с циклопропаном
по-разному. Циклопропан не реагируют с
бромом в темноте и в отсутствие
катализаторов. В условиях радикального
бромирования образуется 1,3-дибромциклопропан.
лор
и бром реагируют с циклопропаном
по-разному. Циклопропан не реагируют с
бромом в темноте и в отсутствие
катализаторов. В условиях радикального
бромирования образуется 1,3-дибромциклопропан.
Р![]() адикальное
хлорирование дает продукт замещения
водорода – хлорциклопропан.
адикальное
хлорирование дает продукт замещения
водорода – хлорциклопропан.
Окисление
Ц иклопропановое
кольцо очень устойчиво к действию
окислителей. В этом циклопропан проявляет
сходство с алканами. Циклопропаны, в
отличие от алкенов, не окисляются в
условиях реакции Вагнера (KMnO4,
H2O, 200C). Циклопропановое
кольцо устойчиво даже к действию такого
сильного окислителя, как озон, в чем
превосходит бензольное кольцо.
иклопропановое
кольцо очень устойчиво к действию
окислителей. В этом циклопропан проявляет
сходство с алканами. Циклопропаны, в
отличие от алкенов, не окисляются в
условиях реакции Вагнера (KMnO4,
H2O, 200C). Циклопропановое
кольцо устойчиво даже к действию такого
сильного окислителя, как озон, в чем
превосходит бензольное кольцо.
Циклобутан
Ц иклобутан
по свойствам аналогичен алканам. Для
него характерны реакции замещения. Он
практически не проявляет свойств
ненасыщенного соединения. Раскрытие
цикла происходит при гидрогенолизе,
который идет труднее, чем в случае
циклопропана.
иклобутан
по свойствам аналогичен алканам. Для
него характерны реакции замещения. Он
практически не проявляет свойств
ненасыщенного соединения. Раскрытие
цикла происходит при гидрогенолизе,
который идет труднее, чем в случае
циклопропана.
Обычные циклы
Х имически
свойства циклопентана и циклогексана
аналогичны свойствам алканов. Для них
характерны реакции замещения
(галогенирование, нитрование), окисления,
дегидрирования. В жестких условиях
протекает гидрогенолиз. Наиболее важные
реакции циклогексана суммированы на
схеме.
имически
свойства циклопентана и циклогексана
аналогичны свойствам алканов. Для них
характерны реакции замещения
(галогенирование, нитрование), окисления,
дегидрирования. В жестких условиях
протекает гидрогенолиз. Наиболее важные
реакции циклогексана суммированы на
схеме.
Влияние конформационных факторов на реакционную способность производных циклогексана.
Существует ряд экспериментальных фактов, которые свидетельствуют о разной реакционной способности заместителей в аксиальном и экваториальном положениях циклогексанового кольца. Различными могут быть скорости реакций образования аксиального и экваториального конформеров, а также скорости и направления реакций отщепления и замещения с их участием.
С равнение
реакционной способности заместителей
возможно в случае их фиксированного
аксиального или экваториального
положения, что имеет место в жестких
полициклических структурах, когда
невозможен процесс интерконверсии
(транс-декалин, стеран). В производных
циклогексана процесс интерконверсии
может быть подавлен за счет введения в
кольцо группы с высокой конформационной
энергией, например, трет-бутильной.
Эта группа занимает исключительно
экваториальное положение, за что её
называют «конформационным якорем». В
цис-1,4-замещенном трет-бутилциклогексане
второй заместитель будет находиться в
аксиальном, а в транс-изомере – в
экваториальном положении, так как в
обоих случаях равновесие процесса
интерконверсии будет практически нацело
сдвинуто в сторону конформера с
экваториальным положением трет-бутильной
группы.
равнение
реакционной способности заместителей
возможно в случае их фиксированного
аксиального или экваториального
положения, что имеет место в жестких
полициклических структурах, когда
невозможен процесс интерконверсии
(транс-декалин, стеран). В производных
циклогексана процесс интерконверсии
может быть подавлен за счет введения в
кольцо группы с высокой конформационной
энергией, например, трет-бутильной.
Эта группа занимает исключительно
экваториальное положение, за что её
называют «конформационным якорем». В
цис-1,4-замещенном трет-бутилциклогексане
второй заместитель будет находиться в
аксиальном, а в транс-изомере – в
экваториальном положении, так как в
обоих случаях равновесие процесса
интерконверсии будет практически нацело
сдвинуто в сторону конформера с
экваториальным положением трет-бутильной
группы.
При этом транс-изомер будет обладать большей термодинамической стабильностью, так как в нем оба заместителя занимают экваториальное положение.
Реакции замещения
И звестно,
что нуклеофильное замещение групп в
аксиальном положении циклогексанового
кольца происходит легче, чем в
экваториальном. Например, сольволиз
цис-4-трет-бутилтозилата в этаноле
идет в ~4 раза быстрее, чем сольволиз
транс-изомера. Процесс протекает
по механизму SN1,
так что обе реакции идут через один тот
же интермедиат (карбокатион) и,
следовательно, имеют одинаковые по
энергии переходные состояния в
скоростьопределяющей стадии. Поскольку
энергия исходного состояния выше у
цис-изомера, он реагирует с большей
скоростью.
звестно,
что нуклеофильное замещение групп в
аксиальном положении циклогексанового
кольца происходит легче, чем в
экваториальном. Например, сольволиз
цис-4-трет-бутилтозилата в этаноле
идет в ~4 раза быстрее, чем сольволиз
транс-изомера. Процесс протекает
по механизму SN1,
так что обе реакции идут через один тот
же интермедиат (карбокатион) и,
следовательно, имеют одинаковые по
энергии переходные состояния в
скоростьопределяющей стадии. Поскольку
энергия исходного состояния выше у
цис-изомера, он реагирует с большей
скоростью.
Б ыло
найдено, что транс-4-трет-бутилциклогексанол
(содержит экваториальный гидроксил)
ацетилируются в 3,7 раза быстрее цис-изомера
(содержит аксиальный гидроксил).
Скоростьопределяющей стадией процесса
является образование тетраэдрического
интермедиата, который можно принять за
модель переходного состояния.
ыло
найдено, что транс-4-трет-бутилциклогексанол
(содержит экваториальный гидроксил)
ацетилируются в 3,7 раза быстрее цис-изомера
(содержит аксиальный гидроксил).
Скоростьопределяющей стадией процесса
является образование тетраэдрического
интермедиата, который можно принять за
модель переходного состояния.
В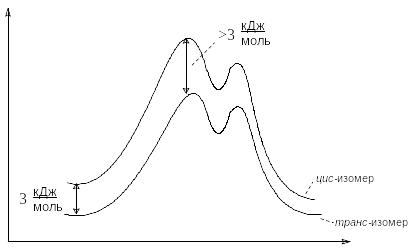 следствие
того, что гидроксильная группа занимает
экваториальное положение, транс-изомер
более устойчив, чем цис-изомер на
величину свободной конформационной
энергии гидроксильной группы (3 кДж/моль).
следствие
того, что гидроксильная группа занимает
экваториальное положение, транс-изомер
более устойчив, чем цис-изомер на
величину свободной конформационной
энергии гидроксильной группы (3 кДж/моль).
Поскольку в тетраэдрических интермедиатах (I и II) увеличивается эффективный объем заместителя и его конформационная энергия, то разность в энергиях переходных состояний должна быть больше 3 кДж/моль. А это означает, что цис-изомер будет ацетилироваться медленнее вследствие более высокой энергии активации.
Реакции отщепления
Р еакции
отщепления, протекающие по механизму
Е2, подчиняются определенным
стереоэлектронным требованиям: уходящие
группы должны быть компланарны и
находится в анти-положении. В
циклогексановом кольце этим требованиям
удовлетворяет только 1,2-диаксиальное
положение заместителей. Если уходящая
группа находится в экваториальном
положении, то она не может участвовать
в Е2 реакции до того, как молекула совершит
конформационный переход.
еакции
отщепления, протекающие по механизму
Е2, подчиняются определенным
стереоэлектронным требованиям: уходящие
группы должны быть компланарны и
находится в анти-положении. В
циклогексановом кольце этим требованиям
удовлетворяет только 1,2-диаксиальное
положение заместителей. Если уходящая
группа находится в экваториальном
положении, то она не может участвовать
в Е2 реакции до того, как молекула совершит
конформационный переход.
Х арактерным
примером, демонстрирующим зависимость
скорости и направления Е2 реакций от
ориентации заместителя, служит
элиминирование в ментил- и неоментилхлоридах
под действием этилата натрия.
Неоментилхлорид в наиболее устойчивой
конформации содержит атом галогена в
аксиальном положении. С ним соседствуют
два аксиальных атома водорода, поэтому
при элиминировании образуются два
продукта – ментен-3 и ментен-2. При этом
преобладает продукт элиминирования по
правилу Зайцева (ментен-3).
арактерным
примером, демонстрирующим зависимость
скорости и направления Е2 реакций от
ориентации заместителя, служит
элиминирование в ментил- и неоментилхлоридах
под действием этилата натрия.
Неоментилхлорид в наиболее устойчивой
конформации содержит атом галогена в
аксиальном положении. С ним соседствуют
два аксиальных атома водорода, поэтому
при элиминировании образуются два
продукта – ментен-3 и ментен-2. При этом
преобладает продукт элиминирования по
правилу Зайцева (ментен-3).
В наиболее устойчивой конформации
ментилхлорида атом хлора занимает
экваториальное положение, из которого
невозможно Е2 элиминирование. Следовательно,
в реакции будет участвовать менее
устойчивая конформация, концентрация
которой в равновесной смеси низка. Кроме
того, в этой конформации ментилхлорид
содержит только один атом водорода в
аксиальном положении по соседству с
хлором. Как следствие этого, ментилхлорид
реагирует с меньшей скоростью и дает
только один продукт элиминирования –
ментен-2. При этом отщепление происходит
с нарушением правила Зайцева.
наиболее устойчивой конформации
ментилхлорида атом хлора занимает
экваториальное положение, из которого
невозможно Е2 элиминирование. Следовательно,
в реакции будет участвовать менее
устойчивая конформация, концентрация
которой в равновесной смеси низка. Кроме
того, в этой конформации ментилхлорид
содержит только один атом водорода в
аксиальном положении по соседству с
хлором. Как следствие этого, ментилхлорид
реагирует с меньшей скоростью и дает
только один продукт элиминирования –
ментен-2. При этом отщепление происходит
с нарушением правила Зайцева.
Средние циклы
Наибольший интерес представляют трансаннулярные реакции в средних циклах. Они осуществляются с участием пространственно сближенных атомов, находящихся на разных сторонах кольца. Их взаимодействие обусловлено характерными для средних циклов конформациями, в которых некоторые связи направлены внутрь цикла.
П ри
элиминировании 14С-циклооктилтозилата
меченый атом углерода оказывается в
разных положениях циклооктенового
кольца. Реакция сопровождается перескоком
пространственно приближенного атома
Н с противоположной стороны цикла к
карбениевому центру.
ри
элиминировании 14С-циклооктилтозилата
меченый атом углерода оказывается в
разных положениях циклооктенового
кольца. Реакция сопровождается перескоком
пространственно приближенного атома
Н с противоположной стороны цикла к
карбениевому центру.
Т рансаннулярное
взаимодействие пространственно
сближенных двойных связей приводит к
образованию бициклического продукта
в реакции электрофильного присоединения
брома к 1,5-циклононадиену.
рансаннулярное
взаимодействие пространственно
сближенных двойных связей приводит к
образованию бициклического продукта
в реакции электрофильного присоединения
брома к 1,5-циклононадиену.
При протонировании N-замещенного азациклооктан-5-она протон атакует не атом азота, а карбонильную группу. При этом образуется бицикличекий продукт присоединения, что уменьшает энергию трасаннулярного напряжения молекулы.
Р еакции
расширения и сужения цикла
еакции
расширения и сужения цикла
Алициклы способны к превращениям, которые сопровождаются изменением размера цикла. Такая перестройка углеродного скелета происходит в ходе реакций с промежуточным образованием карбениевого центра. Если положительный заряд появляется на эндоциклическом атоме углерода, то происходит сужение цикла. При возникновении положительного заряда на атоме углерода, соседнем с циклом, происходит расширение цикла.
Реакции с расширением цикла протекают успешно для циклов любого размера. Уменьшение размера цикла, как правило, сопровождается увеличением энергии напряжения, поэтому соответствующие переходы могут реализоваться, когда энергетические различия не слишком велики. Реакции сужения цикла наиболее характерны для переходов от С4 к С3 и от С6 к С5.
Ч аще
всего генерирование карбениевого центра
происходит в реакциях дезаминирования
и дегидратации. Расширение или сужение
цикла происходит при дезаминировании
соответствующих аминов под действием
азотистой кислоты (перегруппировка
Демьянова).
аще
всего генерирование карбениевого центра
происходит в реакциях дезаминирования
и дегидратации. Расширение или сужение
цикла происходит при дезаминировании
соответствующих аминов под действием
азотистой кислоты (перегруппировка
Демьянова).
А налогичная
перестройка углеродного скелета
происходит при дегидратации спиртов в
кислой среде.
налогичная
перестройка углеродного скелета
происходит при дегидратации спиртов в
кислой среде.
Ц иклоалканоны
взаимодействуют с диазометаном, давая
продукты расширения цикла. Реакция
имеет практическое значение для получения
из циклогексанона циклических кетонов
со средним размером кольца.
иклоалканоны
взаимодействуют с диазометаном, давая
продукты расширения цикла. Реакция
имеет практическое значение для получения
из циклогексанона циклических кетонов
со средним размером кольца.
