- •Вопрос 1 Предмет и задачи биологической химии. Обмен веществ и энергии, сложная структурная организация, гомеостаз и самовоспроизведение как важнейшие признаки живой материи.
- •Вопрос 3 Аминокислоты, входящие в состав белков, их строение и свойства. Пептиды. Биологическая роль аминокислот и пептидов.
- •Классификация аминокислот по химическому строению:
- •Вопрос 5 Конформация пептидных цепей в белках (вторичная структура). Типы химических связей, участвующих в формировании вторичной структуры. Супервторичные структуры.
- •4. Супервторичная структура в виде "лейциновой застёжки-молнии".
Вопрос 5 Конформация пептидных цепей в белках (вторичная структура). Типы химических связей, участвующих в формировании вторичной структуры. Супервторичные структуры.
Вторичная структура белка – пространственная структура, образующаяся в
результате взаимодействий между функциональными группами, входящими в состав пептидного остова. В формировании вторичной стр-ры принимают участие водородные связи между группами С=О и N-H разных аминокислот.
Пептидные цепи могут приобретать регулярные структуры 2-х типов:
1. α-спираль – пептидный остов закручивается в виде спирали за счёт образования
водородных связей между атомами кислорода карбонильных групп и атомами азота аминогрупп, входящих в состав пептидных групп через 4 аминокислотных остатка. Водородные связи ориентированы вдоль оси спирали. На один виток α-спирали приходится 3,6 аминокислотных остатка.
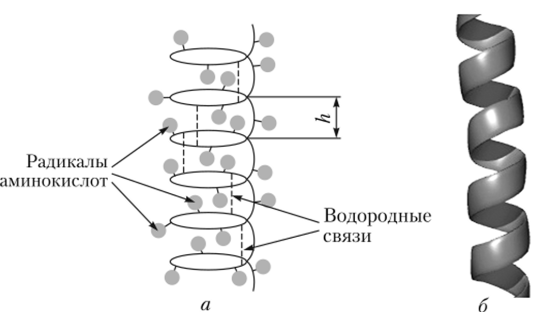
В образовании водородных связей участвуют практически все атомы кислорода и
водорода пептидных групп. В результате α-спираль "стягивается" множеством водородных связей. Т.к. все гидрофильные группы пептидного остова обычно участвуют в образовании водородных связей, гидрофильность (т.е. способность образовывать водородные связи с водой) α-спиралей уменьшается, а их гидрофобность увеличивается.
α-спиральная структура – наиболее устойчивая конформация пептидного остова,
отвечающая минимуму свободной энергии. В результате образования α-спиралей полипептидная цепь укорачивается, но если создать условия для разрыва водородных связей, полипептидная цепь вновь удлинится.
Радикалы АК находятся на наружной стороне α-спирали и направлены от
пептидного остова в стороны и не участвуют в образовании водородных связей.
Нарушение формирования α-спирали могут вызвать:
Пролин – его атом азота входит в состав жёсткого кольца, что исключает
возможность вращения вокруг -N-CH- связи. У атома азота пролина, образующего пептидную связь с другой аминокислотой, нет атома водорода. В результате пролин не способен образовать водородную связь в данном месте пептидного остова, и α-спиральная структура нарушается. Обычно в этом месте пептидной цепи возникает петля или изгиб;
Участки, где последовательно расположены несколько одинаково заряженных
радикалов, между которыми возникают электростатические силы отталкивания;
Участки с близко расположенными объёмными радикалами, механически
нарушающими формирование α-спирали, например метионин, триптофан.
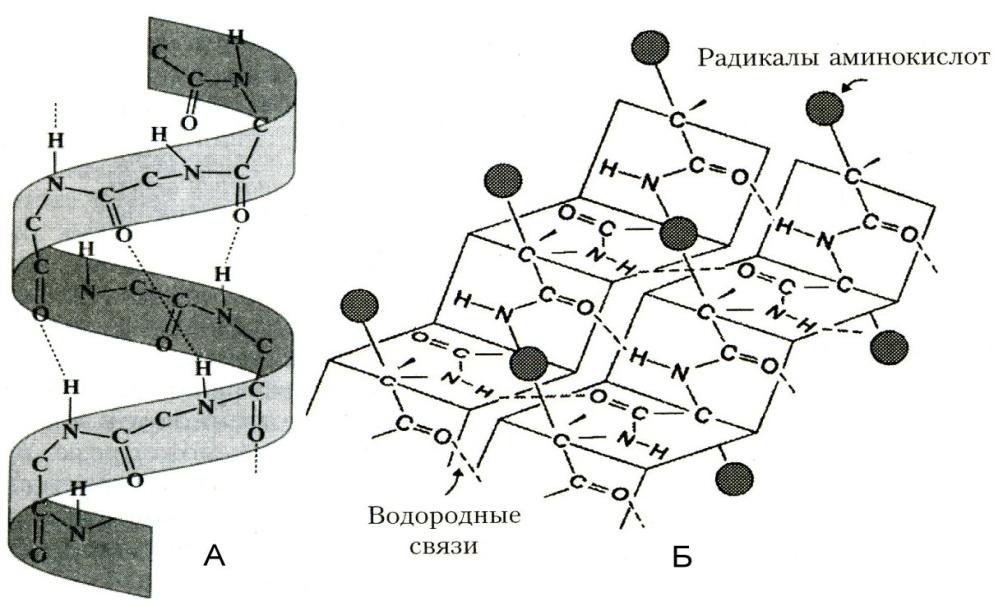
2. β-структура формируется за счёт образования множества водородных связей
между атомами пептидных групп линейных областей одной полипептидной цепи, делающей изгибы, или между разными полипептидными цепями. Она образует фигуру, подобную листу, сложенному "гармошкой", - β-складчатый слой.
Водородные связи расположены перпендикулярно полипептидной цепи.
Межцепочечные связи – водородные связи, обр. между атомами пептидного остова различных полипептидных цепей
Внутрицепочечные связи – водородные связи, обр. между линейными участками внутри одной полипептидной цепи
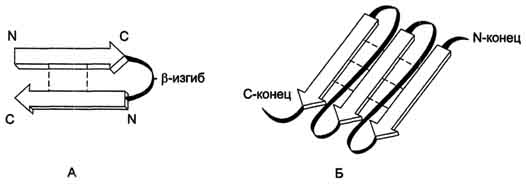
В зависимости от направления связанных полипептидных цепей выделяют:
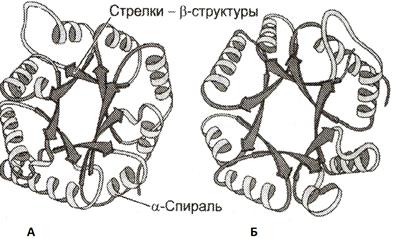
Антипараллельная β-структура – если связанные полипептидные цепи направлены противоположно (N- и C-концы не совпадают – рис. А)
Параллельная β-складчатая структура – если N- и С-концы полипептидных цепей совпадают (рис. Б)
При разрыве водородных связей:
Если разорвать водородные связи, образующие α-спираль, полипептидная цепь удлинится (за счет устранения «стягивания»)
Разрыв водородных связей, формирующих β-структуры, не вызывает удлинения данных участков полипептидных цепей.
Беспорядочные клубки – области с нерегулярной вторичной структурой в белках.
Они представлены петлеобразными и кольцеобразными структурами, имеющими меньшую регулярность укладки, чем описанные выше α-спиралъ и β-структура.
В областях беспорядочного клубка полипептидные цепи могут легко изгибаться и
изменять свою конфигурацию, в то время как a-спираль и b-структуры представляют собой довольно жесткие структуры.
Беспорядочным клубком также часто называют денатурированный белок,
образовавшийся после разрыва слабых внутримолекулярных связей и потерявший свою упорядоченную структуру.
Содержание разных типов вторичных структур в белках
По наличию α-спиралей и β-структур глобулярные белки можно разделить на 4 категории:
1 категория: белки, в структуре которых обнаружены только α-спирали
(миоглобин и гемоглобин)
2 категория: белки с α-спиралями и β-структурами, иногда образующими однотипные сочетания, встречающиеся в разных индивидуальных белках.
В одном из доменов лактатдегидрогеназы в центре расположены β-структуры
полипептидной цепи в виде скрученного листа, и каждая β-структура связана с α-спиральным участком, находящимся на поверхности молекулы (такой же домен находится в молекуле фосфоглицераткиназы)
3 категория: белки, имеющие только β-структуры (в иммуноглобулинах, в ферменте супероксиддисмутазе)
4 категория: белки, имеющие в своём составе лишь незначительное количество регулярных вторичных структур (α-спиралей и β-структур)
Супервторичная структура белков – структура, формирующаяся за счёт
межрадикальных взаимодействий между элементами вторичной структур.
Определённые характерные сочетания α-спиралей и β-структур часто обозначают
как «структурные мотивы», они имеют специфичные названия (основных 4)
1. Супервторичная структура типа β-бочонка. Такая структура действительно
напоминает бочонок, где каждая β-структура расположена внутри и связана с α-спиральным участком полипептидной цепи, находящимся на поверхности молекулы.
Такую стр-ру имеют: фермент триозо-фосфатизомераза, один домен пируваткиназы
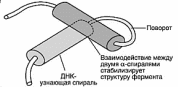
2. Структурный мотив "α-спираль-поворот-α-спираль" обнаружен во многих
ДНК-связывающих белках. В данный структурный мотив входят две α-спирали: одна короткая, другая длинная, которые соединены поворотом полипептидной цепи.
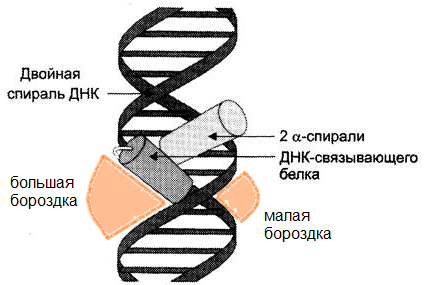
Двухспиральная структура ДНК имеет две бороздки – большую и малую. Большая
бороздка хорошо приспособлена для связывания белков, имеющих небольшие спиральные участки. Т.о. более короткая α-спираль ДНК-связывающего белка располагается поперёк бороздки ДНК, а более длинная α-спираль – в большой бороздке, образуя нековалентные специфические связи радикалов аминокислот с нуклеотидами ДНК.
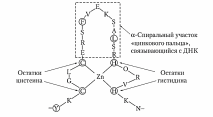
3. Супервторичная структура в виде "цинкового пальца" также часто
встречают в ДНК-связывающих белках.
"Цинковый палец" – фрагмент белка, содержащий около 20 АК остатков, в
котором Zn связан с радикалами 4х АК: обычно с двумя остатками цистеина и двумя - гистидина. Два близко лежащих остатка цистеина отделены от двух других остатков гистидина (или цистеина) аминокислотной последовательностью, состоящей примерно из 12 АК остатков, которая и образует α-спираль, способную специфично связываться с регуляторными участками большой бороздки ДНК.