
- •Вопрос 1 Предмет и задачи биологической химии. Обмен веществ и энергии, сложная структурная организация, гомеостаз и самовоспроизведение как важнейшие признаки живой материи.
- •Вопрос 3 Аминокислоты, входящие в состав белков, их строение и свойства. Пептиды. Биологическая роль аминокислот и пептидов.
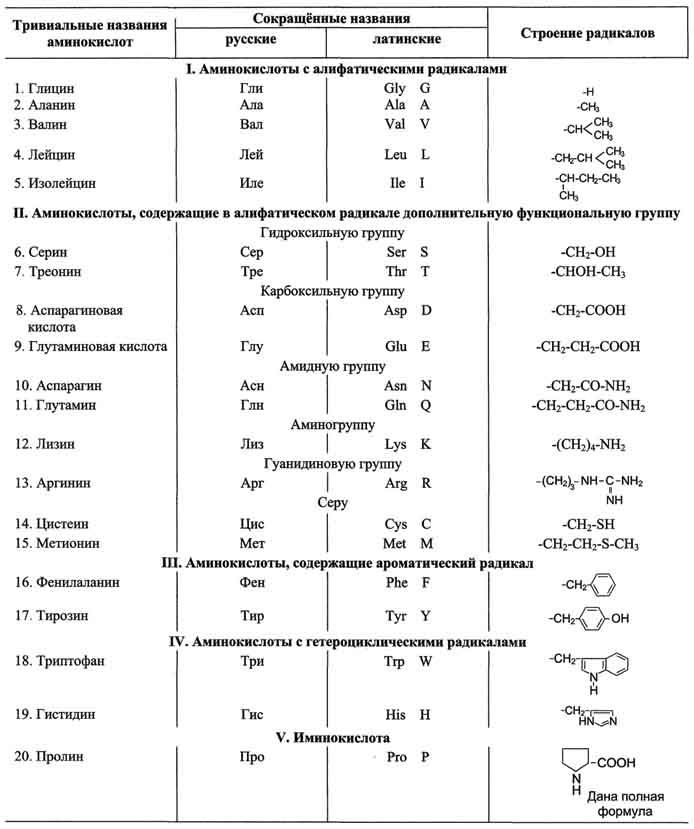
- •Классификация аминокислот по химическому строению:
- •Вопрос 5 Конформация пептидных цепей в белках (вторичная структура). Типы химических связей, участвующих в формировании вторичной структуры. Супервторичные структуры.
- •4. Супервторичная структура в виде "лейциновой застёжки-молнии".
Вопрос 3 Аминокислоты, входящие в состав белков, их строение и свойства. Пептиды. Биологическая роль аминокислот и пептидов.
Аминокислоты (АК) являются мономерами полимерных молекул белков.
В составе белков организма человека встречается только 20 аминокислот (протеиногенные АК).
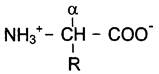
Общая структурная особенность аминокислот – наличие амино- и
карбоксильной групп, соединённых с одним и тем же α-углеродным атомом.
R – радикал аминокислот – у глицина представлен атомом водорода, но может иметь и более сложное строение.
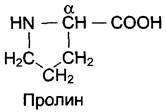
Пролин отличается от других аминокислот тем, что явл. иминокислотой, т.к.
радикал связан как с α-углеродным атомом, так и с аминогруппой, в результате чего молекула приобретает циклическую структуру.
При нейтральном значении pH α-аминокислоты существуют в виде биполярных
ионов (цвиттер-ионов)
Стереоизомерия аминокислот:
19 из 20 аминокислот благодаря 4-м разным заместителям у α-углеродным атома в
природе существуют в виде D- и L-форм. Но в составе белков они находятся только в виде L-форм.
Процесс рацемизации – D- и L- изомеры могут самопроизвольно
неферментативно превращаться в рацемат (эквимолярную смесь D- и L-изомеров)
Это может быть использовано для определения возраста людей: в твёрдой эмали
зубов имеется белок дентин, в котором L-аспартат переходит в D-изомер при температуре тела человека со скоростью 0,01% в год. В период формирования зубов в дентине содержится только L-изомер, поэтому по содержанию D-аспартата можно рассчитать возраст обследуемого.
Классификация аминокислот по химическому строению:
Изменение суммарного заряда АК в зависимости от рН среды:
При нейтральных значениях рН все кислотные (способные отдавать Н+) и все
основные (способные присоединять Н+) функциональные группы находятся в диссоциированном состоянии.
АК, содержащие недиссоциирующий радикал, имеют суммарный нулевой заряд.
АК, содержащие кислотные функциональные группы, имеют суммарный отрицательный заряд
АК, содержащие основные функциональные группы, - положительный заряд
Изменение рН в кислую сторону (т.е. повышение в среде конц. Н+) приводит к
подавлению диссоциации кислотных групп. В сильно кислой среде все аминокислоты приобретают положительный заряд.
Изменение рН в щелочную сторону (повышение конц. ОН- групп) вызывает
отщепление Н+ от основных функциональных групп, что приводит к уменьшению положительного заряда. В сильнощелочной среде все аминокислоты имеют суммарный отрицательный заряд.

Модифицированные АК, присутствующие в белках: в синтезе белков организма
человека принимают участие только 20 перечисленных АК, но в составе некот. белков могут встречаться модифицированные АК. Модификации аминокислотных остатков осуществляются уже в составе белков, т.е. только после окончания их синтеза. Введение дополнительных функциональных групп в структуру аминокислот придаёт белкам свойства, необходимые для выполнения ими специфических функций
Например: в молекуле коллагена присутствуют гидроксипроизводные лизина и
пролина (5-гидроксилизин и 4-гидроксипролин)
Пептиды – соединения, состоящие из α-аминокислот, ковалентно связанных друг с
другом пептидной связью, образованной между α-карбоксильной гр. одной АК и α-аминогруппой другой
Классификация пептидов:
Олигопептиды – пептиды, содержащие до 10 аминокислот (в названии указывают
кол-во АК, входящих в состав олигопептида – трипептид, пентапептид и т.д.)
Полипептиды – пептиды, содержащие более 10 аминокислот
Белки – пептиды, состоящие более чем из 50 АК
Аминокислотные остатки – мономеры АК, входящие в состав белков
N-конец – аминокислотный остаток, имеющий свободную NH2-гр, пишется слева.
C-конец – аминокислотный остаток, имеющий свободную α-карбоксильную группу, пишется справа
Пептиды пишутся и читаются с N-конца
Биологическая роль аминокислот:
Аминокислоты явл. мономерами пептидов и соответственно белков
Являются источником образования нейромедиаторов в ЦНС (гистамин, серотонин дофамин, норадреналин)
Являются нейромедиаторами (глицин, ГАМК)
Участвуют в синтезе пуриновых и пиримидиновых оснований
Участвуют в синтезе глюкозы
Биологическая роль пептидов: (их можно разделить по группам по их осн.действия)
Пептиды, обладающие гормональной активностью (окситоцин, вазопрессин, рилизинг-гормоны гипоталамуса, меланоцитстимулирующий гормон,
глюкагон и др.);
Пептиды, регулирующие процессы пищеварения (гастрин, холецистокинин, вазоинтестиналшый пептид, желудочный ингибирующий пептид и др.);
Пептиды, регулирующие тонус сосудов и АД (брадикинин, калидин,
ангиотензин II);
Пептиды, обладающие обезболивающим действием (энкефалины и эндорфины и другие опиоидные пептиды)
Антибиотики (грамицидин)
Антиоксиданты (глутатион)
Функции пептидов зависят от их первичной структуры. Изменение в
аминокислотном составе пептидов часто приводит к потере одних и возникновению других биологических свойств.
Например: ангиотензин I по структуре очень похож на ангиотензин II (имеет
только две дополнительные аминокислоты с С-конца), но при этом не обладает биологической активностью.
Вопрос 4
Первичная структура белков. Пептидная связь, ее характеристика. Зависимость биологических свойств белков от первичной структуры. Нарушение первичной структуры и функции гемоглобина А (на примере гемоглобина S).
Первичная структура белка – линейная полипептидная последовательность из
АК, соединенных между собой пептидными связями. Первичная стр-ра белка закодирована в ДНК (отдельном гене)
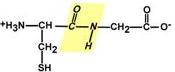
Пептидная связь – это связь между α-карбоксильной группой одной
аминокислоты и α-аминогруппой другой аминокислоты.
Образование пептидной связи (в рез-те отщепляется молекула воды):
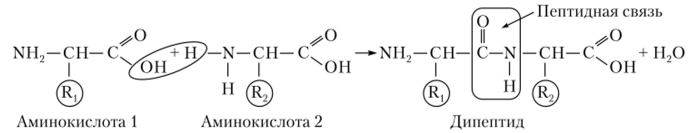
Пептидный остов – цепь повторяющихся атомов в полипептидной цепи -NH-CH-CO-
Характеристика пептидной связи:
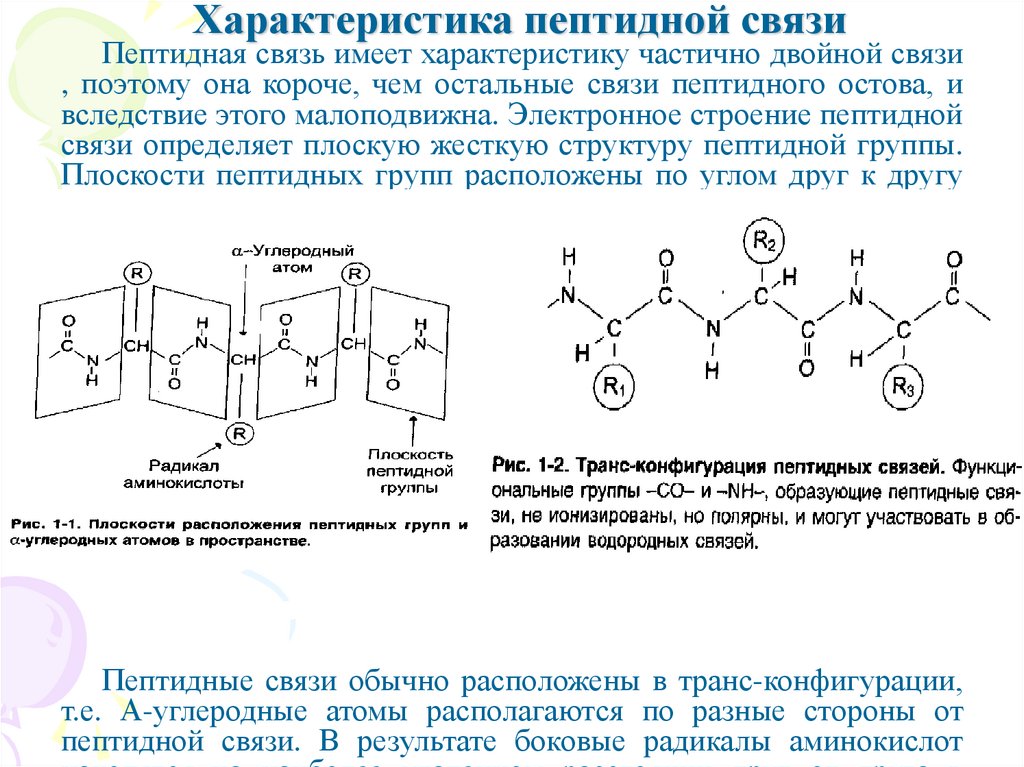
Пептидная связь имеет характеристику частично двойной связи, поэтому она
короче остальных связей пептидного остова и как следствие мало подвижна, она является жесткой структурой. Плоскости пептидных групп расположены под углом друг к другу (см.рис 1-1)
Транс-положение заместителей – радикалы аминокислот по отношению к оси
пептидной C-N-связи находятся по "разные" стороны, в транс-положении (см. рис 1-2)
Копланарность – все атомы, входящие в пептидную группу, находятся в одной
плоскости, при этом атомы "Н" и "О" расположены по разные стороны от пептидной связи.
Способность к образованию водородных связей – атомы кислорода и водорода,
входящие в пептидную группу, обладают способностью образовывать водородные связи с атомами кислорода и водорода других пептидных групп.
Пептидные связи очень прочны и самопроизвольно не разрываются при
нормальных условиях, существующих в клетках (нейтральная среда, температура тела).
Биологические свойства белка (способность белка выполнять присущую ему
функцию) определяются его первичной структурой. Даже небольшие изменения в последовательности аминокислот в белке могут привести к серьезному нарушению в его функционировании, возникновению тяжелого заболевания.
Молекулярные болезни – б., связанные с нарушениями первичной стр-ры белка
Например: серповидно-клеточная анемия
Гемоглобин А – тетрамер, состоящий из двух α- и двух β-цепей (2α2β)
В молекуле гемоглобина S (аномальный гемоглобин) мутантны две β-цепи, которых глутамат (высокополярная отрицательно заряженная АК) в положении 6 была заменена валином, содержащим гидрофобный радикал
В дезоксигемоглобине S имеется участок, комплементарный другому
участку таких же молекул, содержащему замененную АК. В результате молекулы дезоксигемоглобина начинают «слипаться», образуя удлиненные агрегаты, деформирующие эритроцит и приводящие к обр-ю эритроцитов в виде серпа
В оксигемоглобине S комплементарный участок недоступен для взаимодействия
из-за изменения конформации белка, поэтому молекулы оксигемоглобина S не слипаются.
Т.о. образованию агрегатов дезоксигемоглобина S способствуют условия,
повышающие конц. дезоксигемоглобина в клетках (физическая работа, гипоксия и др.)
Серповидные эритроциты плохо проходят через капилляры, часто закупоривают
сосуды и тем самым создают локальную гипоксию => повышается конц. дезоксигемоглобина S в эритроцитах, что увеличивает скорость образования агрегатов и вызывает еще большую деформацию эритроцитов (это может вызывать боль и некроз клеток в данной области)
Серповидно-клеточная анемия – гомозиготное рецессивное заболевание;
проявляется только в том случае, когда от обоих родителей наследуются 2 мутантных гена β-цепей глобина. Болезнь с рождения не проявляется до тех пор, пока значительное количество гемоглобина F (фетальный г., который после рождения обычно заменяется на HbA) не заместится на HbS. Возникают симптомы, характерные для анемии: головокружение и головные боли, учащенные сердцебиение, боли в конечностях и др.
Гетерозиготные индивидуумы, имеющие один нормальный ген HbA, а другой HbS
имеют лишь следовые кол-ва серповидных эритроцитов и нормальную продолжительность жизни.
Особенность: в Африке высока частота гена HbS, это связно с тем, что
гетерозиготные носители гена HbS менее чувствительны к малярии, чем люди с нормальным гемоглобином, т.к. их эритроциты имеют короткий срок жизни, поэтому возбудитель малярии не успевает закончить необходимую стадию развития (что и дает преимущество людям, гетерозиготным по HbS)
