
- •Лекция № 6 основные положения химической термодинамики и основы термохимии
- •Термодинамическая система
- •Процессы
- •Первое начало термодинамики ( I н т/д )
- •Правила знаков в термодинамике
- •Основы термохимии (т/х) Закон Гесса. Термохимические расчеты
- •Второе начало термодинамики (II н т/д)
- •Свободная энергия Гиббса. Критерий направленности процесса в неизолированных системах
- •Одно из основных уравнений химической термодинамики
- •Термодинамические расчеты
- •Третье начало термодинамики
- •Приложение Примеры решения задач
Термодинамические расчеты
G и S (как и U и Н) являются функцией состояния, т.к. их изменение (∆G и ∆S) зависят от начального и конечного состояния системы:
∆G = G2 – G1
∆S = S2 – S1
Поэтому, для вычисления ∆G и ∆S для химических реакций, можно использовать следствие из закона Гесса, предложенное им для величины ∆Н.
 ΔG0298
= Σ ν ΔG0
f , 298 - Σ ν
′ ΔG0 f
, 298
ΔG0298
= Σ ν ΔG0
f , 298 - Σ ν
′ ΔG0 f
, 298
расчет
! (для
хим.р-ии)
справочные
данные)
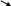
ΔG0298 - стандартная свободная энергия Гиббса соединения.
Стандартная энергия Гиббса образования соединения (ΔG0298) – это изменение энергии Гиббса при реакции образования 1 моль вещества, находящегося в стандартном состоянии из соответствующих простых веществ.
Из этого определения следует, что стандартная энергия образования простого вещества принимается равной нулю, т.е. ΔG0 f , 298 (простых веществ) = 0
ΔG0298 – критерий самопроизвольного протекания химической реакции в стандартных условиях.
Однако, величина ΔG0298 – не может являться критерием направленности процесса при условиях, отличных от стандартны (т.е. при Р = 1 атм, а Т ≠ 2298).
Поэтому в реальных условиях таким критерием является величина ΔG0Т .
При Т = const
ΔG0Т = ΔН0 f , 298 - Т ΔS0 f , 298

изменение
энтро-пии хим.реакции
тепловой
эффект реакции в станд. условиях
- критерий самопроизвольного
протекания процесса при любой заданной
Т
ΔG0Т < 0
Третье начало термодинамики
Многочисленные опыты показывают, что с понижением температуры во всякой системе наблюдается тенденции ко все большей степени упорядоченности. Если бы можно было охладить тело до абсолютного нуля, когда тепловые движения не могут мешать установлению порядка, то в системе установился бы максимальный мыслимый порядок (идеальный кристалл с W=1) и этому состоянию соответствовала бы минимальная энтропия . Если к этому состоянию можно было бы привести идеальный кристалл, то W (термодинамическая вероятность) такого состояния была бы равна 1, а энтропия идеального кристалла при 0 К равнялась 0. Это одна из формулировок третьего начала термодинамики.
Приложение Примеры решения задач
Пример 1. При взаимодействии кристаллов хлорида фосфора с парами воды образуются жидкий POCl3 и хлористый водород. Реакция сопровождается выделением 111,4 кДж теплоты. Напишите термохимическое уравнение этой реакции.
Решение
Записываем уравнение реакции:
РС15(к) + Н2О(г) = РОС13(ж) + 2НС1(г); ΔH =- 111,4 кДж.
Реакция экзотермическая, поэтому ΔH<0.
ΔНр-и = Σ ΔН0298продуктов – Σ ΔН0298исходных веществ.
Выписываем в таблицу стандартные энтальпии образования исходных веществ и продуктов реакции:
Вещество |
PCl5(к) |
H2O(г) |
POCl3(ж) |
HCl(г) |
ΔН0298, кДж/моль |
-445,89 |
-241,81 |
-597,5 |
-92,31 |
ΔHр-и = 2 (-92,31) + (-597,5) − (-241,81) − (-445,89) = -111,4 (кДж).
Ответ: ΔHр-и = -111,4 (кДж). Реакция экзотермическая.
Пример 2. Вычислите стандартную энтальпию реакции
0,5 О2(г) + SО2(r) = SO3(г).
Решение ΔHр-и =ΔH0298 (SO3) −ΔH0298 (SO2)= -396 − (-297) = -99 кДж.
Ответ: ΔHр-и = -99(кДж). Реакция экзотермическая, так как ΔHр-и < 0.
Пример 3. Окисление солей Fe2+в щелочном растворе сопровождается следующими превращениями:
Fe2+(p) +2OH-(p) = Fe(OH)2(к), (1)
Fe(OH)2(к) + 0,25O2(г) +0,5H2O(ж) = Fe(OH)3(к). (2)
Какова энтальпия образования Fe(OH)3(к)?
Решение
С термохимическими уравнениями, как и с химическими, можно производить алгебраические преобразования, например, их можно складывать, или вычитать.
В уравнение (2) подставляем уравнение (1), получаем
Fe2+(p) +2OH-(p) +0,25O2(г) +0,5H2O(ж) = Fe(OH)3(к).
Выписываем в таблицу значения энтальпий образования реагентов:
Вещество |
Fe2+(p) |
OH-(p) |
H2O(ж) |
Fe(OH)3(к) |
ΔН0298, кДж/моль |
-87,2 |
-230,2 |
285,8 |
-826,6 |
Ответ: ΔН0= -826,6 − (-87,2 – 2х230,2 − 0,5·285,8) = -131,5 кДж. Реакция экзотермическая.
Пример 4. Реакция горения этана выражается термохимическим уравнением:
С2Н6(г) + 31/2O2(г) = 2СO2(г) + 3Н2О(ж); ΔH = -1559,87 кДж.
Вычислите стандартную энтальпию образования этана, если известны стандартные энтальпии образования СО2(г) и Н2О(ж).
Решение
1-й способ:
Нужно вычислить тепловой эффект реакции, термохимическое уравнение которой имеет вид
2С(граф) + 3Н2(г) = С2Н6(г); ΔH=?
исходя из следующих данных:
а) С2Н6(г) + 3½O2(г) = 2СO2(г) + 3Н2О(ж); ΔH = -1559,87 кДж;
б) С(граф) +О2 (г) = СО2(г); ΔH= -393,51 кДж;
в) Н2(г) + 1/2О2(г) = Н2О(ж); ΔH = -285,84 кДж.
Для получения искомого результата следует уравнение (б) умножить на 2, уравнение (в) – на 3, а затем сумму этих уравнений вычесть из уравнения (а):
С2Н6 + 3½O2 – 2С – 2O2 – 3Н2 – 3/2О2 = 2СO2 + 3Н2О –2СO2 – 3Н2О;
С2Н6 = 2С+3Н2 реакция разложения С2Н6;
ΔHразл= -1559,87 + 787,02+ 857,52; ΔH = +84,67 кДж.
Так как энтальпия образования равна энтальпии разложения с обратным знаком, то ΔHобрС2Н6(г) = -84,67 кДж.
Ответ: ΔHобрС2Н6(г) = -84,67 кДж.
2-й способ:
Для решения задачи применяем следствие из закона Гесса:
ΔH.р-и= 2 ΔH0298(СО2) + 3ΔH0298(Н2О) – ΔH0298(С2Н6) – 3½ΔH0298О2).
Учитывая, что энтальпии образования простых веществ условно приняты равными нулю
ΔH0298(С2Н6).= 2 ΔH0298(СО2) + 3 ΔH0298(Н2О) − ΔHр-и;
ΔH0298(С2Н6) = 2(-393,51) + 3(-285,84) + 1559,87 = -84,67 (кДж).
Пример 5. Реакция горения этилового спирта выражается термохимическим уравнением:
С2Н5ОН(ж) + 3О2(г) = 2СО2(г) + 3Н2О(ж); ΔH = ?
Вычислите тепловой эффект реакции, если известно, что энтальпия парообразования С2Н5ОН(ж) равна +42,36 кДж и известны энтальпии образования С2Н5ОН(г), СО2(г); Н2О(ж).
Решение
Для определения ΔH реакции необходимо знать энтальпию образования С2Н5ОН(ж). Последнюю находим из данных задачи:
С2Н5ОН(ж) = С2Н5ОН(г); ΔH = +42,36 кДж;
+42,36 = -235,31 – ΔH (С2Н5ОН(ж));
ΔH (С2Н5ОН(ж)) = -235,31 – 42,36 = -277,67 кДж.
Пример 6. Растворение моля безводной соды Na2CO3 в достаточно большом количестве воды сопровождается выделением 25,10 кДж теплоты, тогда как при растворении кристаллогидрата Na2CO3·10Н2О поглощается 66,94 кДж теплоты. Вычислите энтальпию гидратации Na2CO3 (энтальпию образования кристаллогидрата).
Решение: составляем термохимические уравнения соответствующих реакций:
а) Na2CO3 + aq = Na2CO3aq, ΔH = -25,10 кДж;
б) Na2CO3·10Н2О + aq = Na2CO3 aq, ΔH = +66,94 кДж.
Вычитая уравнение (б) из уравнения (а) (см. пример 2), получаем
Na2CO3 + 10Н2О = Na2CO3·10Н2О; ΔH = -92,04 кДж,
т. е. при образовании Na2CO3 · 10Н2О выделяется 92,04 кДж теплоты.
Пример 7. Расчет изменений внутренней энергии системы.
Рассчитайте изменение внутренней энергии системы в стандартных условиях (ΔU°) при протекании реакции
2Cl2 + 2H2O(г) → 4HCl(г) + O2,
если стандартные энтальпии образования H2O и хлороводорода (HCl) соответственно равны -241,84 и 92,3 кДж/моль.
Решение: изменение внутренней энергии рассчитывается по формуле ΔU=ΔH − A, для газов A (работа расширения) = ΔnRT →ΔU = ΔH − ΔnRT,
где Δn − изменение числа моль газообразных продуктов реакции и исходных веществ. Для данной реакции Δn= 5−4 = 1 моль.
Рассчитаем ΔH° реакции, используя следствие из закона Гесса:
ΔH° реакции = 4ΔH(HCl) − 2ΔH(H2О) = 4(-92,3) − 2(-241,84)=114,48 кДж/моль, где R – газовая постоянная, равна 8,3∙10-3кДж/моль∙К; Т = 298 К (25 °С).
Рассчитываем изменение внутренней энергии
ΔU° = 114,48 – 1∙8,3∙10-3∙298 = 112,0 кДж/моль.
Следовательно, в процессе реакции внутренняя энергия увеличилась на 112 кДж/моль.
Пример 8
Смесь сульфидных минералов в сернокислой среде окисляют кислородом воздуха. Рассчитайте стандартную энергию Гиббса реакции
0,5O2(г)+ 2H+ + SO42-+PbS(к)=PbSO4(к) + Н2O(ж);
ΔGо298, кДж/моль, -745 -98,8 -813,8 -237,2
и укажите, будет ли в стандартных условиях галенит PbS окисляться до англезита PbSO4?
Решение
ΔGр-и = (-813,8 ̶ 237,2) − (-74 5 ̶ 98,8) = -207,2 кДж.
Данная реакция при стандартных условиях будет протекать самопроизвольно, так как ΔGр-и< 0.
Эти расчеты можно произвести по формуле ΔG = ΔН – TΔS, если отсутствуют данные значений свободной энергии для каких-либо компонентов реакции. При таких расчетах необходимо учитывать размерность стандартных величин энтальпии (кДж/моль) и энтропии (Дж/моль К). Кроме того, знание величин ΔН и ΔS необходимо при расчетах ΔGр-и при различных температурах.
Пример 9
Возможна ли реакция восстановления Fe2О3 углеродом при температурах 500 и 1000 К?
Fe2О3(к) + 3C(к)=2Fe(к)+3CO(г); ∆Hр-и=490,54 кДж.
Решение
Стандартная энтропия реакции ∆Sr0
∆Sр-и =3 S0 (CO) ̶ 2S0(Fe) ̶ S0 (Fe2О3) ̶ 3S0 (C) = 3·197,91 + 2·27,2 ̶ 89,96 ̶
− 3·5,69 = 541 Дж/(К∙моль).
Энергия Гиббса при 500 и 1000 К:
∆G°500 = ∆Hр-и0 – Т∙∆S0= 490,54 – 500· 0,541 = +219,99 кДж;
∆G°1000 = 490,54 – 1000· 0,541 = -50,56 кДж.
Ответ: восстановление возможно при 1000 К (∆G°1000<0) и невозможно при 500 К (∆G°500 >0).
Пример 10
Восстановление Fe2O3 водородом протекает по уравнению
Fe2O3(к) + ЗН2(г) = 2 Fe(к) + 3Н2О(г); ΔН = + 96,61 кДж.
Возможна ли эта реакция при стандартных условиях, если изменение энтропии ΔS = 0,1387 кДж/(моль·град)? При какой температуре начнется восстановление Fe2O3?
Решение
Вычисляем ΔG0 реакции ΔG =ΔН – ТΔS = 96,61 – 298·0,1387 = +55,28 кДж. Так как ΔG>0, то реакция при стандартных условиях невозможна; наоборот, при этих условиях идет обратная реакция окисления железа (коррозия). Найдем температуру, при которой ΔG = 0
ΔН=96,61 кДж;
ΔН = ТΔS; Т = ΔН/ΔS = 96,61/0,1387 = 696,5 К.
Следовательно, при температуре 696,5 К начнется реакция восстановления Fe2O3. Иногда эту температуру называют температурой начала реакции.
