
- •ПРЕДИСЛОВИЕ
- •ОБЩИЕ РЕКОМЕНДАЦИИ СТУДЕНТАМ
- •КРАТКИЕ СВЕДЕНИЯ ИЗ МАТЕМАТИКИ
- •УЧЕБНЫЕ МАТЕРИАЛЫ ПО РАЗДЕЛАМ КУРСА ФИЗИКИ
- •МЕХАНИКА
- •ЭЛЕКТРИЧЕСТВО
- •МАГНЕТИЗМ
- •КОЛЕБАНИЯ И ВОЛНЫ
- •ВОЛНОВАЯ ОПТИКА
- •МОЛЕКУЛЯРНАЯ ФИЗИКА И ТЕРМОДИНАМИКА
- •КВАНТОВАЯ ФИЗИКА
- •ЯДЕРНАЯ ФИЗИКА
- •ОТВЕТЫ К ЗАДАНИЯМ ДЛЯ САМОСТОЯТЕЛЬНОГО ВЫПОЛНЕНИЯ

6. МОЛЕКУЛЯРНАЯ ФИЗИКА И ТЕРМОДИНАМИКА
Основные формулы и определения
● Скорость каждой молекулы идеального газа представляет собой случайную величину. Функция плотности вероятности случайной величины имеет вид:
f(v) = dN / (N · dv),
где dN / (N · dv) – доля молекул, скорости которых заключены в интервале скоростей от v до (v + dv) в расчете на единицу этого интервала. Площадь, ограниченная графиком функции распределения f(v) и осью абсцисс, численно равна единице, так как функция распределения удовлетворяет условию нормировки.
● Для молекул идеального газа функция плотности вероятности молекул по скоростям (распределение Максвелла) представляет собой кривую с максимумом. Максимум функции распределения приходится на значение скорости, называемой наиболее вероятной, которая равна:
vвер = 












 2kT / m ,
2kT / m ,
где k – постоянная Больцмана; Т – абсолютная (или термодинамическая) температура; m – масса молекулы. Эту формулу можно записать в другом виде:
vвер = |
|
|
|
2RT / μ |
, |
|
|
||||
где R – |
газовая постоянная; µ – молярная масса. |
||||
● Числом степеней свободы называется число независимых координат, полностью определяющих положение системы (молекулы или атома) в пространстве. Полное число степеней свободы складывается из числа степеней свободы поступательного, вращательного и удвоенного числа степеней свободы колебательного движения:
i = iпост + iвращ + 2iколеб.
Для одноатомной молекулы i = iпост = 3. Для многоатомной молекулы, если не учитывать колебательное движение, то полное число степеней свободы
равно: i = iпост + iвращ = 3 + 3 = 6. Для двухатомной молекулы, если не учитывать колебательное движение, то i = iпост + iвращ = 3 + 2 = 5, так как вращением относительно оси, проходящей через центры тяжести двух молекул,
пренебрегают.
● Уравнение состояния идеального газа (уравнение Менделеева – Клапейрона) имеет вид:
p V = ν RT,
где p – давление; V – объем; T – термодинамическая температура; ν – количество вещества; R = 8,31 Дж/(моль·К) – газовая постоянная.
● Изобарным называется процесс, протекающий при постоянном давлении (p = const), изохорным – при постоянном объёме (V = const), изотермическим – при постоянной температуре (T = const), адиабатным называется процесс, протекающий без теплообмена с окружающей средой (Q = 0).

● Согласно первому началу термодинамики, количество теплоты, подводимое к системе, затрачивается на изменение внутренней энергии системы и работу, совершаемую системой против внешних сил:
Q = ∆U + A.
● Изменение внутренней энергии идеального газа равно:
∆U = (i/2) ν R ∆T,
где i – число степеней свободы; ∆T – изменение температуры.
● Работа, совершаемая системой против внешних сил, при изобарном процессе равна произведению давления на изменение объёма:
А = р ∆V.
При изохорном процессе А = 0, так как ∆V = 0 при V = const.
Работа, совершаемая за цикл, численно равна площади замкнутой фигуры, изображаемой на (р, V)-диаграмме.
●Молярная теплоемкость при постоянном объёме равна: Сv = (i/2) R. Молярная теплоёмкость при постоянном давлении равна: Сp = (i + 2) R/2.
●Изменение энтропии равно отношению теплоты, полученной или отданной телом, к абсолютной температуре тела:
S= Q/T.
●Любой тепловой двигатель работает по замкнутому циклу. Коэффициент
полезного действия тепловой машины равен: η = A/Q1, где A – полезная работа, совершенная за цикл; Q1 – теплота, полученная от нагревателя при температуре нагревателя Т1. Коэффициент полезного действия цикла Карно вычисляется по формуле: η = (Т1 – Т2)/Т1, где Т2 – температура холодильника.
Тест 6-1
На рис. 103 представлен график функции распределения молекул идеального газа по скоростям (распределение Максвелла), где f(v) = dN / (N · dv)
– доля молекул, скорости которых заключены в интервале скоростей от v до (v + dv) в расчете на единицу этого интервала. Верным утверждением
является...
Варианты ответов:
1) Площадь заштрихованной полоски с ростом температуры будет уменьшаться;
2) С ростом температуры максимум кривой смещается влево;
3) С ростом температуры площадь под кривой растет.
Решение
Рис. 103 Начнём с анализа третьего утверждения. Площадь, ограниченная графиком функции распределения f(v) и осью абсцисс, численно равна единице,
так как функция распределения удовлетворяет условию нормировки.

Следовательно, с изменением температуры площадь остается постоянной, поэтому третье утверждение является неверным.
Проанализируем второе утверждение. Максимум функции распределения приходится на значение скорости, называемой наиболее вероятной, которая
равна: vвер = 















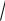 2kT / m , где k – постоянная Больцмана; Т – абсолютная
2kT / m , где k – постоянная Больцмана; Т – абсолютная
температура; m – масса молекулы. Из этой формулы следует, что с ростом температуры максимум кривой смещается вправо, а не влево. Поэтому второе утверждение также неверно.
Рассмотрим первое утверждение. Площадь заштрихованной полоски приблизительно равна площади параллелограмма, которая равна произведению основания на высоту, т. е. f(v) · dv. Но значение f(v) уменьшается с ростом температуры, так как эта функция удовлетворяет условию нормировки, а значение dv остаётся неизменным, поэтому их произведение уменьшается, и площадь заштрихованной полоски с ростом температуры будет уменьшаться. Следовательно, утверждение 1 является верным.
Ответ: вариант 1.
Тест 6-2
На рис. 103 представлен график функции распределения молекул идеального газа по скоростям (распределение Максвелла), где f(v) = dN / (N · dv) – доля молекул, скорости которых заключены в интервале скоростей от v до (v + dv) в расчете на единицу этого интервала.
Если, не меняя температуры и числа молекул, взять другой газ с большей молярной массой, то...
Варианты ответов:
1)Площадь под кривой увеличится;
2)Максимум кривой сместится вправо в сторону больших скоростей;
3)Максимум кривой сместится влево в сторону меньших скоростей.
Решение
Начнём с анализа первого утверждения. Площадь, ограниченная графиком функции распределения f(v) и осью абсцисс, численно равна единице, так как функция распределения удовлетворяет условию нормировки. Следовательно, с изменением массы молекулы площадь остается постоянной, поэтому первое утверждение является неверным.
Рассмотрим два других утверждения. Максимум функции распределения приходится на значение скорости, называемой наиболее вероятной. Наиболее
вероятная скорость равна: vвер = |
|
|
|
2kT / m , где k – постоянная |
|
||||
|
|
Больцмана; Т – абсолютная (или термодинамическая) температура; m – масса молекулы. Эту формулу можно записать в другом виде: vвер = 
 2RT / μ , где R –
2RT / μ , где R –
газовая постоянная; µ – молярная масса. Из этой формулы следует, что с ростом молярной массы максимум кривой смещается влево, а не вправо. Поэтому
второе утверждение также неверно. Следовательно, верным является третье утверждение.
Ответ: вариант 3.
Задание С6-1 для самостоятельного решения
На рис. 103 представлен график функции распределения молекул идеального газа по скоростям (распределение Максвелла), где f(v) = dN / (N · dv)
– доля молекул, скорости которых заключены в интервале скоростей от v до (v + dv) в расчете на единицу этого интервала. Для этой функции верным утверждением является...
Варианты ответов:
1)При понижении температуры максимум кривой смещается влево;
2)При понижении температуры величина максимума уменьшается;
3)При понижении температуры площадь под кривой уменьшается.
Задание С6-2 для самостоятельного решения
На рис. 103 представлен график функции распределения молекул идеального газа по скоростям (распределение Максвелла), где f(v) = dN / (N · dv)
– доля молекул, скорости которых заключены в интервале скоростей от v до (v + dv) в расчете на единицу этого интервала. Для этой функции верным утверждением является...
Варианты ответов:
1)С ростом температуры площадь кривой изменяется;
2)При понижении температуры величина максимума уменьшается;
3)Положение максимума зависит от природы газа (массы молекул).
Задание С6-3 для самостоятельного решения
Для функции распределения Максвелла верным утверждением является...
Варианты ответов:
1)При понижении температуры величина максимума растет;
2)При изменении температуры площадь под кривой изменяется;
3)При любом изменении температуры положение максимума не меняется.
Задание С6-4 для самостоятельного решения
На рис. 103 представлен график функции распределения молекул идеального газа по скоростям (распределение Максвелла), где f(v) = dN / (N · dv) – доля молекул, скорости которых заключены в интервале скоростей от v до (v + dv) в расчете на единицу этого интервала.
Если, не меняя температуры и числа молекул, взять другой газ с меньшей молярной массой, то для этой функции верным утверждением является...
Варианты ответов:
1)Максимум кривой сместится влево в сторону меньших скоростей;
2)Максимум кривой сместится вправо в сторону больших скоростей;
3)Площадь под кривой уменьшится.

Тест 6-3
В трех одинаковых с осудах при равных условиях находится одинаковое
количество водорода H2, ге лия He и азота N2 (рис. 104).
Рис. 104
Распределение скоростей молекул водорода будет описывать кривая (рис. 105)...
Варианты ответов:
1) кривая 1; 2) кривая 2;
3) кривая 3.
Решение |
|
|
|
|
Функция |
распределения |
|
||
молекул |
по |
скоростям |
|
|
представляет |
собой |
кривую |
с |
|
максимумом. |
|
|
|
|
Максимум |
|
функции |
Рис. 105 |
|
распределения |
приходится |
на |
||
значение скорости, называемой
наиболее вероятной, которая равна: vвер = 2kT / m , где k – |
постоянная |
Больцмана; Т – абсолютная (или термодинамическая) темпе ратура; |
m – масса |
молекулы. Из этой формулы следует, что с ростом тем пературы или с уменьшением массы молекулы максимум кривой смещается в право. Поскольку молекула водорода обладает наименьшей массой, то при одинаковых температурах максимум функции распределения имеет наибольшее (из трех графиков) смещение вправо. Следовательно, распределение скоростей молекул
водорода будет описывать кривая 3.
Ответ: вариант 3.
Задание С6-5 для са мостоятельного решения
В трех одинаковых с осудах при равных условиях находится одинаковое
количество водорода Н2, ге лия Не и азота N2.
Распределение скоростей молекул азота (см. рис. 105) будет описывать
кривая…
Варианты ответов:
1) кривая 1; 2) кривая 2; 3) кривая 3.
Задание С6-6 для са мостоятельного решения
В трех одинаковых с осудах при равных условиях находится одинаковое
количество водорода Н2, ге лия Не и азота N2.

Распределение скоростей молекул гелия (см. рис. 105) будет описывать
кривая…
Варианты ответов: |
|
|
|
|
|
1) кривая 1; 2) кривая 2; |
3) кривая 3. |
|
|
|
|
Тест 6-4 |
|
|
|
|
|
f(Vx) |
В |
трех |
одинаковых сосудах |
при |
|
равных условиях нах одится одинаковое |
|||||
|
|||||
|
количество водорода H2, гелия He и |
||||
|
азота |
N2. |
Распреде ление проекций |
||
|
скоростей |
молекул водорода |
на |
||
|
произвольное направление X будет |
||||
|
описывать кривая (рис. 106)... |
|
|||
|
Варианты ответов: |
|
|||
|
1) кривая 3; 2) кривая 2; |
|
|||
|
3) кривая 1. |
|
|||
|
Vx |
|
|
|
|
Рис. 106 |
Решение |
|
|||
Распределение проек ций скоростей молекул на произвольное направление
X будет описывать функция f(vx) = 
 m /(2πkT )
m /(2πkT )  exp(– m vx2/(2kТ)),
exp(– m vx2/(2kТ)),
где число exp = е = 2,71… называется экспонентой, а в скобка х стоит показатель
степени экспоненты.
При значении скорости vx = 0 функция распределения имеет максимум,
значение которого равно: f(0) =  , где k – постоянная Больцмана; Т –
, где k – постоянная Больцмана; Т –
абсолютная (или термодинамическая) температура; m – масса молекулы.
Из этой формулы следует, что значение f(vx = 0) тем бо льше, чем больше масса молекулы и мень ше температура газа. Так как по условию задачи одинаковое число молекул находится в трёх сосудах в одинаковых условиях, то при одинаковых температурах, чем меньше масса молеку лы, тем меньше максимальное значение функции f(vx). Массу молекулы мо жно определить с
помощью |
таблицы |
Мен делеева. Масса молекулы, |
измеренная |
в |
атомных |
||
единицах |
массы, |
для |
водорода (H2) равна |
m = 2 а.е.м., для |
гелия (Не) |
||
m = 4 а.е.м., для азота |
(N 2) m = 14 · 2 = 28 а.е.м. |
Так |
как молекула |
водорода |
|||
обладает наименьшей мас сой, то распределение проекций скоростей молекул водорода на произвольное направление x будет описывать кривая 3.
Ответ: вариант 1.
Тест 6-5
В трех одинаковых сосудах находится одинаковое количество газа, причем,
Т1 > Т2 > Т3 (рис. 107).
Рис. 107

Распределение проекций скоростей молекул водорода на произвольное направление X для молекул в сосуде с температурой T1 будет описывать (рис.
108)…
Варианты ответов: |
|
1) кривая 2; |
2) кривая 3; |
3) кривая 1. |
|
|
Решение |
|
|
|
|
|
|||
f(Vx) |
Распределение |
|
|
проекций |
скоростей |
||||
|
молекул на произвольное направление x |
||||||||
|
будет |
описывать |
функция |
||||||
|
f(vx) = |
|
|
|
· exp(– m vx2/(2kТ)). |
|
|||
|
m /(2π kT ) |
|
При |
||||||
|
значении |
скорости |
vx = 0 |
функция |
|||||
|
распределения имеет максимум, значение |
||||||||
|
которого равно f(0) = , где k – |
постоянная |
|||||||
|
Больцмана; |
Т |
– |
|
абсолютная |
(или |
|||
Vx |
термодинамическая) |
температура; m – масса |
|||||||
молекулы. |
Из этой |
|
формулы |
следует, |
что |
||||
Рис. 108 |
f(vx = 0) будет тем больше, чем больше масса |
||||||||
|
молекулы и меньше температура газа. Так |
||||||||
как по условию задачи одинаковое число молекул водорода находится в трёх |
|||||||||
сосудах при различных температурах, то чем больше температура газа, |
тем |
||||||||
меньше максимальное значение функции f(vx). Следовательно, распределение проекций скоростей молекул водорода на произвольное направление X при наибольшей температуре Т1 будет описывать кривая 3.
Ответ: вариант 2.
Тест 6-6
Средняя кинетическая энергия молекулы идеального газа при температуре
T равна ‹ε› = (i/2)kT. Здесь i = iпост + iвращ + 2iколеб, где iпост, iвращ, iколеб – число
степеней свободы поступательного, вращательного и колебательного движений молекулы. При условии, что имеют место только поступательное и вращательное движение, для водяного пара (Н2О) число i равно...
Варианты ответов:
1) 7; |
2) 5; |
3) 6; |
4) 2. |
Решение
Числом степеней свободы называется число независимых координат, полностью определяющих положение системы (молекулы или атома) в пространстве.
Для определения положения центра тяжести молекулы в пространстве нужно задать три координаты: x, y, z. Поэтому число степеней свободы поступательного движения iпост = 3. Заметим, что одноатомную молекулу можно считать материальной точкой, поэтому для такой молекулы i = 3.
Для определения положения многоатомной молекулы в пространстве при её вращательном движении тоже нужно задать 3 числа, так как вращение происходит относительно трёх осей координат, поэтому число степеней свободы вращательного движения iвращ = 3. Однако, если молекула состоит из двух атомов, то вращением относительно оси, проходящей через центры тяжести двух молекул, пренебрегают, поэтому двухатомная молекула имеет 2 степени свободы вращательного движения.
Если не учитывать колебательное движение, то величина i представляет собой сумму числа степеней свободы поступательного и вращательного
движения молекулы: i = iпост + iвращ.
Молекула водяного пара (Н2О) состоит из трёх атомов, поэтому она имеет три степени свободы поступательного движения (iпост = 3) и три степени свободы вращательного движения (iвращ = 3). Полное число степеней свободы i =
iпост + iвращ = 3 + 3 = 6.
Ответ: вариант 3.
Задание С6-7 для самостоятельного решения
Средняя кинетическая энергия молекулы идеального газа при температуре
T равна ‹ε› = (i/2)kT. Здесь i = iпост + iвращ + 2iколеб, где iпост, iвращ, iколеб – число
степеней свободы поступательного, вращательного и колебательного движений молекулы. При условии, что имеют место только поступательное и вращательное движение, для молекулы водорода (Н2) число i равно...
Варианты ответов:
1) 7; |
2) 5; |
3) 6; |
4) 2. |
Задание С6-8 для самостоятельного решения
Средняя кинетическая энергия молекулы идеального газа при температуре
T равна ‹ε› = (i/2) kT. Здесь i = iпост + iвращ + 2iколеб, где iпост, iвращ, iколеб – число
степеней свободы поступательного, вращательного и колебательного движений молекулы. Для атомарного водорода (Н) число i равно...
Варианты ответов:
1) 7; |
2) 1; |
3) 5; |
4) 3. |
Задание С6-9 для самостоятельного решения
Средняя кинетическая энергия молекулы идеального газа при температуре
T равна ‹ε› = (i/2)kT. Здесь i = iпост + iвращ + 2iколеб, где iпост, iвращ, iколеб – число
степеней свободы поступательного, вращательного и колебательного движений молекулы. Для гелия (Не) число i равно...
Варианты ответов:
1) 7; |
2) 1; |
3) 5; |
4) 3. |
Тест 6-7
Средняя кинетическая энергия молекул газа при температуре Т зависит от их структуры, что связано с возможностью различных видов движения атомов в молекуле. Средняя кинетическая энергия молекул гелия (Не) равна...
Варианты ответов:
1) 7kT/2; 2) 5kT/2; 3) kT/2; 4) 3kT/2.
Решение
Средняя кинетическая энергия молекулы равна: ‹ε› = (i/2)kT, где i – число степеней свободы; k – постоянная Больцмана; T – абсолютная (или термодинамическая) температура. Величина i представляет собой сумму числа степеней свободы поступательного, вращательного и удвоенного числа степеней свободы колебательного движения молекулы: i = iпост + iвращ + 2iколеб. Молекула гелия состоит из одного атома, поэтому она имеет три степени свободы поступательного движения (i = 3), и средняя кинетическая энергия молекулы гелия равна: ‹ε› = 3 kT/2.
Ответ: вариант 4.
Тест 6-8
Средняя кинетическая энергия молекул газа при температуре Т зависит от их структуры, что связано с возможностью различных видов движения атомов в молекуле. При условии, что имеют место только поступательное и вращательное движение, средняя энергия молекул водяного пара (Н2О) равна...
Варианты ответов:
1) 3kT/2; 2) 3kT; 3) 7kT/2; 4) 5kT/2.
Решение
Средняя кинетическая энергия молекулы равна: ‹ε› = (i/2)kT, где i – полное число степеней свободы; k – постоянная Больцмана; T – абсолютная (или термодинамическая) температура. Величина i представляет собой сумму числа степеней свободы поступательного и вращательного движения молекулы:
i = iпост + iвращ.
Молекула водяного пара (Н2О) состоит из трёх атомов, поэтому она имеет три степени свободы поступательного движения (iпост = 3) и три степени свободы вращательного движения (iвращ = 3). Полное число степеней свободы i = iпост + iвращ = 3 + 3 = 6. Поэтому средняя кинетическая энергия молекулы воды равна: ‹ε› = (6/2) kT = 3kT.
Ответ: вариант 2.
Задание С6-10 для самостоятельного решения
Средняя кинетическая энергия молекул газа при температуре Т зависит от их структуры, что связано с возможностью различных видов движения атомов в молекуле. При условии, что имеют место только поступательное и вращательное движение, средняя энергия молекул азота (N2) равна...
Варианты ответов:
1) 5kT/2; 2) 3kT/2; 3) 7kT/2; 4) kT/2.

Тест 6-9 |
|
|
|
|
|
|
Состояние |
идеального газа определяется значениями параметров: |
|||||
pV = ν RT, где Т – |
термодинамическая температура; р – давление; V – объем газа. |
|||||
Определенное |
количество |
газа |
перевели |
из |
состояния |
(p0,V0) |
в состояние (2p0, V0). При этом его внутренняя энергия...
Варианты ответов:
1) уменьшилась; 2) не изменилась; 3) увеличилась.
Решение
Внутренняя энергия идеального газа равна: U = (i/2)ν RT, где i – число степеней свободы; ν – количество вещества; R = 8,31 Дж/(моль · К) – газовая постоянная. Из уравнения Менделеева – Клапейрона следует: pV = ν RT. Тогда
U = (i/2) pV. Отсюда следует: U1 = (i/2) p0V0 и U2 = (i/2) 2p0V0. Таким образом, U2 > U1, т. е. внутренняя энергия увеличилась.
Ответ: вариант 3.
Задание С6-11 для самостоятельного решения
Внутренняя энергия одного моля двухатомного газа при повышении температуры в 2 раза…
Варианты ответов:
1) увеличится в 2 раза; 2) уменьшится в 2 раза; 3) не изменится.
Тест 6-10
Молярные теплоемкости гелия в процессах 1 – 2 и 1 – 3 равны C1 и С2 соответственно (рис. 109). Тогда C1/C2 составляет...
Варианты ответов:
1) 5/7; |
2) 3/5; |
3) 5/3; |
4) 7/5. |
Решение
Процесс 1 – 2 происходит при постоянном объёме. Молярная теплоемкость при постоянном объёме равна Рис. 109 С1 = (i/2)R. Процесс 1 – 3 происходит при постоянном давлении. Молярная теплоёмкость при постоянном
давлении равна С2 = (i + 2)R/2. Отношение С1/С2 = i/(i + 2). Так как гелий – это одноатомный газ, то для него i = 3. Тогда С1/С2 = 3/(3 + 2) = 3/5.
Ответ: вариант 2.
Задание С6-12 для самостоятельного решения
Состояние идеального газа изменяется в соответствии с рис. 109. Отношение молярной теплоёмкости кислорода (О2) при постоянном давлении С2 к молярной теплоёмкости при постоянном объёме С1 равно…
Варианты ответов:
1) 5/7; |
2) 4/3; |
3) 5/3; |
4) 7/5. |

Тест 6-11
В соответствии с первым началом термодинамики для процесса в идеальном газе, график которого представлен на рис. 110, справедливо соотношение…
Варианты ответов: |
|
1) Q > 0; ∆U > 0; A = 0; |
2) Q < 0; ∆U < 0; A = 0; |
3) Q < 0; ∆U > 0; A = 0; |
4) Q > 0; ∆U < 0; A = 0. |
|
Рис. 110 |
Решение
Согласно первому началу термодинамики, количество теплоты, подводимое к системе, затрачивается на изменение внутренней энергии системы и работу, совершаемую системой против внешних сил: Q = ∆U + A.
Изменение внутренней энергии идеального газа равно: ∆U = (i/2)νR∆T, где i –
число степеней свободы; T – термодинамическая температура; |
ν – |
количество |
||
вещества; R = 8,31 Дж/(моль·К) – газовая постоянная. |
|
|
|
|
Работа, совершаемая |
системой против внешних |
сил |
при |
изобарном |
(р = const) процессе равна |
произведению давления на |
изменение объёма: |
||
А = р ∆V, а при изохорном (V = const) процессе работа равна нулю.
Из графика на рис. 110 видно, что объём остаётся постоянным, т. е. процесс изохорный (V = const и ∆V = 0), поэтому А = 0. Из графика также следует, что температура увеличивается, т. е. система нагревается и изменение температуры ∆T > 0, поэтому ∆U > 0. Если температура системы увеличивается, то это значит, что система получает тепло и Q > 0. Следовательно, в соответствии с первым началом термодинамики для процесса в идеальном газе, график которого представлен на рис. 110, справедливо соотношение: Q > 0,
∆U > 0, А = 0.
Ответ: вариант 1.
Тест 6-12
Если ∆U – изменение внутренней энергии идеального газа; А – работа газа; Q – количество теплоты, сообщаемое газу, то для адиабатного расширения газа справедливы соотношения...
Варианты ответов:
1) Q > 0; A > 0; ∆U = 0; 3) Q = 0; A < 0; ∆U > 0;
2) Q < 0; A < 0; ∆U = 0. 4) Q = 0; A > 0; ∆U < 0.
Решение
Согласно первому началу термодинамики, количество теплоты, подводимое к системе, затрачивается на изменение внутренней энергии системы и работу, совершаемую системой против внешних сил: Q = ∆U + A. При адиабатном процессе количество теплоты, подводимое к системе, равно нулю: Q = 0, поэтому ∆U + A = 0.
Так как при расширении работа положительна, т. е. A > 0, то ∆U < 0, что соответствует варианту 4.
Ответ: вариант 4.

Задание С6-13 для са мостоятельного решения
Если ∆U – изменение внутренней энергии идеального газа; А – работа газа; Q – количество теплоты, сообщаемое газу, то для изотермического расширения газа справедливы соотношения...
Варианты ответов:
1)Q > 0; А > 0; ∆U = 0;
2)Q < 0; A < 0; ∆U = 0;
3)Q = 0; А < 0; ∆U > 0;
4)Q > 0; А > 0; ∆U < 0.
Задание С6-14 для са мостоятельного решения
Если ∆U – изменение внутренней энергии идеального газа; А – работа газа; Q – количество теплоты, сообщаемое газу, то для изобарного нагревания газа справедливы соотношения...
Варианты ответов:
1) Q > 0; А > 0; ∆U > 0; 3) Q = 0; А < 0; ∆U > 0;
2)Q < 0; A = 0; ∆U < 0;
4)Q > 0; А > 0; ∆U = 0.
Тест 6-13
На (p, V)-диаграмме изображены два циклических процесса (рис. 111). Отношение работ, совершенных в каждом цикле АІ/АІІ, равно…
Рис. 111
Варианты ответов:
1) –1/2; 2) –2; 3) 1/2; 4) 2.
Решение
Работа, совершенная за цикл, численно равна площади замкнутой фигуры, изображенной на (р, V)-диаграмме. Площадь можно подсч итать в условных единицах как число клеток. Тогда отношение работ, совер енных в каждом цикле, равно отношению числа клеток. Причем работа, совершенная за цикл, будет положительной, если обход совершается по часовой стрелке, и отрицательной, если обход совершается против часовой стрелки. В нашем примере обход совершае ся по часовой стрелке, поэтому АI > 0 и A II > 0. Отношение работ, соверш нных в каждом цикле, равно: АI/A II = 3/6 = 1/2.
Ответ: вариант 3.

Задание С6-15 для са мостоятельного решения
На (p, V)-диаграмме ( рис. 112) изображены два циклических процесса.
Рис. 112
Отношение работ, совершенных в каждом цикле АІ/АІІ, равно…
Варианты ответов:
1) –1/2; 2) –2; 3) 1/2; 4) 2.
Тест 6-14
Тепловая машина работает по циклу Карно. Если температуру нагревателя увеличить, то КПД цикла…
Варианты ответов:
1) увеличится; 2) уменьшится; 3) не изменится.
Решение
Коэффициент полезного действия (КПД) цикла Карно вычисляется по
формуле: η = (Т1 – Т2)/Т1, где Т1 – температура нагревателя; Т2 – температура
холодильника. Иначе, КПД равен: η = (1 – Т2/Т1). Отсюда следует, что при повышении температуры нагревателя Т1 отношение Т2/ Т1 уменьшается,
разность (1 – Т2/Т1) увеличивается, т. е. КПД увеличивается. Ответ: вариант 1.
Тест 6-15
Процесс, изображенный на рис. 113 в координатах (T, S), где S – энтропия, является...
Варианты ответов:
1)Изобарным сжатием;
2)Изохорным охлаждением;
3)Адиабатным расширением;
4)Изотермическим сжатием.
Рис. 113
Решение
Изобарным называется процесс, протекающий при пос тоянном давлении (p = const), изохорным – при постоянном объёме (V = const), изотермическим –
при постоянной температуре (T = const), адиабатным называется процесс, протекающий без теплообмена с окружающей средой (Q = 0).
Из термодинамики известно, что отношение теплоты, полученной или отданной телом, к абсолютной температуре тела равно изменению энтропии: S = Q/T. Как видно из рис. 113, энтропия постоянна (S = const), поэтому S = 0 и Q = 0, т. е. рассматривается адиабатный проесс.
Уравнение адиабаты можно записать в виде: Т V γ – 1 = const, где γ – показатель адиабаты, для данного газа являющийся постоянной величиной. Из уравнения адиабаты следует, что при увеличении объёма (т. е. при расширении), температура понижается, а при сжатии – повышается. На рис. 113 изображен адиабатный процесс, связанный с понижением температуры, следовательно, процесс является адиабатным расширением.
Ответ: вариант 3.
Задание С6-16 для самостоятельного решения
Процесс, изображенный на рис. 114 в координатах (T, S), где S – энтропия, является...
Варианты ответов:
1)Изотермическим расширением;
2)Адиабатным сжатием;
3)Изобарным расширением;
4)Изохорным нагреванием.
Тест 6-16
На рис. 115 изображен цикл Карно в координатах (T, S), где S – энтропия. Теплота подводится к системе на участке...
Варианты ответов:
1) 2 – 3; |
2) 1 – 2; |
|
|
|
|
|
3) 4 – 3; |
4) 4 – 1. |
|
|
|
|
|
Решение |
|
|
|
|
|
|
Цикл Карно состоит из двух адиабат (2 – 3 и 4 – |
|
|||||
1) и двух изотерм (1 – 2 и 3 |
– 4). |
При адиабатном |
|
|||
процессе S = const, так как Q = 0, т. е. при процессах |
|
|||||
(2 – 3 и 4 |
– 1) |
тепло не |
подводится. |
Теплота |
|
|
подводится |
при |
изотермическом |
процессе от |
Рис. 115 |
||
нагревателя, температура которого выше, чем |
|
|||||
температура |
холодильника, |
поэтому |
теплота |
|
||
подводится к системе на участке 1 – 2. |
|
|
||||
Ответ: вариант 2. |
|
|
|
|
||
Тест 6-17
На рис. 115 изображен цикл Карно в координатах (T, S), где S – энтропия. Изотермическое сжатие происходит на этапе...
Варианты ответов:
1) 2 – 3; 2) 3 – 4; 3) 1 – 2; 4) 4 – 1.

Решение
Изотермическим называется процесс, протекающий при постоянной
температуре, что соответствует на рис. 115 процессам 1 – 2 |
и 3 – 4. Изменение |
||||
энтропии при |
изотермическом процессе равно: |
S = νR |
ln(V2/V1), где ν – |
||
количество вещества; R – |
газовая постоянная. |
|
|
||
При расширении отношение конечного и начального объёмов газа больше |
|||||
единицы, т. е. |
V2/V1 > 1. |
Тогда логарифм |
натуральный ln(V2/V1) > 0, |
||
следовательно, |
S = S2 – |
S1 > 0, т. е. при изотермическом расширении энтропия |
|||
возрастает (S2 > S1). При сжатии конечный объём меньше начального, V2/V1 < 1, |
|||||
ln(V2/V1) < 0 и |
S2 < S1, |
т. е. |
при изотермическом |
сжатии |
энтропия убывает. |
Следовательно, изотермическое сжатие происходит на этапе 3 – 4. Ответ: вариант 2.
Задание С6-17 для самостоятельного решения
На рис. 115 изображен цикл Карно в координатах (T, S), где S – энтропия. Адиабатное расширение происходит на этапе...
Варианты ответов:
1) 2 – 3; 2) 3 – 4; 3) 1 – 2; 4) 4 – 1.
Тест 6-18
На рис. 116 представлен цикл тепловой машины в координатах Т, S, где Т – термодинамическая температура; S – энтропия. Укажите нагреватели и холодильники с соответствующими температурами.
Варианты ответов:
1) Нагреватели – Т2, T4, T5; холодильники – T1, T3;
2) Нагреватели – Т3, T4, T5; холодильники – T1, T2;
3)Нагреватели – Т4, Т5; холодильники – Т1, Т2, Т3;
4)Нагреватели – Т3, T5; холодильники – T1, T2, T4.
Решение |
|
|
|
|
|
Любой тепловой двигатель работает по |
|
||||
замкнутому циклу. Цикл, изображенный на |
|
||||
рис. 116, состоит из адиабат и изотерм. При |
|
||||
адиабатном процессе теплота не подводится к |
|
||||
системе (Q = 0 и |
S = const). |
При |
|
||
изотермическом процессе |
(Т = const) |
при |
|
||
возрастании энтропии теплота подводится от |
|
||||
нагревателя, при уменьшении энтропии |
|
||||
частично передается холодильнику. Поэтому |
|
||||
теплота |
подводится |
к |
системе |
при |
|
температурах Т5 и Т4, а отдаётся холодильнику |
|
||||
при температурах Т2, Т1 и Т3. Следовательно, Т5 |
|
||||
и Т4 – нагреватели, а Т1, Т2, Т3 |
– холодильники. |
Рис. 116 |
|||
Ответ: вариант 3. |
|
|
|
||
|
|
|
|
||

Тест 6-19
Ha (P, V)-диаграмме (рис. 117) изображен циклический процесс. На участках АВ и ВС температура...
Варианты ответов:
1)Повышается;
2)На ав – повышается, на вс – понижается;
3)Понижается;
4)На ав – понижается, на вс – повышается.
Решение
Рассмотрим уравнение состояния идеального газа: pV = νRT, где ν – количество вещества; R – газовая постоянная; T – термодинамическая
температура. Так как νR = const, то изменение температуры зависит от произведения pV. Если произведение возрастает, то температура возрастает, и наоборот, если произведение pV убывает, то температура понижается. Рассмотрим циклический процесс, изображенный на диаграмме рис. 117. На участке АВ p = const, а V возрастает, значит, температура возрастает. На участке ВС V = const, а p убывает, поэтому температура понижается. Следовательно, на участках АВ – ВС температура: на АВ – повышается, на ВС – понижается, что соответствует варианту ответа 2.
Ответ: вариант 2.
Задание С6-18 для самостоятельного решения
Ha (P,V)-диаграмме (см. рис. 117) изображен циклический процесс. На участках DA и AB температура...
Варианты ответов:
1)Повышается;
2)На da – повышается, на ав – понижается;
3)На da – понижается, на ав – повышается;
4)Понижается.
Тест 6-20
Явление диффузии имеет место при наличии градиента...
Варианты ответов:
1) концентрации; 2) скорости слоев жидкости или газа; 3) температуры; 4) электрического заряда.
Решение
Понятие градиента вводится для неравновесных систем, когда неоднородно распределён какой-либо параметр системы. Например, когда концентрация, температура или другой параметр являются функцией координат. Градиент – это вектор, который показывает, в каком направлении функция изменяется быстрее всего. При наличии градиента в системах возникают необратимые
процессы, называемые явлениями переноса, которые приводят к выравниванию неравновесного параметра. В молекулярной физике к явлениям переноса относятся диффузия, вязкость и теплопроводность.
Явление диффузии обусловлено переносом массы, в результате которого происходит самопроизвольное выравнивание концентрации. Диффузия продолжается, пока существует градиент плотности.
Если система состоит из заряженных частиц, то при наличии градиента плотности возникнет градиент электрического заряда, что приведет, наряду с диффузией, к появлению электрического тока.
Вязкость (или внутреннее трение) обусловлена переносом импульса молекул между слоями жидкости или газа, движущимися с различными скоростями, в результате чего более медленно движущиеся слои ускоряются, а более быстрые – замедляются. Вязкость существует при наличии градиента скорости.
Явление теплопроводности обусловлено переносом энергии молекул, в результате чего происходит выравнивание температуры тела. Явление теплопроводности наблюдается при наличии градиента температуры.
Таким образом, явление диффузии имеет место при наличии градиента концентрации.
Ответ: вариант 1.
Тест 6-21
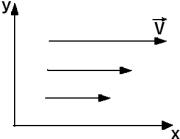
В потоке газа, направленном вдоль оси x, скорость газа растет в положительном направлении оси y. Перенос импульсов направленного движения происходит…
Варианты ответов:
1)В отрицательном направлении оси z;
2)В положительном направлении оси z;
3)В положительном направлении оси y;
4)В отрицательном направлении оси y.
Решение
В потоке жидкости или газа между параллельными слоями вещества,
движущимися с различными скоростями, возникает |
|
внутреннее трение. Внутреннее трение (вязкость) |
|
возникает благодаря тому, что из-за хаотического |
|
теплового движения между слоями жидкости или газа |
|
происходит обмен молекул. При этом импульс слоя, |
|
движущегося быстрее, уменьшается, а движущегося |
|
медленнее – увеличивается. Это приводит к торможению |
|
слоя, движущегося быстрее, и ускорению слоя, |
Рис. 118 |
движущегося медленнее (рис. 118). |
|

Плотность потока импульса равна: jp = – η |
d v |
, где |
d v |
– градиент |
|
dy |
|||
|
dy |
|
||
скорости; η – коэффициент вязкости. Знак «минус» показывает, |
что импульс |
|||
переносится в направлении убывания скорости.
По условию задачи скорость растёт в положительном направлении оси y,
поэтому градиент скорости положителен, т. е. d v > 0. Следовательно, перенос dy
импульса будет происходить в отрицательном направлении оси y. Ответ: вариант 4.
Задание С6-19 для самостоятельного решения
В некотором объёме газа температура неоднородна и растёт в положительном направлении оси x. Перенос тепловой энергии происходит…
Варианты ответов:
1)В отрицательном направлении оси x;
2)В положительном направлении оси x;
3)В положительном направлении оси y;
4)В отрицательном направлении оси y.
Задание С6-20 для самостоятельного решения
В некотором объёме газа плотность неоднородна и растёт в отрицательном направлении оси y. Перенос массы вещества происходит…
Варианты ответов:
1)В отрицательном направлении оси x;
2)В положительном направлении оси x;
3)В положительном направлении оси y;
4)В отрицательном направлении оси y.
