
- •Ферменты
- •История
- •Свойства
- •Классификация
- •Особенности ферментативного катализа
- •Ферментативная реакция
- •Строение ферментов
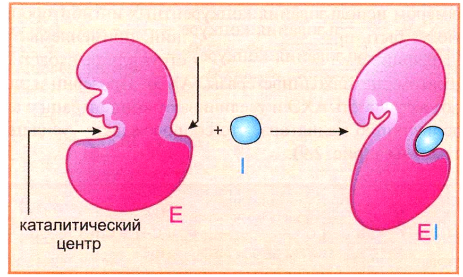
- •Активный центр
- •Номенклатура
- •Классификация
- •З ависимость скорости ферментативной реакции
- •Специфичность ферментов, ее виды
- •Эффекторы
- •1 )Конкурентное ингибирование
- •2)Неконкурентное ингибирование
- •3)Бесконкурентное ингибирование
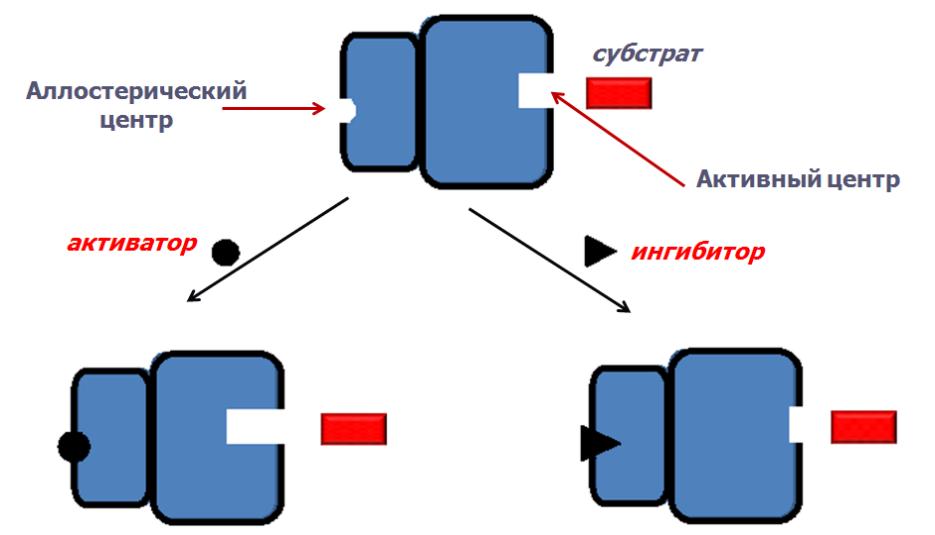
- •Аллостерический центр
- •Регуляция ферментативной активности.
- •Энзимология

Аллостерический центр
6
 )Аллостерическое
ингибирование.
)Аллостерическое
ингибирование.
-ингибиторы связываются с отдельными участками фермента вне активного центра.
-конформационные изменения в молекуле фермента, которые приводят к уменьшению его активности
Регуляция ферментативной активности.
Возможность регулировать активность ферментов в соответствии с потребностями клетки и целостного организма относится к важнейшим свойствам этих веществ. Ферменты должны работать со строго определѐнной активностью и в строго определѐнных направлениях. В регуляции метаболизма принимают участие несколько факторов.
1. Количество фермента в клетке, которое определяется двумя факторами:
скоростью синтеза; скоростью распада.
(два типа ферментов)
конститутивные (ферменты жизнеобеспечения – энергетического обмена, синтеза нуклеиновых кислот, белков, липидов и т.д.)синтезируются с постоянной скоростью и с постоянной скоростью разрушаются;
индуцибельные (адаптивные) – ферменты, обеспечивающие выполнение специфических функций; синтез этих ферментов возрастает при наличии соответствующих стимулов (индукторов). Например, при беременности и после родов в молочной железе индуцируется синтез ф-та лактозосинтазы под действием лактотропного гормона
2. Доступность фермента и субстрата (например, при отсутствии инсулина глюкоза не может проникнуть в клетки, где находятся ферменты еѐ метаболизма).
3. Регуляция активности самого фермента: компонентами самой клетки (температурой, рН, количеством субстрата, компартментализацией ферментов, наличием транспортных систем, наличием эффекторов);
а
 ллостерическая
регуляция;
ллостерическая
регуляция;
-К аллостерическому центру присоединяется не субстрат, а эффектор
-Аллостерические ферменты построены из двух и более субъединиц: одни субъединицы содержат каталитический центр, другие имеют аллостерический центр(регуляторные).
-Присоединение эффектора к аллостерическому центру регуляторной субъединицы изменяет конформацию белка и, соответственно, активность каталитической субъединицы
-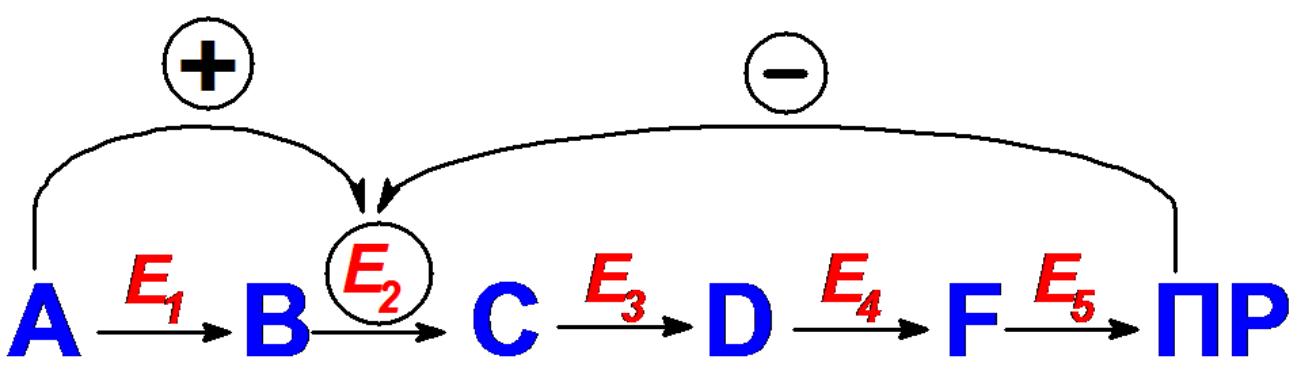 Регуляторы
– исходные вещества и конечные продукты,
а также вещества, участвующие в сопряжѐнных
реакциях, поэтому аллостерическую
регуляцию часто называют саморегуляцией,
Конечные продукты (иногда промежуточные
метаболиты) – ингибиторы, исходные
субстраты – активаторы.
Регуляторы
– исходные вещества и конечные продукты,
а также вещества, участвующие в сопряжѐнных
реакциях, поэтому аллостерическую
регуляцию часто называют саморегуляцией,
Конечные продукты (иногда промежуточные
метаболиты) – ингибиторы, исходные
субстраты – активаторы.
химическая модификация (ковалентная и нековалентная);
Ф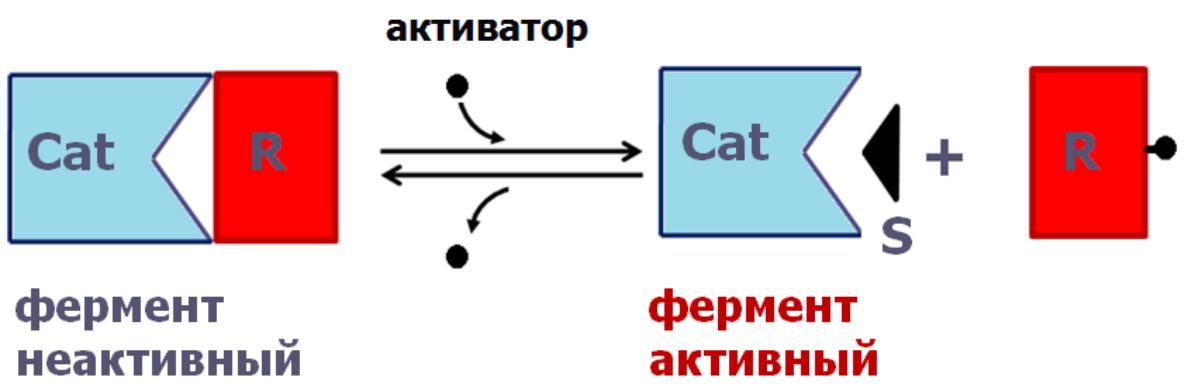
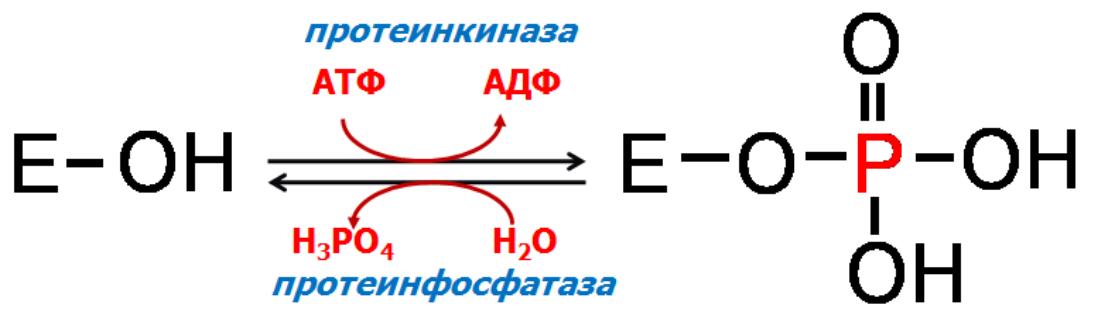 осфорилирование
и дефосфорилирование (ковалентная
модификация) – один из наиболее
распространѐнных способов регуляции
активности ферментов. Такая модификация
заключается в обратимом присоединении
или отщеплении фосфорной кислоты.
Фосфорилирование фермента происходит
по остаткам серина и тирозина. Присоединение
фосфорной кислоты к белку осуществляют
ферменты протеинкиназы,
отщепление – протеинфосфатазы.
осфорилирование
и дефосфорилирование (ковалентная
модификация) – один из наиболее
распространѐнных способов регуляции
активности ферментов. Такая модификация
заключается в обратимом присоединении
или отщеплении фосфорной кислоты.
Фосфорилирование фермента происходит
по остаткам серина и тирозина. Присоединение
фосфорной кислоты к белку осуществляют
ферменты протеинкиназы,
отщепление – протеинфосфатазы.
Ферменты могут быть активны как в фосфорилированном, так и в дефосфорилированном состоянии. Например, при фосфорилировании ферментов, участвующих в обмене гликогена, фермент распада гликогена (гликогенфос-форилаза) находится в активном состоянии, а фермент синтеза гликогена (гликогенсинтаза) – в неактивном. В дефосфорилированном состоянии, наоборот, гликогенфосфорилаза неактивна, а гликогенсинтаза активна. Таким образом противоположно направленные процессы никогда не идут одновременно. Процессы диссоциации-ассоциации и фосфорилирования-дефосфорилирования не происходят спонтанно, а начинаются только при поступлении гормонального сигнала.
частичный протеолиз- отщепление пептида от неактивного предшественника, в результате чего формируется правильная конформация белка-фермента, и он переходит в активное состояние
Кофакторы ферментов: ионы Ме
Алкогольдегидрогеназа, карбоангидраза |
Zn |
Аргиназа, аминопептидаза |
Mn |
Дипептидаза |
Co |
Фосфатаза, фосфокиназа |
Mg |
Тирозиназа |
Cu |
Сукцинатдегидрогеназа |
Fe |
Ксантиноксидаза |
Mo |
Содержание
-глюкозооксидаза используется - содержание глюкозы в крови
-уреаза –определение концентрации мочевины
липаза – липидов
Активность
–измерение скорости превращения субстрата в продукт, т.е. количество превращѐнного субстрата в единицу времени.
Типы единиц
1![]() )Международная
(стандартная) Единица активности – это
количество фермента, которое катализирует
превращение 1 мкмоля субстрата в минуту
в оптимальных условиях:
)Международная
(стандартная) Единица активности – это
количество фермента, которое катализирует
превращение 1 мкмоля субстрата в минуту
в оптимальных условиях:
2)Катал – количество фермента, которое катализирует превращение в оптимальных условиях 1 моля субстрата за одну секунду
![]()
![]()
3)Другие -активность протеиназ - «тирозиновые единицы»
-активность амилазы – в амилокластических
-активность аминотрансфераз – условных
