
Презентация / РыскинаЕА_Лекция по энзимологии
.pdf
Альфа-амилаза (Диастаза, 1,4 альфа-Д- Глюканогидролаза) (КФ 3.2.1.1.)
Основной фермент, участвующий в гидролизе углеводов, а именно разложении крахмала и гликогена до декстринов, мальтозы и глюкозы. Места образования фермента – слюнные железы и поджелудочная железа. В сыворотке крови выделяют, таким образом, панкреатический (Р-тип) и слюнной (S-тип) α-амилазы. Кальций содержащий фермент.
Определение активности α-амилазы в сыворотке и моче используется преимущественно в диагностике
заболеваний поджелудочной железы.
ДЛЯ ОПРЕДЕЛЕНИЯ АКТИВНОСТИ АМИЛАЗЫ ПРЕДЛОЖЕНО БОЛЕЕ 200 МЕТОДОВ. В НАСТОЯЩЕЕ ВРЕМЯ ШИРОКОЕ РАСПРОСТРАНЕНИЕ ИМЕЮТ ФЕРМЕНТАТИВНЫЕ КОЛОРИМЕТРИЧЕСКИЕ МЕТОДЫ С ИСПОЛЬЗОВАНИЕМ РАЗЛИЧНЫХ ХРОМОГЕННЫХ СУБСТРАТОВ
Пример метода с использование хромогенных субстратов: В качестве
субстрата для a-амилазы используется мальтотриозид, связанный с
хромогеном 2-хлор-п-нитрофенолом (ХНФ). Под действием a-амилазы субстрат гидролизуется с выделением окрашенного 2-хлор-п-нитрофенола, мальтотриозы и глюкозы. Реакция протекает быстро и не требует присутствия в реакционной смеси коферментов. Скорость гидролиза субстрата и образования продукта (2-хлор-4-нитрофенола) прямо пропорционально активности a-амилазы в пробе и измеряется спектрофотометрически при длине волны 405 нм. Рекомендуется использовать ФЭК или полуавтоматический, автоматический биохимический анализатор, а именно - кинетический режим, обеспечивающий термостатирование фотометрической ячейки при 37С.
Амилаза
Мальтотриозид-ХНФ ----------- |
> ХНФ + Мальтотриоза + Глюкоза |
Линейность метода: до 1500 Е/л. Норма: 25-125 Е/л (37°С).
АЛАНИНАМИНОТРАНСФЕРАЗА (АЛТ) – КФ 2.6.1.2. АСПАРТАТАМИНОТРАНСФЕРАЗА (АСТ) - КФ 2.6.1.1.
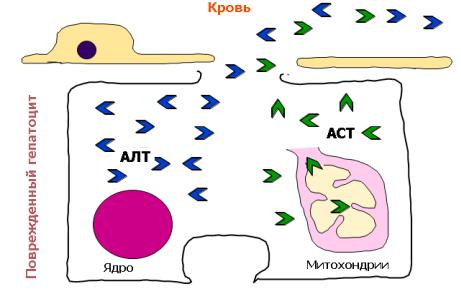
▪Эти ферменты играют центральную роль в обмене белков.
▪Избирательная тканевая локализация позволяет считать трансаминазы индикаторными (маркерными) ферментами:
▪АСТ для миокарда
▪АЛТ для печени
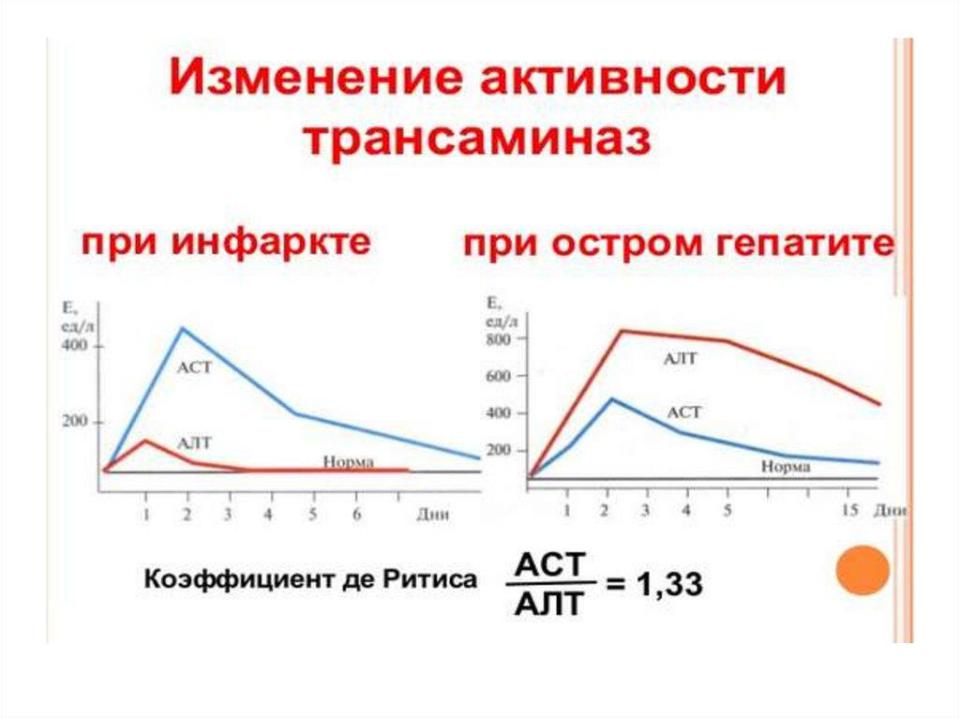
▪Соотношение активности аминотрансфераз - АСТ/АЛТ (коэффициент де Ритиса) позволяет судить о глубине повреждения клеток: АЛТ преимущественно локализована в цитоплазме, АСТ — в митохондриях.
СУЩЕСТВУЮЩИЕ МЕТОДЫ ОПРЕДЕЛЕНИЯ АКТИВНОСТИ ТРАНСАМИНАЗ В СЫВОРОТКЕ КРОВИ МОЖНО РАЗДЕЛИТЬ НА ДВЕ ОСНОВНЫЕ ГРУППЫ:
ФОТОКОЛОРИМЕТРИЧЕСКИЕ И СПЕКТРОФОТОМЕТРИЧЕСКИЕ:
Колориметрические методы основаны на образовании окрашенного динитрофенилгидразона пировиноградной кислоты. Наибольшее применение нашел метод Райтмана-Френкеля, являющийся технически простым и дающим воспроизводимые результаты.
Принцип метода: При определении активности АСТ и АЛТ пользуются тем, что образующийся продукт реакции пировиноградная кислота (ПВК) при добавлении 2,4 динитрофенилгидрозина (2,4ДНФГ) образует окрашенный гидразон ПВК в щелочной среде. Интенсивность окраски прямо пропорционально количеству образовавшейся ПВК, а значит и активности фермента.
|
АЛТ |
|
Аланин + ά-кетоглутаровая кислота |
→ |
ПВК + 2,4ДНФГ → |
гидразон ПВК + NaOH → коричневое окрашивание |
||
|
АСТ |
|
Аспартат + ά-кетоглутаровая кислота |
→ |
ПВК + 2,4ДНФГ → |
гидразон ПВК + NaOH → коричневое окрашивание
ВОСНОВЕ СПЕКТРОФОТОМЕТРИЧЕСКИХ МЕТОДОВ ОПРЕДЕЛЕНИЯ АКТИВНОСТИ АЛТ И АСТ ЛЕЖИТ
ИСПОЛЬЗОВАНИЕ ОПТИЧЕСКОГО ТЕСТА ВАРБУРГА
Эти методы являются наиболее специфичными и точными для исследования активности трансаминаз сыворотки крови, требуют постановки индикаторных реакций, в которые вовлекаются продукты основной реакции:
▪ Скорость окисления НАДН(Н+) пропорциональна активности
аланин аминотрансферазы (АЛТ): L-аланин + a-кетоглутарат ↔ пируват + L-глутамат
пируват + НАДН(Н +) ↔ лактат + НАД
▪ Скорость окисления НАДН(Н+) пропорциональна активности
аспартатаминотрансферазы (АСТ): L-аспартат + a-кетоглутарат ↔ оксалоацетат + L-глутамат
оксалоацетат + НАДН(Н+) ↔ малат + НАД
КРЕАТИНКИНАЗА (КК) - ФЕРМЕНТ, КАТАЛИЗИРУЮЩИЙ ОБРАТИМУЮ РЕАКЦИЮ ПЕРЕНОСА ОСТАТКА ФОСФОРНОЙ КИСЛОТЫ С АТФ НА КРЕАТИН.
▪Наиболее точными методами определения общей активности КК считаются методы, основанные на оптическом тесте Варбурга. Определение активности фермента можно проводить как по прямой, так и по обратной реакции, определяя содержание креатина или креатинфосфата:
▪Прямая реакция:
▪ Креатин + АТФ креатинкиназа Креатинфосфат + АДФ
▪ АДФ + Пируватфосфат пируваткиназа |
АТФ + Пируват |
▪ Пируват + НАДН лактатдегидргеназа |
Лактат + НАД |
▪Клиническое значение: Повышение общей активности КК имеет место при мышечных повреждениях (инфаркт миокарда, травма мышцы), при мышечной дистрофии, полимиозите, сильном мышечном напряжении (беге), гипотиреозе, инсульте.
▪Норма общей активности КК варьирует в зависимости от метода: 10-50 МЕ.
УНИФИЦИРОВАННЫМ МЕТОДОМ ЯВЛЯЕТСЯ ФОТОКОЛОРОМЕТРИЧЕСКИЙ
МЕТОД, ОСНОВАННЫЙ НА ОПРЕДЕЛЕНИИ КОНЦЕНТРАЦИИ
НЕОРГАНИЧЕСКОГО ФОСФОРА, ОСВОБОЖДАЮЩЕГОСЯ В РЕЗУЛЬТАТЕ ГИДРОЛИТИЧЕСКОГО РАСЩЕПЛЕНИЯ КРЕАТИНФОСФАТА. НЕОРГАНИЧЕСКИЙ ФОСФОР ОПРЕДЕЛЯЮТ ФОТОКОЛОРИМЕТРИЧЕСКИ
▪Нормальные величины:
▪Общая активность КК (сыворотка) до 6 МЕ
▪Изоферменты КК - сыворотка (электрофорез):
▪ВB — отсутствие или следы
▪MB < 4-6% общей активности
▪MM > 94-96%общей активности
▪Влияющие факторы: in vitro: завышает результаты исследования наличие фосфора в посуде, гемолиз (из-за наличия в эритроцитах аденилаткиназы).
▪in vivo: повторные мышечные инъекции, тяжелые мышечные нагрузки, хирургические операции, этанол, длительная анестезия ведут к увеличению активности фермента в сыворотке.

ИЗОФЕРМЕНТЫ КРЕАТИНФОСФОКИНАЗЫ ОПРЕДЕЛЯЮТ ПРИ ПОМОЩИ ЭЛЕКТРОФОРЕЗА (НА АГАРЕ, В ПОЛИАКРИЛАМИДНОМ ГЕЛЕ) И КОЛОНОЧНОЙ
ХРОМАТОГРАФИИ.
НАИБОЛЬШЕЕ КЛИНИЧЕСКОЕ ЗНАЧЕНИЕ ИМЕЕТ ОПРЕДЕЛЕНИЕ АКТИВНОСТИ ИЗОФЕРМЕНТОВ КРЕАТИНКИНАЗЫ:
КК-МВ (СЕРДЕЧНЫЙ ИЗОФЕРМЕНТ, ИЗМЕНЯЮЩИЙСЯ ПРИ ПОВРЕЖДЕНИИ КЛЕТОК МИОКАРДА),
КК-ВВ (МОЗГОВОЙ ИЗОФЕРМЕНТ, ОТРАЖАЮЩИЙ ПАТОЛОГИЮ КЛЕТОК ГОЛОВНОГО МОЗГА),
КК-ММ (МЫШЕЧНЫЙ ИЗОФЕРМЕНТ, НАХОДЯЩИЙСЯ В СКЕЛЕТНЫХ МЫШЦАХ).
▪После инфаркта миокарда КК-МВ повышается быстро (за 3-5 ч) и сохраняется повышенной 2-3 дня. Показатель не повышается при инфаркте легкого и поражении паренхимы печени.
▪Содержание КК-ММ повышается в сыворотке при повреждении скелетных мышц, мышцы сердца, мозга, при заболеваниях мышц, после тяжелой физической нагрузки.

ЛАКТАТДЕГИДРОГЕНАЗА (ЛДГ) - ЦИТОПЛАЗМАТИЧЕСКИЙ ФЕРМЕНТ, ОБРАТИМО КАТАЛИЗИРУЮЩИЙ ВОССТАНОВЛЕНИЕ ПИРУВАТА В ЛАКТАТ
▪Существуют следующие методы определения общей активности ЛДГ в сыворотке крови. Эти методы высокочувствительны.
▪1. Колориметрические методы. Динитрофенилгидразиновый метод основан на определении количества пировиноградной кислоты (продукт реакции) с помощью 2,4-дининтрофенилгидразина, который образует с пируватом в щелочной среде окрашенное соединение (см. АЛТ).
▪2. Спектрофотометрические методы основаны на различии спектров поглощения окисленной и восстановленной форм НАД (оптический тест Варбурга).
▪ Лактат + НАД |
Лактатдегидрогеназа |
Пируват + НАДН |
▪Норма (варьирует в разных методах): до 250 МЕ при 37 °С.
▪Клиническое значение. Общая активность ЛДГ в сыворотке крови резко повышена при мегалобластных и пернициозных анемиях, обширных опухолевых процессах, вирусных гепатитах, шоке, гипоксии. Выраженное повышение наблюдается при циррозах печени, обтурационных желтухах, заболеваниях почек, опорно-мышечного аппарата, опухолях, при сердечной недостаточности.
