
- •1. Уровни организации белковых молекул. Структуры белка и их краткая характеристика Ам-к состав белков, пептидная связь и ее физико-химическая характеристика.
- •2. Четвертичная структура белков. Особенности строения и функционирования олигомерных белков на примере гемсодержащих белков - гемоглобина и миоглобина.
- •3. Физико-химические свойства белков и их классификация. Потребность в белках. Азотистый баланс. Белковая недостаточность. Квашиокор.
- •5. Основные свойства белковых фракций крови и значение их определения для диагностики. Методы исследования. Эмбриоспецифические белки и их значение. Энзимо-диагностика.
- •8. Строение нуклеиновых кислот. Азотистые основания и сахара, входящие в состав днк и рнк. Нуклеозиды и нуклеотиды. Адениловые динуклеотиды (над, надф, фад). Денатурация и ренатурация днк(см.10в)
- •9. Вторичная структура днк и рнк. Комплементарность азотистыx оснований.
- •11. Общая характеристика витаминов, классификации, биологическое значение, источники, потребность, а- и гипервитаминозы. Кофакторы и коферменты.
- •12. Витамины и коферменты. Роль флавиновых коферментов.
- •13. Витамин b1(тиамин), его строение и медико-биологическое значение.
- •14. Тиаминпирофосфат, его строение и биологическая роль.
- •15. Биотин и витамин в12(кобаламин, антианемический). Роль этих витаминов в биосинтезах.
- •25. Роль биотина и витамина b12 в клеточном метаболизме.
- •17. Строение фад и его роль в клеточном метаболизме.
- •2 9. Витамины в2 и рр их химическое строение и роль в клеточном метаболизме.
- •30. Витамин а(ретинол, антисерофтальмический), его химическое строение и роль в обмене веществ клеток. Основные пищевые источники витамина а.
- •31. Витамины группы d, их строение и физиологическая роль.
- •3 2.Аскорбиновая кислота. Строение и физиологические функции.
- •34. Витамины е и к, их химическое строение и медико-биологическое значение. Витамин е см.33.
- •35. История открытия и изучения ферментов. Особенности ферментативного катализа.
- •36. Особенности ферментативного катализа. Специфичность действия ферментов. Основные представления о механизме ферментативного катализа.
- •37. Современные представления о механизмах действия ферментов. Мультиферментные комплексы на примере структуры синтазы жирных кислот.
- •42. Регуляция активности ферментов. Различные способы активации и ингибирования ферментов.
- •44. Классификация и номенклатура ферментов. (см.39в) Виды энзимопатологий. Наследственные энзимопатии.
- •45. Строение окисленного и восстановленного над. Важнейшие субстраты над-зависимых дегидрогеназ. Представление о надн-дегидрогеназах и других переносчиках электронов внутренней мембраны митохондрий.
- •47. Различия ферментного состава тканей. Изменения активности ферментов в процессе развития. Изоферменты и энзимодиагностика.
- •48. Различия ферментного состава органов и тканей. Органоспецифичные ферменты. Изменения активности ферментов в процессе развития. Изоферменты и энзимодиагностика.
- •56. Амфиболические функции цикла трикарбоновых кислот.
- •57. Анаболические функции цикла лимонной кислоты. Реакции, пополняющие цитратный цикл.
- •54. Представление о процессах окислительного фосфорилирования. Надн-дегидрогеназа как компонент дыхательной цепи.
- •57. Дыхательная цепь митохондрий, ее строение и основные принципы функционирования. Теории сопряжения окисления и фосфорилирования
- •64. Иерархия регуляторных систем. Место гормонов в системе регуляции метаболизма. Механизмы передачи гормонального сигнала в клетку.
- •67 Гормоны задней доли гипофиза
- •73. Прогестерон, его физико-химическая характеристика и биологические функции
- •80 Краткая характеристика гомо- и гетерополисахаридов. Их биологическое и физиологическое значение.
- •84 Наследственные нарушения обмена моносахаридов и дисахаридов: галактоземия, непереносимость фруктозы, непереносимость дисахаридов.
- •86. Глюкозо-6-фосфат, схема путей его образования и использования в организме.
- •87 Синтез гликогена и гликогенолиз-распад
- •90. Гликогенолиз и его биологическое значение.
- •88. Пути синтеза полисахаридов. Роль утф в синтезе полисахаридов. Регуляция синтеза и распада полисахаридов. Гликогенозы и биохимические механизмы их возникновения.
- •89. Свойства и строение гликогена. Биосинтез гликогена. Мобилизация гликогена и его гормональная регуляция.
- •90, 91 Гликолиз, биологическое значание.
- •93. Анаэробный гликолиз. Гликолитическая оксидоредукция, субстратное фосфорилирование.
- •94. Молочнокислое брожение –
- •95 Метаболические превращения пвк.
- •96. Окислительное декарбоксилирование пвк(см.58-59)
- •99.Глюконеогенез.См.Выше и в метаболизме*
- •112.Классификация липидов. Роль в жизнедеят-ти клетки. Метаболизм липопротеинов, транспорт липидов между органами и тканями. Нарушение обмена липидов при сердечно-сосудистых.
- •124. Окисление ненасыщенных жирных кислот, метаболические особенности этого процесса.
- •129.Фосфолипиды, разновидности, структура, роль в построении биомембран и в формировании их функциональных особенностей(см.121,119).
- •130. Желчные кислоты и их роль в переваривании липидов. Связь с обменом холестерина.
- •133. Биосинтез кефалина и лецитина и их биологическая роль(см.135)
- •134. Биосинтез фосфолипидов и их биологическая роль.
- •135. Биосинтез лецитина и его биологическое значение. Липотропные факторы.
- •136. Строение холестерина и его биологическое значение. Представление о биосинтезе холестерина.
- •138. Представление о биологическом значении и метаболизме холестерина.
- •140. Ресинтез триацилглицеринов в стенке кишечника. Образование хиломикронов и транспорт жиров. Роль аполипопротеинов в составе хиломикронов. Липопротеинлипаза.
- •141. Краткая характеристика липопротеидов крови. Роль апопротеинов в функционировании липопротеидов. Диагностическое значение определения липопротеинов в клинике.
- •142. Хиломикроны, их физико-химическая характеристика и физиологическое значение.
- •144. Кетоновые тела, структура, механизмы образования и окисления. Кетогенез при голодании и сахарном диабете. Резистентность и склонность к кетозу у детей.(см.143).
- •145. Образование кетоновых тел, химизм реакции, биологическое значение. Основные причины их избыточного образования(см.Выше)
- •146. Роль печени в липидном обмене.
- •151. Рекции переаминирования и трансдезаминирования и их значение в метаболизме клеток.
- •164. Метионин и его роль в обмене веществ. S-аденозилметионин, как липотропный фактор.
- •165. Роль лизина и аргинина в клеточном метаболизме.
- •167. Строение днк эукариотических клеток и механизмы, лежащие в основе ее пространственной упаковки. Многообразие азотистых оснований. Функции нуклеиновых кислот в живых организмах.
- •168. Генетический код и его характеристика. Молекулярные механизмы возникновения наследственных болезней. Краткое описание процесса трансляции.
- •170. Синтез белка на рибосомах. Условия необходимые для реализации этого процесса.
- •172. Распад пуриновых оснований. Химизм процесса и его медико-биологическое значение. Подагра.
- •173. Распад пуриновых оснований. Химизм процесса и его медико-биологическое значение. Подагра.(см.172)
- •175. Распад гема. Образование и пути выделение билирубина. Желтухи, диагностика. Характеристика распада гемоглобина в неонатальном периоде. Физиологическая желтуха новорожденных.
- •176. Биосинтез гема и его регуляция. Химизм реакций до порфобилиногена, представление о дальнейших путях синтеза гема. Порфирии.
- •178. Незаменимые факторы питания и их медико-биологическое значение. Необходимость оптимального обеспечения детского организма незаменимыми факторами питания.
- •179. Основные пищевые вещества: углеводы, жиры, белки; суточная потребность, переваривание; частичная взаимозаменяемость при питании.
- •180. Обмен веществ: питание, метаболизм и выделение продуктов метаболизма. Состав пищи человека. Органические и минеральные компоненты. Основные и минорные компоненты.
1. Уровни организации белковых молекул. Структуры белка и их краткая характеристика Ам-к состав белков, пептидная связь и ее физико-химическая характеристика.
Б.- полимеры, мономерами которых явл.ам-к, соедин.пептидной связью. Пептидная связь образуется путем взаим.а-карбоксил.группы одной ам-к с а-аминогруппой другой ам-к.
Первичная структура – линей.последов. ам-к.остатков в полипептидной цепи.
Вторич. струк. белка — простр. структура, формирующаяся в рез-те образ.водород.связей м/у группами –С=о и NH пептидного остова.структура мб 2 типов: а-спирали и b-структуры.
Третич. струк. белка — обр. в рез-те гидрофобных взаимод. между радикалами аминок-т. Большинство белков при этом формир.глобулу.
Четвертич струк. - способ укладки в пространстве отдельных полипептидных цепей, обладающих одинаковой (или разной) первичной, вторичной или третичной структурой. Белки-высокомолекулярные биологич полимеры,составленные из 21 разл мономера- альфа аминокислотных остатков, соединенных пептидной связью. Если аминокислотн цепь содержит менее 10-20 остатков аминокислот, ее наз- пептидом, если более –полипептидом. Полипептиды сост из 50 и более аминокислотных остатков, наз – белками. Общ форм. аминок-т:Пептидные связи соедин аминогруппу одной аминок-ты с карбоксильной гр др аминок-ты. (т о - образование полимера).
Пепт. сязи оч. прочные,для их разруш вне организма требуются выс температуры и давл, сильно кислая или сильно щелочная среда и длит время.В клетках ораганизма пепт связи разры-ся протеолитич ферментами.Вращение вокруг связи C-N треб больш затрат Э. и затруднено. Пепт цепь имеет одно направление и два разн конца – N-конец несет свободную аминогр первой аминок-ты (начало белк цепи) и C-конец несет карбокс гр последнего аминокисл остатка.
2. Четвертичная структура белков. Особенности строения и функционирования олигомерных белков на примере гемсодержащих белков - гемоглобина и миоглобина.
Ч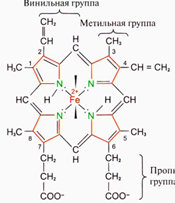 етвертичная
структура-пространственная ориентация
нескольких полипептидных цепей, облад.
собственной первичной, вторичн или
третичной структурой, с образ.
макромолекулярного образования.
Гем(рис).
етвертичная
структура-пространственная ориентация
нескольких полипептидных цепей, облад.
собственной первичной, вторичн или
третичной структурой, с образ.
макромолекулярного образования.
Гем(рис).
У олигомерных Б. появл св-ва,отсутствующие у мономерных Б. Формирование четвертичн структуры ведет к усложнению фу-ии.,появл возможность их регуляции.. Миоглобин и гемоглобин представляют собой белки, соединенные с железосодержащим пигментом – гемом. Миоглобин депонир кислород в красных мыш волокнах и освобожд его при интенсивной мыш работе,после чего кислород использ для получ Э, необход мышцам. Ф-ии гемоглобина - транспорт кислорода из легких в ткани, т е связывание кислорода в легких и его диссоциация в капиллярах ткани.
Два эти белка называют дыхательными ферментами, т.к. выполняют роль переносчиков при дыхании. Гем приобретает способность переносить кислород лишь при условии, если его окружает и защищает специфический белок – глобин (сам по себе гем не связывает кислород).
3. Физико-химические свойства белков и их классификация. Потребность в белках. Азотистый баланс. Белковая недостаточность. Квашиокор.
Физ. Св-ва. Белки — кристалл.в-ва, имеющие большую молекулярную массу , благодаря чему образуют в воде коллоидные растворы. Растворимость Б. опр. их ам-к.составом, особ. организации молекулы и св-вами растворителя. Стабильность растворам белков придают заряд белковой молекулы и ее гидратная оболочка.Химические св-ва белков определяются благодаря функциональнм группам(—NH2, —СООН, —ОН, —SН и др.). Характерной для белков реакцией является гидролиз пептидных связей. Благодаря наличию и амино-, и карбоксильных групп белки обладают амфотерными свойствами.
Азотистый баланс-это соотнош между суточным приходом и суточным расходом белка (азота) -о приходе и расходе белка судят по приходу и расходу азота, для этого кол-во азота умножают на 6,25 (напр с мочой выделилось 12 г азота, суточный расход равен = 12*6,25=75 г)
Возможны 3 варианта баланса - азотистое равновесие, отриц.(расход > приход – опухолевый рост) и положительный азот баланс(приход>расхода – рост, беременность, наращивание мыш массы.
Сут.потребность в белках – 60-120г.
Причины развития белковой недостаточности: малое содержание белков в пище с дефицитом незаменимых аминокислот; заболевания органов пищеварения,; повышенный расход и потери белка при туберкулезе, многих инфекционных болезнях. Квашиоркор — вид тяжёлой дистрофии на фоне недостатка белков в пищевом рационе. Болезнь обычно возникает у детей 1-4 лет, развивающихся стран. Причинами мб также врожденные нарушения обмена ам-к, нарушения всасывания белка в кишечнике, повышенные потери белка с мочой при нефротическом синдроме, нарушение синтеза белка. Все это приводит к нарушению развития ребенка, дистрофическим изменениям органов и тканей.
4. Лабильность пространственной структуры белков. Факторы, вызывающие денатурацию белков. Белки теплового шока и шапероны. Представление о прионах. Болезни, связанные с нарушением правильного сворачивания белков - болезнь Альцгеймера, кистозный фиброз, BSE (Коровье бешенство), наследственная форма эмфиземы, а также многие формы рака.
Лабильность-св-во белков незначительно изменять конформацию посредством разрыва одних и образ др слабых связей без потери биологич активности.
Факторы,вызыв Денатурацию:
Выс. температ –выше 50 градусов, кислоты и щелочи; мочевина гуанидинхлорид; спирт и фенол разруш гидрофобные и водородные связи; соли тяж металлов образ нераствор соли Б и этих металлов.
Шапероны - класс белков, главная функция которых состоит в восстановлении правильной третичной структуры повреждённых белков, а также образование и диссоциация белковых комплексов. Напр.митохондриальные шапероны активируют ферменты пируватдегидрогеназного комплекса. Многие шапероны являются белками теплового шока, то есть белками, экспрессия которых начинается в ответ на рост температуры или другие клеточные стрессы.
Прио́ны особый класс инфекционных агентов, чисто белковых, не содержащих нуклеиновых кислот, вызывающих тяжёлые заболевания центральной нервной системы у человека и ряда высших животных (т. н. «медленные инфекции»).
