
LS-Sb88916
.pdfМИНОБРНАУКИ РОССИИ
–––––––––––––––––––––––––––––––––
Санкт-Петербургский государственный электротехнический университет «ЛЭТИ»
–––––––––––––––––––––––––––––––––––––––
АНАЛИЗ БИОСУБСТРАТОВ
Электронные методические указания к лабораторным работам
Санкт-Петербург Издательство СПбГЭТУ «ЛЭТИ»
2012
УДК 543.075
Анализ биосубстратов: Электронные методические указания к лабораторным работам по аналитической химии и физико-химическому конструированию биоматериалов / Сост.: С. А. Кириллова, В. Ф. Иванов, О. А. Лебедев. СПб.: Изд-во СПбГЭТУ «ЛЭТИ», 2012. 40 с.
Включают восемь работ, относящихся к курсам «Аналитическая химия», «Аналитическая химия биосовместимых материалов», «Физико-химическое конструирование биоматериалов», в которых приводятся методики исследования биосубстратов.
Предназначены для магистров направления «Биотехнические системы и технологии», образовательная программа магистратуры «Биосовместимые материалы»
Утверждено редакционно-издательским советом университета в качестве электронных методических указаний
© СПбГЭТУ «ЛЭТИ», 2012
2
ВВЕДЕНИЕ
Аналитическая химия – научная дисциплина, развивающая и применяющая методы, приборы и общие подходы для получения информации о химическом составе и, в некоторой степени, структуре веществ и их изменении в пространстве и времени (определение ИЮПАК). Основной целью аналитической химии является обеспечение требуемой точности, высокой чувствительности, экспрессности и/или избирательности анализа при изучении и контроле химического состава веществ в производстве, при проведении научных исследований, исследовании объектов окружающей среды, анализе живых систем и др.
Предмет исследования химика-аналитика называется – образцом или пробой. В качестве анализируемого образца могут выступать различные объекты. По природе анализируемого объекта различают органические и неорганические вещества. Вещество может находиться в любом агрегатном состоянии и должно быть специальным образом подготовлено к анализу (процедура пробоподготовки зависит от конкретного метода).
Необходимо различать принцип анализа, метод анализа и методику анализа.
Принцип анализа – это то явление природы, которое лежит в основе данного метода анализа и может предоставить аналитику интересующую его информацию. Например, взаимодействие электромагнитного излучения оптического и ультрафиолетового диапазона с веществом в спектрофотометрии.
Метод анализа характеризует ход анализа с точки зрения его важнейших стадий в соответствии с тем или иным принципом анализа.
Методика анализа – это полное описание всего хода анализа. В ней в форме подробных прописей оговариваются все детали анализа, включая отбор пробы и представление результатов.
При выборе того или иного метода анализа руководствуются следующими принципами:
1.Чувствительность метода. Определяется тем минимальным количеством вещества, которое можно определять данным методом. Сравнивая чувствительность различных методов и примерное содержание определяемого компонента в пробе, выбирают тот или иной метод анализа.
2.Избирательность (селективность) метода, т. е. возможность опреде-
ления данного вещества в многокомпонентных пробах. Например, метод атомно-эмиссионной спектроскопии с индуктивно-связанной плазмой поз-
3
воляет определять до 30 различных химических элементов одновременно из одной пробы (без их предварительного разделения). Методы (методики), позволяющие определять только один компонент в пробе на фоне большого количества других называют специфичными.
3.Точность анализа включает в себя правильность и воспроизводимость.
Точность часто характеризуют относительной погрешностью определения (%).
4.Экспрессность метода. Существуют методы, позволяющие проводить анализ очень быстро (ионометрия, атомно-эмиссионная спектроскопия с ин- дуктивно-связанной плазмой и т. д.). Следует отметить, что сама стадия измерения в большинстве методов является достаточно быстрой, а основное время затрачивается на пробоподготовку. Поэтому при прочих равных условиях для уменьшения времени анализа предпочитают выбирать наиболее избирательные, не требующие специальной пробоподготовки, методы.
5.Стоимость анализа. При проведении серийных и массовых анализов большую роль играет стоимость химического анализа, в которую входит стоимость используемой аппаратуры, реактивов, рабочего времени хими- ка-аналитика и т. д. Наиболее дешевыми с точки зрения аппаратуры являются титриметрические, гравиметрические методы и потенциометрия. Наиболее дорогой является аппаратура, используемая в хромато-масс-спектрометрии, атомно-эмиссионной спектроскопии с индуктивно-связанной плазмой и т. п. методах. При прочих равных условиях для решения поставленной задачи стараются выбирать наиболее дешевые методы анализа.
6.Автоматизация анализа. При проведении массовых однотипных ана-
лизов следует выбирать метод, допускающий автоматизацию анализа, которая позволяет облегчить труд аналитика, заменив многие ручные, трудоемкие операции автоматическими, снизить погрешности отдельных операций, уве-
личить скорость проведения анализа, снизить его стоимость, проводить ана-
лиз на расстоянии и т. д.
Процесс установления состава образца с точки зрения природы содер-
жащихся в нем компонентов называется качественным анализом. Результа-
том качественного анализа является ответ на вопрос «Содержится ли данное вещество или элемент в пробе или нет?». В настоящее время вопросы каче-
ственного анализа возникают в связи с обнаружением следовых количеств веществ: примесей в полупроводниковых материалах; загрязнений в воздухе;
запрещенных медицинских препаратов в биологических объектах и т. п.
4
Задача количественного анализа определить количество (содержание) элемента или соединения в анализируемой пробе. Вместо абсолютного количества аналитика может интересовать концентрация (при анализе растворов) или доля (при анализе твердых проб) искомого компонента.
Качественный и количественный анализ проводят, фиксируя аналитиче- ский сигнал. Например, при добавлении к раствору, содержащему сульфат-ионы, раствора соли бария выпадает белый осадок (сульфат бария), не растворимый в 6 н растворе соляной кислоты. Появление такого осадка является аналитическим
сигналом на присутствие в исследуемом растворе ионов SO24− .
Аналитический сигнал может давать информацию как качественного, так и количественного характера. При проведении качественного анализа фиксируют наличие аналитического сигнала – образование осадка, появление определенной окраски раствора или линии в спектре.
Количественную информацию получают, измеряя интенсивность ана- литического сигнала: массу осадка, силу тока, интенсивность линии спектра и т. д. Затем, используя функциональную зависимость между интенсивностью аналитического сигнала и содержанием определяемого компонента, рассчитывают его количество. При измерении аналитического сигнала учитывают наличие полезного аналитического сигнала, являющегося функцией содержания определяемого компонента, и аналитического сигнала фона, обусловленного мешающими компонентами пробы, а также «шумами» приборов и измерительных схем. Аналитический сигнал фона учитывают при проведении контрольного (холостого) опыта, в котором через все стадии анализа проводится проба, не содержащая определяемый компонент. Полезный аналитический сигнал при этом будет равен разности между величиной измеренного аналитического сигнала анализируемой пробы и величиной аналитического сигнала фона.
По происхождению аналитического сигнала все методы анализа можно раз-
делить на химические (классические), физико-химические и физические методы.
Кхимическим относят методы, в которых аналитический сигнал возникает
врезультате протекания химической реакции, а фактором интенсивности этого сигнала является либо масса (гравиметрия), либо объем (титриметрия).
В физико-химических методах аналитический сигнал также является результатом химической реакции, но представляет собой какое-либо физи- ко-химическое свойство системы (например, электропроводность раствора,
5
светопоглощение, сила тока и т. п.). В свою очередь в физико-химических методах можно выделить оптические, электрохимические и хроматографические методы анализа.
Вфизических методах в качестве аналитического сигнала выступает некое физическое свойство (например, испускание света при повышенной температуре, люминесценция, ядерный и парамагнитный резонанс и т. д.).
Различают также одномерные и двумерные методы анализа. Одномерные методы основаны на измерении интенсивности аналитического сигнала в единственной измеряемой позиции (например, измерение светопоглощения при одной длине волны). Одномерные методы пригодны только для однокомпонентного анализа. Как правило, химические методы анализа относятся к одномерным.
При двумерном методе анализа аналитический сигнал регистрируют в нескольких измерительных позициях (например, регистрация полного спектра поглощения в спектрофотометрии). Двумерные методы можно использовать как для однокомпонентного, так и для многокомпонентного анализа. Данные, полученные с помощью двумерных методов, можно представить в виде зависимости интенсивности аналитического сигнала от некоей величины x, которая различна в каждом методе. Например, в спектроскопии x соответствует длине волны; в хроматографии – времени; в электрохимических методах анализа – потенциалу электрода и т. п. Обычно зависимости, полученные в двумерных методах, содержат отдельные пики (электрохимические методы, хроматография) или полосы (спектроскопия). Положение максимума пика или полосы дает качественную информацию о природе соответствующего элемента или соединения, а площадь или высота пика используется для определения содержания компонента.
С точки зрения задач, решаемых химиком-аналитиком аналитические методы можно разделить на:
– методы элементного анализа;
– методы (функционального) структурного анализа;
– методы фазового анализа;
– методы изотопного анализа.
Входе количественного элементного анализа определяют абсолютное или процентное содержание элемента в пробе. В органических соединениях этими методами чаще всего определяют содержание углерода, водорода, серы, гало-
6
генов, азота, реже – фосфора, мышьяка и т. д. Задача элементного анализа в органической химии сводится к определению формулы соединения.
Задача методов структурного анализа состоит в определении пространственного расположения и порядка связи элементарных фрагментов атомного уровня, составляющих вещество. При синтезе нового химического соединения представляет интерес установление структуры его отдельных молекул. При разработке новых материалов исследуют структуру твердого тела.
В ходе качественного анализа органических соединений сначала определяют их состав, наличие тех или иных функциональных групп, затем устанавливают конфигурацию и конформацию молекул. Для структурного анализа в органической химии широко используют методы инфракрасной спектроскопии и ядерно-магнитного резонанса.
Фазовый анализ позволяет получать информацию о составе и количестве отдельных фаз в пробе. С помощью этих методов можно исследовать распределение той или иной фазы, как на поверхности, так и в объеме анализируемого образца.
Методами изотопного анализа определяют изотопный состав анализируемой пробы.
Чтобы получить четкий аналитический сигнал, определяемое вещество или элемент предварительно переводят в соответствующую аналитическую форму. Во многих методах для этих целей служит аналитическая химическая реакция, важнейшей количественной характеристикой которой является пре-
дел обнаружения.
Предел обнаружения – это наименьшее содержание, при котором по данной методике можно обнаружить присутствие определяемого компонента с заданной вероятностью P. В качественном анализе доверительная вероятность должна быть равна единице. Поэтому в качественном анализе за предел обнаружения принимают то наименьшее содержание определяемого компонента, при котором сигнал еще настолько интенсивен, что всегда (во всех опытах) получают положительные результаты. В большинстве методов количественного анализа доверительная вероятность составляет 0,95. Следует отметить, что предел обнаружения не является постоянной характеристикой химической реакции, используемой для анализа, а в значительной степени зависит от условий протекания реакции: рН раствора, концентраций реагентов, температуры и т. д.
7
ХИМИЧЕСКИЙ АНАЛИЗ В МЕДИЦИНСКОЙ ДИАГНОСТИКЕ
Чтобы определить общее состояние организма, а также установить, подтвердить или опровергнуть конкретный диагноз, как правило, пациенту назначают проведение анализов. К самым распространенным из них относится анализ таких биологических жидкостей как кровь и моча. Кроме того, в качестве биологических материалов выступают и другие жидкие и твердые компоненты живого организма – биосубстраты, такие как слюна, слезная жидкость, сперма, спинномозговая жидкость, лимфа, волосы, ногти и т. п. Анализу подвергают также срезы биотканей (группы мышечных, соединительных, нервных клеток и отдельные клетки) и фрагменты оперированных органов (биопсия).
Анализ жидких биологических образцов, тканей, вытяжек из них и т. д. есть не что иное, как определение их химического состава. Получаемая первичная информация о содержании отдельных компонентов биологических жидкостей позволяет сделать диагностические выводы о том, в каком состоянии находятся органы человека. Анализ крови представляет собой два вида исследований: клинических (уровень гемоглобина, число эритроцитов, тромбоцитов, лейкоцитов и скорость оседания эритроцитов) и биохимических (содержание гормонов, холестерина, глюкозы, креатинина, мочевины и т. д.). По этим результатам делают выводы о состоянии организма человека – наличии анемии, аллергии, различных патологий и заболеваний.
Химический анализ – одна из составляющих комплексного подхода в медицинской диагностике. Существует так называемый золотой стандарт диагностики. Это комплексная программа диагностического обследования, позволяющая врачу в сложных или неясных случаях создать целостное представление о состоянии здоровья пациента, выявить имеющиеся проблемы и разработать индивидуальную эффективную тактику лечения. Процедура включает в себя двенадцать видов исследований, необходимых для получения всесторонней информации о состоянии здоровья пациента. Все они делятся на две большие группы: инструментальная диагностика (ЭКГ, УЗИ, диагностика клеточного метаболизма) и лабораторная (общие анализы крови и мочи, биохимический анализ крови, гормональный фон и т. д.). Лабораторные исследования, которые проводятся в ходе лечебно-диагностического процесса, позволяют получить непосредственную, часто наиболее раннюю, полную и точную диагностическую информацию о многих тончайших биохимических процессах, происходящих на клеточном, молекулярном и субмолекулярном уровнях как в во внутренней среде живого организма, так и в окружающей среде.
8

Биосубстраты отличаются высокой сложностью, разнообразием физических, химических и физико-химических свойств, изменчивостью под влиянием внешних факторов и другими характеристиками, превращающими их исследование в непростую аналитическую задачу. Они представляют собой, как правило, многокомпонентные, часто многофазные, тонко структурированные системы, которые очень чувствительны к различным физико-хими- ческим воздействиям. Все это требует применения сравнительно мягких, неразрушающих методов обращения с биопробами как на стадии их подготовки, так и при проведении анализа.
Теоретический курс аналитической химии биосубстратов должен сопровождаться занятиями, позволяющими приобрести практические навыки аналитической работы. В данное издание вошли лабораторные работы по качественному и по количественному анализу биосубстратов. Работы по количественному анализу основаны на титриметрическом, поляриметрическом, фотоколориметрическом методах количественного определения некоторых компонентов в биологических жидкостях (биосубстратах).
ХИМИЧЕСКИЕ И ФИЗИКО-ХИМИЧЕСКИЕ МЕТОДЫ АНАЛИЗА
Титриметрический анализ основан на точном измерении объема титранта – раствора реактива, затраченного на реакцию с определяемым компонентом. Титрант-раствор – это раствор, концентрация которого точно известна. Тит-
ром раствора (т) называется масса вещества, содержащегося в 1 см3 (или в 1 мл)
раствора. Единица измерения титра – грамм на кубический сантиметр [г/см3] или миллиграмм на миллилитр [мг/мл], титрование идет до точки эквивалентности, устанавливающей момент окончания реакции. Расчет основывается на законе эквивалентов:
нвVв = нтVт ; нв = т ×1000 Vт ,
M fв Vв
где нв и нт – нормальные концентрации идентифицируемого вещества и тит-
ранта, [моль.экв./л]; Vв и Vт – их объемы, [л]; M fв – эквивалентная масса
вещества В, [г.экв./моль].
Принцип поляриметрического метода и расчет приводятся в лабораторной работе 4.
9

Основной закон светопоглощения – закон Бугера– Ламберта– Бера (БЛБ) – выражается уравнением:
I = I0 ×10−ElC , или lg (I0 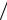 I ) = ECl ,
I ) = ECl ,
где I – интенсивность потока света, прошедшего через раствор; I0 – интен-
сивность потока света, падающего на раствор; Е – коэффициент поглощения света – постоянная величина, зависящая от природы растворенного вещества (молярный коэффициент поглощения); С – молярная концентрация раствора; l
– толщина слоя светопоглощающего раствора, см, или
По формуле I0 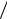 I = A находят абсорбционность, или оптическую плот-
I = A находят абсорбционность, или оптическую плот-
ность раствора, т. е. А = ЕСl. Если l = 1 см, а С = 1 моль/л, то А = E. Величину Е называют молярным коэффициентом поглощения (или экстинции).
Прямое спектрофотометрическое определение концентрации веществ осуществляется следующими методами:
1. Графическим, основанным на построении калибровочного графика в координатах А (абсорбция) – С (концентрация). Предварительно записывают спектр поглощения вещества и находят длину волны, соответствующую максимуму поглощения. Далее готовят стандартные растворы определяемого вещества (т. е. растворы известной концентрации), измеряют оптическую плотность их в максимуме поглощения и строят калибровочный график. В случае подчинения поглощения закону Бугера– Ламберта– Бера и при измерении оптической плотности (по сравнению с плотностью растворителя) график имеет вид прямой, проходящей через начало координат. Измеряют оптическую плотность исследуемого раствора Ax и по графику находят ис-
комую концентрацию Cx вещества в растворе.
2. Алгебраическим методом стандартного раствора – сравнивают по-
глощение исследуемого ( Ax ) и стандартного ( Aст ) растворов с известной концентрацией и рассчитывают Cx по формуле:
Cx = AxCст .
Аст
Измерения проводят с несколькими стандартными растворами, близкими по концентрациям к исследуемому, и усредняют значения Cx . Этот способ требует подчинения поглощения закону БЛБ.
10
