
Процесс каталитического крекинга
.pdf
СПБГУАП группа 4736 https://new.guap.ru/i03/contacts
ступенями в реакциях, предложенных для объяснения химии каталитического крекинга.
Как они могут быть приняты во внимание на основании структурной динамики,
предложенной в настоящей статье. Предполагается, что перераспределение протонов может происходить на поверхности катализатора с малыми структурными изменениями ɤ-
окси алюминия. Катализатор, представляющий в значительной мере сетку из кислородных ионов, может захватывать и переносить протоны приблизительно таким же образом, как это делает вода. Предполагается, что гидридный ион может аккомодироваться, как изображено в реакции (2). Шестикоординационно связанный ион алюминия представляет потенциальную льюисовскую кислоту. Парафиновые углеводороды, будучи слабыми льюисовскими основаниями, способны образовывать полярные комплексы с катализатором благодаря изменению координации иона алюминия. В этом случае вода не принимает участия в комплексе. Льюисовские кислоты, повидимому, играют существенную роль в алкилировании и изомеризации парафинов другими катализаторами [(HF)хH2SO4 и Аl2Х6].
Все эти катализаторы представляют потенциальные льюисовские кислоты: например HF,
S03, А1Х3 (мономер). Точное выяснение способа, каким катализатор осуществляет пере-
распределение протона и гидридного иона, представляет интересную и важную область дальнейшего исследования. Знание тонкой структуры ɤ-окси алюминия значительно осветило бы эти две проблемы. Авторы считают весьма вероятным, что в случае многих катализаторов реакций углеводородов, например катализаторов Фриделя — Крафтса,
сильных кислот, HF и H2SO4, окиси алюминия, алюмосиликата и т. п., перенос водорода осуществляется в форме протонов и гидридных ионов. Для осуществления этого требуется двойственный катализатор. Такой двойственный участок должен состоять из совокупно расположенных ионов, способных сосуществовать соответственно в виде бренстедовских и льюисовских кислот. Таким образом, реакции (1) и (2) должны происходить одновременно и на соседних участках. Третья реакция:
(3)
завершает перераспределение.
Для понимания изложенных идей катализа следует подчеркнуть обратимость
реакций (1) — (3). По мнению авторов, для каталитической активности важна способность
12
СПБГУАП группа 4736 https://new.guap.ru/i03/contacts
катализатора обратимо реагировать с субстратом при образовании полярного комплекса.
Если бы эти реакции не были легко обратимыми при температурах, при которых они проводятся, то вещество не было бы катализатором. Если принять во внимание относительную стабильность первичного, вторичного и третичного карбониевого иона, то акт изомеризации имеющегося первичного карбониевого иона в третичный должен приводить к образованию даже еще более прочного комплекса между субстратом и катализатором, чем первоначально образовавшийся. Следовательно, в этом случае измененный комплекс должен был бы десорбироваться труднее. Тенденция алюминия возвратиться обратно к шестикоординационному окружению представляет часть движущей силы десорбции. Вещества, образующие на участках с кислотами Льюиса или Бренстеда более прочные комплексы, чем реагирующее вещество, должны действовать как яды для данной рассматриваемой реакции. Вещества, подобные азотистым основаниям,
ионам щелочных металлов и т. п., при обычных температурах катализа связывают все доступные ионы алюминия в стабильную четырехкоординационную форму и, таким образом, действуют по отношению реакции как яды. Обратимость алюмосиликатных комплексов аналогична обратимости таких катализаторов, как галогениды алюминия,
фтористый бор, и даже сильных кислот — серной и фтористоводородной. Галогениды алюминия и фтористый бор имеют тенденцию возвращаться из четырехкоординационных комплексов к их обычной структурной -форме. Для того чтобы сильные кислоты, HF, H2SO4
и Н3Р04, могли действовать как катализаторы, они должны содержать немного воды. В этом случае движущую силу разложения комплекса представляет конкуренция воды кислотного катализатора л протона полярного комплекса.
В заключение авторы надеются, что развитые ими идеи окажутся приложимыми к гетерогенному катализу вообще. Катализатор окисного типа рассматривается ими как поверхность, ионы которой склонны к перемещениям в известных пределах. В собственном окружении ионы катализатора расположены в состоянии псевдостабильного равновесия. В
зависимости от катализатора некоторые вещества оказываются способными индуцировать структурные сдвиги атомов или ионов образующих поверхность компонентов, давая при этом комплексы, подвергающиеся реакции. Разложение комплекса представляет реакцию,
обратную только что описанной. Эти структурные изменения заключаются в изменении координации оперативно расположенных ионов. Хорошо известно, что для катализа до-
ступно очень немного ионов данного катализатора. Кажущаяся неоднородность поверхности катализатора реальна по той причине, что, как уже было объяснено, не все активные в отношении адсорбции ионы расположены в точности одинаковым способом.
Для динамического структурного изменения имеется распределение доступности,
13
СПБГУАП группа 4736 https://new.guap.ru/i03/contacts
следовательно, у одних поверхностных ионов оказывается более трудным вызвать
координационные изменения, чем у других.
14
СПБГУАП группа 4736 https://new.guap.ru/i03/contacts
4. К АТАЛИЗАТОРЫ ПРОЦЕССА КАТАЛИТИЧЕСКОГО КРЕКИНГА
Катализатором называется вещество, в присутствии которого течение химической реакции значительно ускоряется, а в некоторых случаях замедляется (отрицательный катализ).
Явление изменения скорости протекания химической реакции, вызываемое различными катализаторами, называется катализом. Различают однородный (гомогенный)
и неоднородный (гетерогенный) катализы. При неоднородном катализе катализатор и реагирующие вещества находятся в разных состояниях (фазах), при этом часто катализатор является твердым телом, а реагирующее вещество находится в жидкой или газовой фазе. К
последнему типу катализа относится и каталитический крекинг; иногда такие каталитические процессы называют контактными, а твердые катализаторы контактными веществами или просто контактами.
Сложные каталитические процессы могут протекать по нескольким возможным направлениям с образованием во многих случаях большого числа различных продуктов.
Преобладающее течение реакции по тому или иному направлению зависит от свойств применяемого катализатора, качества реагирующих веществ (сырья) и условий, при которых осуществляется процесс.
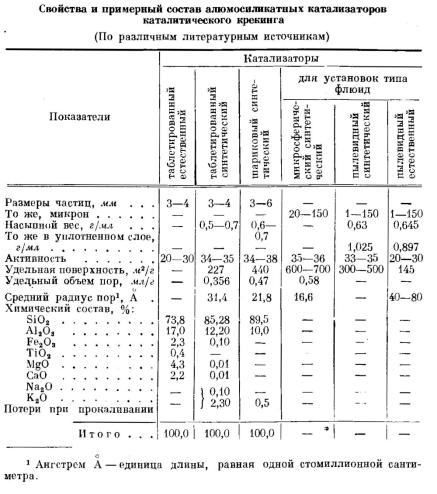
Для каталитического крекинга применяются алюмосиликатные катализаторы. Это природные или искусственно полученные твердые высокопористые вещества с сильно развитой внутренней поверхностью, изготовляемые в виде цилиндриков диаметром и высо-
той 3—4 мм пли в виде шариков диаметром 3—6 мм. К неформованным относятся пылевидные или порошкообразные катализаторы.
Основными компонентами алюмосиликатного катализатора являются окись алюминия А1203 и окись кремния Si02, кроме того, в небольших количествах в нем содержатся окислы кальция, магния, натрия и других металлов.
Катализатор работает не столько внешней поверхностью частиц (гранул), сколько внутренней (поверхностью пор); площадь всех пор достигает большой величины, для некоторых катализаторов до 600 м2 на 1 г катализатора. Наружная поверхность ката-
лизатора невелика по сравнению с развитой внутренней его поверхностью вследствие громадной пористости частиц катализатора.
В процессах каталитического крекинга с кипящим слоем употребляются микросферический катализатор с частицами размером 20—150 микрон и пылевидный с частицами размером 1—150 микрон из активного алюмосиликатного материала
15
СПБГУАП группа 4736 https://new.guap.ru/i03/contacts
Превращения ненасыщенных углеводородов с одной двойной связью — олефинов
(алкенов). Олефиновые углеводороды обнаруживают наибольшую реакционную способность в присутствии алюмосиликатных катализаторов.
Основным направлением превращения олефинов на алюмосиликатах при температурах каталитического крекинга является распад их с образованием насыщенных и ненасыщенных углеводородов С3, С4 и вышекипящих.
Одновременно с реакциями распада протекают реакции изомеризации олефинов.
Хорошо пзомеризуются олефины не только с открытой цепью, но также и циклического строения, прп этом склонность к изомеризации тем больше, чем выше молекулярный вес олефиновых углеводородов.
Кроме изомеризации, непредельные углеводороды, включая и свежеобразованные в процессе изоолефины, насыщаются водородом, выделяющимся при дегидрогенизации высокомолекулярных олефинов с образованием продуктов уплотнения, в том числе кокса на катализаторе. Экспериментально установлено, что при дегидрогенизации получается примерно 50% необходимого водорода.
Таким образом, каталитический крекинг непредельных углеводородов слагается из ряда последовательно и параллельно протекающих реакций, среди которых наибольшее значение имеют распад, изомеризация, перераспределение водорода, ароматизация,
полимеризация и конденсация.
Превращение парафиновых углеводородов (алканов). В сырье, поступающем на каталитический крекинг, содержится большое количество парафиновых углеводородов,
поэтому превращения их в присутствии алюмосиликатных катализаторов заслуживают особого внимания.
Насыщенные углеводороды парафинового ряда достаточно устойчивы в условиях каталитического крекинга. Трудность их разложения объясняется, невидимому, их слабой сравнительно с другими группами углеводородов адсорбцией на поверхности катализатора.
Скорость распада заметно увеличивается с увеличением молекулярного веса.
Наличие изоолефинов и изопарафинов в продуктах крекинга нормальных парафиновых углеводородов, вероятно, является следствием вторичных реакций превращения образовав-
шихся олефинов, так как непосредственной изомеризации метановых углеводородов, как отмечается в литературе, в присутствии алюмосиликатных катализаторов не происходит. К
вторичным реакциям следует также отнести и образование ароматических углеводородов,
содержание которых повышается по мере увеличения молекулярного веса исходного углеводорода и углубления процесса.
16
СПБГУАП группа 4736 https://new.guap.ru/i03/contacts
В заключение следует отметить, что снижение температуры реакции, при сохранении глубины общего превращения за счет других факторов процесса, приводит:
кполучению более насыщенных продуктов реакции, богатых углеводородами изостроения;
кувеличению отношения количества изобутана к количеству нормального бутана в газе и увеличению выхода изобутана;
кповышению выхода на прореагировавший углеводород кокса.
Превращение циклопарафинов — нафтеновых углеводородов (цикланов). Керосино-
соляровые дестиллаты, состоящие в основнов из нафтеновых углеводородов, являются наиболее ценным сырьем для каталитического крекинга. При переработке такого сырья образуется больше бензина и качество его лучше — более высокое октановое число при меньшем содержании непредельных углеводородов, в газе больше изобутана и меньше непредельных, чем в случае крекинга парафинистого дестиллята. При наличии боковой цени в молекуле углеводорода скорость распада увеличивается. При прочих одинаковых условиях скорость распада нафтенов быстро увеличивается по мере увеличения молекулярного веса.
Работами русских исследователей было показано, что в отличие от других катализаторов (окисных и металлических), приводящих к образованию только одного ароматического углеводорода, алюмосиликатный катализатор образует ряд ароматических углеводородов только с некоторым преобладанием ароматического углеводорода с тем же числом атомов углерода, что и у исходного нафтенового углеводорода.
Превращение ароматических углеводородов. Ароматические углеводороды под действием алюмосиликатного катализатора подвергаются разнообразным превращениям,
среди которых большое значение имеют реакции алкилирования и деалкилирования. В
условиях каталитического крекинга протекают главным образом реакции деалкилирования.
Введение в молекулы органических соединений углеводородных радикалов — алкилов, таких, например, как метил —СН3, этил — С2Н5 и т. д. называется алкилированнем.
Деалкилирование — процесс, обратный алкилированию. При деалкилировании от молекулы химического соединения отщепляются углеводородные радикалы.
В присутствии алюмосиликатного катализатора преимущественно происходит отрыв боковой цепи от бензольного ядра с образованием бензола и соответствующего непредельного углеводорода.
Наряду с деалкилированием происходят и реакции алкилирования. В основном происходит алкилирование бензола (образующегося в значительном количестве в процессе
17
СПБГУАП группа 4736 https://new.guap.ru/i03/contacts
деалкилирования) низшими олефинами, получающимися при термическом распаде углеводородного сырья в присутствии алюмосиликатного катализатора.
Этим в основном и объясняется малое содержание бензола в бензине каталитического крекинга.
Кроме того, в процессе превращения ароматических углеводородов существенную роль играют реакции перераспределения водорода и конденсации. При крекинге ароматических углеводородов кокса образуется значительно больше, чем при крекинге парафиновых или нафтеновых углеводородов.
Типы катализаторов
В нефтяной промышленности для каталитического крекинга применяются алюмосиликатные катализаторы следующих типов.
1) Природные катализаторы в естественном виде или активированные кислотой специальные глины в виде цилиндриков размерами 3—4 мм. Такие катализаторы широко применяются при крекинге тяжелого сырья для получения автомобильных бензинов с высоким октановым числом (до 78 пунктов но моторному методу).
Эти катализаторы просты в изготовлении и сравнительно недороги .
2) Синтетические алюмосиликатные катализаторы в виде шариков диаметром 3—6
мм. Обладают повышенной активностью. Применяются в системах каталитического крекинга с неподвижным и циркулирующим катализатором. Стоимость их значительно выше естественных, но ниже синтетических таблетированных катализаторов.
3) Синтетические алюмосиликатные катализаторы в виде цилиндриков размером
3—4 мм. Эти катализаторы обладают недостаточной механической прочностью и используются в системах каталитического крекинга с неподвижным слоем катализатора.
Таблетированный катализатор, даже из систем с неподвижным катализатором,
вытесняется шариковым синтетическим, который имеет следующие преимущества:
а) легкость удаления из реакторов вследствие лучшей сыпучести;
б) повышенную механическую прочность и в связи с этим меньшее пылеобразование;
в) более низкую стоимость.
4) Синтетические алюмосиликатные катализаторы — микросферические и пылевидные (частицы диаметром преимущественно от 20 до шарикового алюмосиликатных катализаторов. 100 микрон). Специально изготавливается син-
тетический микросферический катализатор, а пылевидный является отходом установок
18
СПБГУАП группа 4736 https://new.guap.ru/i03/contacts
каталитического крекинга и катализаторных фабрик или в некоторых случаях его получают путем измельчения и рассева крупных гранул алюмосиликатного катализатора.
5) Природные активированные порошкообразные катализаторы.
Синтетические микросферический и порошкообразные, а также естественные пылевидные катализаторы щироко применяются в процессах каталитического крекинга в кипящем слое.
Синтетический катализатор содержит больше кремния и меньше алюминия, железа и кальция, чем естественный. Химический состав катализаторов, применяемых на установках типа «флюид», близок к составу соответствующих шариковых и таблетированных катализаторов.
Синтетический алюмосиликатный катализатор отличается от естественных главным образом более высокой термостойкостью и активностью, а также аморфной структурой
(естественный катализатор имеет кристаллическую структуру).
Ниже рассмотрим основные свойства алюмосиликатных катализаторов для каталитического крекинга нефтяного сырья.
19
СПБГУАП группа 4736 https://new.guap.ru/i03/contacts
Активность катализатора
Основной характеристикой катализатора является его каталитическая активность, т.
е. способность катализатора ускорять реакции превращения исходного сырья в целевые продукты. При каталитическом крекинге нефтяных дестиллятов таким целевым продуктом является бензин, выходом которого и принято оценивать каталитическую активность катализатора. Для свежих синтетических катализаторов эта активность обычно находится в пределах 34—35% вес. бензина (выкипающего до 200°) на сырье, а для естественных катализаторов она ниже — от 20 до 30%.
Активность катализатора зависит от его физико-химических свойств: строения,
химического состава и т. д. Свойства синтетического катализатора зависят не только от качества применяемого для его изготовления сырья, но и от способа производства катали-
затора. Для естественных катализаторов состав исходной породы также оказывает существенное влияние на каталитическую активность. Некоторые глины (каолин) обладают высокой каталитической активностью к реакциям перераспределения водорода. Актив-
ность других глин значительно повышается после их активации кислотами.
Образованная порами внутренняя поверхность, так же как и наружная, активна.
Между активностью катализатора и его удельной поверхностью имеется прямая связь: чем больше удельная поверхность, тем выше активность и наоборот.
Следует выбирать катализаторы, структура которых допускает достаточно легкое проникновение молекул углеводородов в глубину пор. При этом надо иметь в виду, что чем больше размер частиц катализатора, тем длиннее путь молекул сырья к отдаленным глубинным порам катализатора.
Активность катализатора, содержание кокса на котором достигло примерно 13%,
падает до нуля. Для поддержания достаточной скорости крекинга, обеспечивающей требуемую глубину разложения желательно, чтобы содержание кокса на катализаторе,
выходящем из реактора, не превышало 1,5—1,8%.
Избирательность катализатора
Способность катализатора увеличивать скорости одних (желательных) реакций и в то же время сохранять неизменными скорости других (нежелательных) реакций называется избирательностью (селективностью).
20
СПБГУАП группа 4736 https://new.guap.ru/i03/contacts
Избирательность катализатора каталитического крекинга нефтяных дестиллятов определяется отношением выхода бензина к выходу кокса и газа или в отдельных случаях отношением выхода кокса или газа при работе на данном катализаторе к выходу кокса или газа при работе на стандартном катализаторе при тех же условиях процесса и степени превращения сырья. После некоторого времени работы соотношение между выходами бензина и кокса уменьшается, например, для одного из образцов синтетического катализатора на 20—23% (с 17,5—18,9 до 14—14,6) и для естественных приблизительно на
51% (с 13,7 до 6,75), в зависимости от длительности работы и условий процесса.
Примерно в такой же степени снижается и отношение выхода бензина к выходу газа. Отсюда видно, что избирательность естественного катализатора падает значительно сильнее, чем синтетического.
Старение катализаторов
Впроцессе работы установки каталитического крекинга катализатор, находящийся
всистеме, теряет активность, и избирательность его ухудшается — происходит старение катализатора. Существуют два вида старения катализатора: нормальное старение с постепенным снижением активности катализатора, но без существенного изменения его избирательности, и ненормальное, сопровождающееся резким ухудшением избирательности катализатора.
Нормальное старение не устранимо. Оно ускоряется с увеличением жесткости условий нроцесса и объясняется в первую очередь действием высоких температур и водяного пара.
Основными причинами ненормального старения являются: 1) действие на катализатор некоторых газов при высокой температуре — аммиака, сернистого газа и особенно сероводорода; 2) влияние на свойства катализатора ряда сернистых соединений,
особенно тех, из которых в условиях каталитического крекинга образуются сероводород и сернистый газ; 3) накопление на катализаторе окислов металлов (железа, меди, никеля,
ванадия, натрия и др.), содержащихся в виде примесей в сырье; 4) действие на катализатор высокой температуры и водяного пара при высокой температуре.
Газы по своему действию на катализаторы разделяются на три группы:
инертные, не действующие на катализатор при температуре ниже 620°С, —
окись углерода, углекислый газ и аммиак;
снижающие активность катализатора без изменения избирательности —
водяной пар;
21
