
Ацилирование и алкилирование аминов
.pdf
СПБГУАП группа 4736 https://new.guap.ru/i03/contacts
Содержание
1. Введение
. Ацилирование и алкилирование аминов Амины: номенклатура, классификация, применение Химические свойства аминов Основные и кислотные свойства Реакции ацилирования Реакции алкилирования
Ацилирование и алкилирование по Фриделю-Крафтсу Взаимодействие аминов с азотистой кислотой Методы получения аминов Алкилирование аммиака и аминов
Восстановление азотсодержащих органических соединений Перегруппировка Гофмана Биологически активные амины и их производные
СПБГУАП группа 4736 https://new.guap.ru/i03/contacts
Акридон: получение, свойства и применение
9-аминоакридин: получение, свойства и применение
Заключение
Список литературы
СПБГУАП группа 4736 https://new.guap.ru/i03/contacts
1. Введение
Амины - производные аммиака, в молекуле которого один, два или три атома водорода заметены углеводородными радикалами. По числу замешенных атомов водорода они делятся на первичные, вторичные и третичные амины.
Существуют и четвертичные аммониевые соли, например хлорид тетраметиламония, соответствующее ему основание - гидроксид тетраметиламмония, который представляет собой сильное основание,
аналогичное щелочных металлов, так как связь с гидроксильной группой здесь ионная [10].
В зависимости от природы углеводородных радикалов амины подразделяются на алифатические, алициклические, ароматические и смешанные (имеющие алифатический и ароматический радикалы). Эти соединения отличаются друг от друга строением углеводородных радикалов.
Названия простых по строению аминов образуют от названий соответствующих углеводородных радикалов, связанных с атомом азота,
добавляя в конце корень-амин. Кроме того, ароматические амины имеют тривиальные названия.
Химические свойства аминов определяются в основном присутствием атома азота с неподеленной парой электронов, наличие которой обуславливает их основные и нуклеофильные свойства.
Нуклеофильность и основность аминов изменяются, как правило,
симбатно: они уменьшаются с уменьшением электроннной плотности на атоме азота или при его пространственном экранировании и увеличиваются с увеличением электронной плотности на атоме азота или с увеличением его доступности.
Амины, чаще в виде полифункциональных производных, находят применение, являясь обычно полупродуктами в органических синтезах.
Получаются с применением аминов такие лекарственные препараты, как
СПБГУАП группа 4736 https://new.guap.ru/i03/contacts
новокаин, спазмолитин, парацетамол, сульфаниламидные препараты [1].
Широко амины и их производные применяется в производстве инсектицидов, фунгицидов, ускорителей вулканизации, поверхностно-
активных веществ, красителей, ракетных топлив, растворителей и т.д.
Все выше сказанное подтверждает актуальность темы представленной работы.
Цель работы: изучить реакции ацилирования и алкилирования аминов.
Для достижения поставленной цели были определены следующие задачи:
. Рассмотреть общую характеристику аминов.
. Рассмотреть химические свойства аминов.
. Проанализировать методы получения аминов.
. Дать характеристику биогенным аминам.
. Представить получение, свойства и применение 9-аминоакридина.
СПБГУАП группа 4736 https://new.guap.ru/i03/contacts
2. Ацилирование и алкилирование аминов
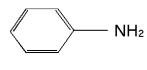
Амины: номенклатура, классификация, применение
Аминами называются органические производные аммиака, в котором один, два или все три атома водорода замещены на углеводородные
радикалы (предельные, непредельные, ароматические).
Название аминов производят от названия углеводородного радикала с
добавлением окончания -амин или от названия соответствующего
углеводорода с приставкой амино-.
Примеры приведена на Рис. 1:
- NH2 |
CH3 - NH - C2H5 |
|
метиламин |
метилэтиламин |
метилдифениламин |
фениламин (анилин)
Рис. 1. Примеры полуструктурных формул аминов и их названия
В зависимости от числа атомов водорода, замещенных в аммиаке на углеводородные радикалы, различают первичные, вторичные и третичные амины (Рис. 2):
|
|
RNH2 |
R - |
NH - R’ |
R - N - R” |
|
|
первичный амин вторичный амин |
третичный амин |
|
|
Рис. 2. Классификация аминов. R, R’, R’’ - углеводородные радикалы
СПБГУАП группа 4736 https://new.guap.ru/i03/contacts
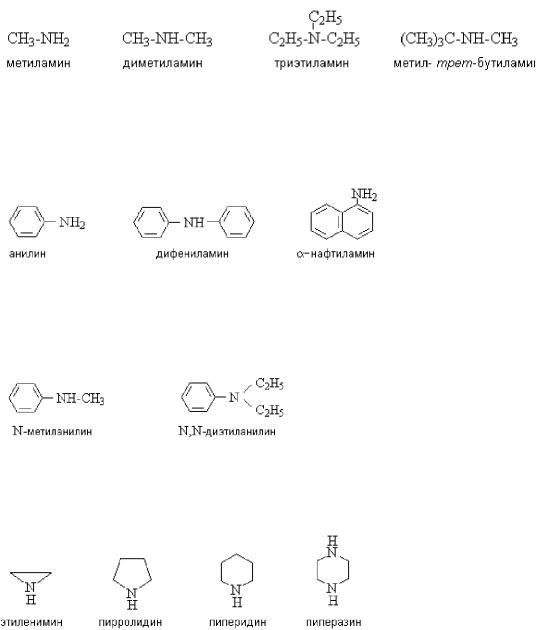
Алкиламины содержат только алифатические углеводородные радикалы, например (Рис. 3):
Рис. 3. Примеры алкиламинов
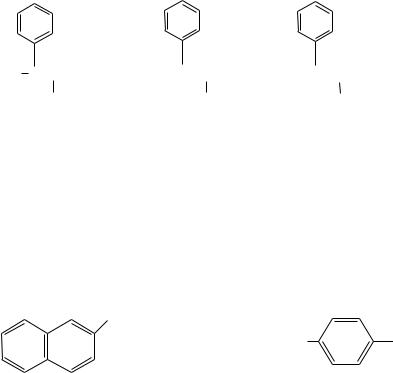
Ариламины содержат ароматические радикалы с атомом азота в ароматическом кольце, например (ри№с. 4):
Рис. 4. Примеры ариламинов
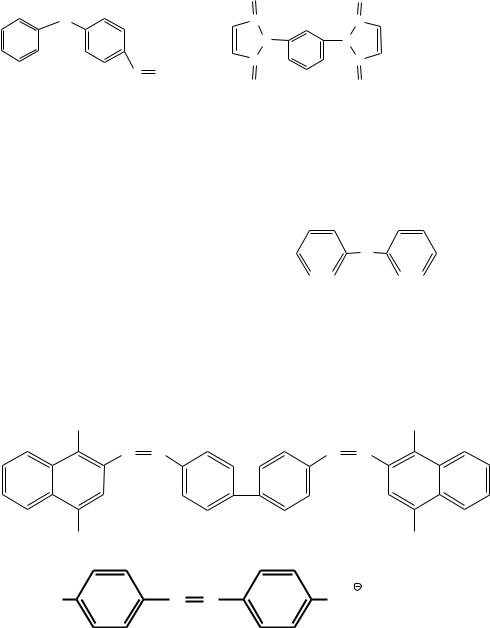
Алкилариламины содержат алифатические и ароматические радикалы, например (Рис. 5):
Рис. 5. Примеры алкилариламинов
Гетероциклические амины содержат азот в цикле, например (Рис. 6):
Рис. 6. Примеры гетероциклических аминов Амины, чаще в виде полифункциональных производных, находят
применение, являясь обычно полупродуктами в органических синтезах. Получаются с применением аминов такие лекарственные препараты, как новокаин, спазмолитин, парацетамол, сульфаниламидные препараты [5].
Широкое применение нашли соединения с упрощенной адреналиновой структурой, такие, как эфедрин, амфетамин, первитин и т.д. (Рис. 7)
СПБГУАП группа 4736 https://new.guap.ru/i03/contacts
HO CHCHNHCH |
CH CHNH |
2 |
CH CHNHCH |
3 |
3 |
2 |
2 |
||
CH |
CH |
|
CH |
|
3 |
3 |
|
3 |
|
a |
b |
|
c |
|
Рис. 7. Формулы эфедрина (а), амфетамина (b), первитина (с)
Эти соединения, обладая структурой близкой к структуре адреналина, оказывают стимулирующее, возбуждающее действие, но более сильное и продолжительное.
Амины широко используются в качестве термо- и светостабилизаторов
(Рис. 8):
NHC H |
5 |
|
|
|
6 |
|
|
|
|
|
(C H ) |
N |
NH |
|
|
6 |
5 2 |
|
2 |
неозон D |
N,N-дифенил-n-фенилен- |
|
диамин |
||
|
Рис. 8. Формулы представителей аминов термо- и светостабилизаторов
Амины могут выступать в роли модификаторов резин и как вулканизирующие агенты (Рис. 9):
СПБГУАП группа 4736 https://new.guap.ru/i03/contacts
|
O |
O |
H |
|
|
N |
C |
C |
|
N |
N |
|
C |
C |
N |
O |
|
|
O |
O |
дифенам 4H |
|
малеимид Ф |
Рис. 9. Формулы представителей аминов модификаторов резин и вулканизирующие агенты
Мономеры для синтеза полиамидов (Рис. 10):
H2NCH2CH2CH2CH2CH2CH2NH2 |
H2N |
|
|
|
O |
|
|
|
NH2 |
|
|
|
|
|
|||||
гексаметилендиамин |
|
|
|
|
|
|
|
|
|
ди(n-аминофениловый) эфир |
|||||||||
Рис. 10. Формулы представителей аминов мономеров для синтеза полиамидов
Амины могут быть использованы и как красители (Рис. 11):
NH |
|
|
NH |
2 |
|
|
2 |
N |
N |
N |
N |
|
SO Na |
|
|
SO Na |
|
3 |
|
конго красный |
3 |
|
|
|
|
|
(H C) N |
N |
N |
SO |
|
3 |
2 |
|
|
3 |
|
|
метилоранж |
|
|
Рис. 11. Формулы представителей аминов красителей
Фотореактивы (Рис. 12):

СПБГУАП группа 4736 https://new.guap.ru/i03/contacts
OH |
OH |
OH |
NH |
|
|
|
2 |
|
|
|
NH |
|
|
|
2 |
NH |
NHCH |
NH |
N(C H ) |
||
2 |
3 |
2 |
2 |
5 2 |
|
n-аминофенол |
метол |
амидол |
N,N-диэтил-n- |
||
фенилендиамин |
|||||
|
|
|
|||
Рис. 12. Формулы представителей аминов фотореактивов
Метиламин применяется в производстве инсектицидов, фунгицидов, ускорителей вулканизации, поверхностно-активных веществ, красителей, ракетных топлив, растворителей.
Триэтиламин применяется в производстве ускорителей вулканизации, ингибиторов коррозии, растворитель.
Анилин: производство N,N-диметиланилина, дифениламина, лекарственных средств, антиоксидантов, ускорителей вулканизации и фотоматериалов.
Некоторые амины применяются как селективные растворители для извлечения урана из сернокислых растворов. Амины, обладающие запахом рыбы, используются как приманка в борьбе с полевыми грызунами.
Третичные амины и соли четвертичных аммониевых оснований получили широкое распространение в качестве катализаторов межфазного переноса в органическом синтезе [2,3].
Химические свойства аминов
Химические свойства аминов определяются в основном присутствием атома азота с неподеленной парой электронов, наличие которой обуславливает их основные и нуклеофильные свойства.
СПБГУАП группа 4736 https://new.guap.ru/i03/contacts
2.2.1 Основные и кислотные свойства
Алифатические амины являются сильными основаниями (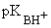 = 1011) и превосходят по основности аммиак. Их водные растворы имеют щелочную реакцию:
= 1011) и превосходят по основности аммиак. Их водные растворы имеют щелочную реакцию:
+ H2O → RNH3+ + OH - (1)
Ароматические амины - слабые основания (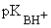 = 3-5), что связано с разрушением при протонированиии стабильной сопряженной системы, в которой участвует неподеленная пара электронов азота (см. лек. №4).
= 3-5), что связано с разрушением при протонированиии стабильной сопряженной системы, в которой участвует неподеленная пара электронов азота (см. лек. №4).
При взаимодействии с кислотами амины образуют растворимые в воде аммониевые соли:
+ HX → RNH3+ X - (2)
Первичные и вторичные амины являются слабыми N-H кислотами (рКа=33-35) и образуют соли при взаимодействии с активными металлами:
+ Na → RNHNa+ + 1/2 H2 (3)
Характер групп, находящихся у атома азота, оказывает большое влияние на основность амина. Обычно алифатические амины, являются сильными основаниями, обладают щелочной реакцией на лакмус и во влажном состоянии поглощают двуокись углерода. Низшие алифатические амины являются, более сильными основаниями, чем аммиак, и титруются кислотами в присутствии метилоранжа или бромфенолблау в качестве индикатора. При наличии ароматического остатка основность аминов выражена значительно слабее; например, анилин и его гомологи, хотя и образуют соли с разбавленными минеральными кислотами, однако не дают щелочной реакции на лакмус и не поглощают двуокись углерода из воздуха. Титрование таких аминов кислотой в присутствии обычных индикаторов не дает удовлетворительных результатов. Напротив, солянокислые соли ароматических аминов легко титруются водным раствором щелочи в присутствии фенолфталеина, т.е. ведут себя в этих условиях, как свободные кислоты. При увеличении числа ароматических радикалов у атома азота наблюдается еще большее уменьшение основности амина. Соли дифениламина гидролизуются в воде в значительной степени с частичным выделением свободного основания. Трифениламин является нейтральным соединением и не образует солей, за исключением комплексного соединения с хлорной кислотой.
Хотя введение нитрогруппы в ядро анилина заметно понижает его основность, нитранилины все же еще обладают основным характером и дают соли с минеральными кислотами, которые, однако, очень легко, гидролизуются при действии воды. Введение более одной нитрогруппы в ядро ведет к дальнейшему понижению основности; действительно, иолинитрамины проявляют лишь незначительную склонность к образованию солей. То же относится и к галоидозамещенным аминам [2].
