
Ацилирование и алкилирование аминов
.pdf
СПБГУАП группа 4736 https://new.guap.ru/i03/contacts
Самым распространенным катализатором этой реакции является предварительно сублимированный хлористый алюминий.
Например, механизм реакции бензилирования хлористым бензилом в нитробензоле в присутствии безводного AlCl3 в качестве катализатора следующей схемой (Рис. 32):
Рис. 32. Механизм реакции бензилирования, где В: =AlCl4-; H2O или др. основание. Скорость реакции лимитируется второй стадией
Точное строение интермедиата неизвестно. В принципе, можно представить целый ряд структур от молекулярного комплекса до диссоциированных карбокатионов (Рис. 33):
Рис. 33. Строение интермедиата
Участие свободных карбокатионов как алкилирующих агентов маловероятно.
Если бы алкилирующими агентами были свободные карбокатионы, то медленной стадией была бы стадия их образования (k1), а реакция с аренами была бы быстрой и третьего порядка не должно было наблюдаться. Крайне маловероятно, что алкилирующим агентом является молекулярный комплекс. При низких температурах иногда удается выделить комплексы алкилгалогенидов с кислотами Льюиса. Для них характерен медленный обмен галогенов по схеме (Рис. 34):
Рис. 34. Получение комплексов алкилгалогенидов с кислотами Льюиса
Скорость обмена возрастает в ряду перв.R< втор.R<трет.R, что можно объяснить и ион-парным строением, и структурой координационного аддукта.
Многие исследователи, работающие в данной области, полагают, что строение комплексов RX. MXn постепенно изменяется от структуры координационного аддукта в случае R=СН3 до структуры ионной пары в случае R=t-Bu, однако экспериментально это пока не подтверждено.
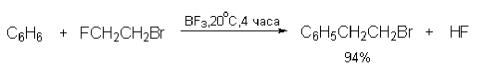
СПБГУАП группа 4736 https://new.guap.ru/i03/contacts
Способность атома галогена в RX к комплексообразованию с AlCl3 или другой жесткой кислотой Льюиса резко уменьшается от фтора к иоду, вследствие этого активность алкилгалогенидов в качестве алкилирующих агентов в реакции Фриделя-Крафтса также уменьшается в ряду RF>RCl>RBr>RI. По этой причине алкилиодиды не применяют в качестве алкилирующего агента.
Различие в активности алкилфторидов и алкилбромидов настолько велико, что позволяет селективно замещать фтор в присутствии брома в одной и той же молекуле (Рис. 35) [3]:
Рис. 35. Различие в активности алкилфторидов и алкилбромидов
Взаимодействие аминов с азотистой кислотой Первичные, вторичные и третичные амины по-разному
взаимодействуют с азотистой кислотой, что используется для установления типа амина. Неустойчивую азотистую кислоту генерируют действием сильной кислоты на нитриты.
Третичные алифатические амины при обычной температуре с азотистой кислотой не взаимодействуют.
Вторичные амины образуют с азотистой кислотой устойчивые нитрозамины - жидкие или твердые продукты желтого цвета:
NH + NaNO2 + HCl → R2N-N=O + NaCl + H2O (12)
Нитрозамины являются сильными канцерогенами. Показана возможность синтеза нитрозаминов в желудке человека из содержащихся в пище и лекарственных препаратах вторичных аминов и нитритов Канцерогенное действие нитрозаминов основано на их способности алкилировать нуклеофильные центры ДНК, что приводит к онкогенным мутациям.
Первичные алифатические амины реагируют с азотистой кислотой с выделением газообразного азота. Реакция идет через образование неустойчивого первичного нитрозамина, который изомеризуется в диазогидроксид, превращающийся далее в соль диазония:
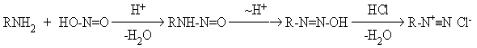 (13)
(13)
Дальнейший ход реакции зависит от природы углеводородного радикала.
Если R - алифатический радикал, то соль диазония очень неустойчива и немедленно разлагается с образованием молекулы азота и карбокатиона,

СПБГУАП группа 4736 https://new.guap.ru/i03/contacts
который затем взаимодействует с находящимися в реакционной среде нуклеофилами (например, с растворителем) или отщепляет протон и дает продукт элиминирования. Например, превращения катиона н- пропилдиазония могут быть представлены следующей схемой (Рис. 36):
Рис. 36. Превращение катиона н-пропилдиазония
Реакция не имеет препаративного значения. Процесс используется в аналитических целях для количественного определения первичных алифатических аминов, в том числе природных α-аминокислот, по объему выделяющегося азота.
Соли арилдиазония более устойчивы и могут быть выделены из реакционной смеси. Они являются высокореакционноспособными соединениями и широко используются в органическом синтезе.
Процесс получения ароматических диазосоединений называется диазотированием и выражается следующим суммарным уравнением. + NaNO2 + 2HCl → ArN2+Cl- + NaCl + 2H2O (14)
Реакции солей арилдиазония можно разделить на два типа: реакции с выделением азота и реакции без выделения азота.
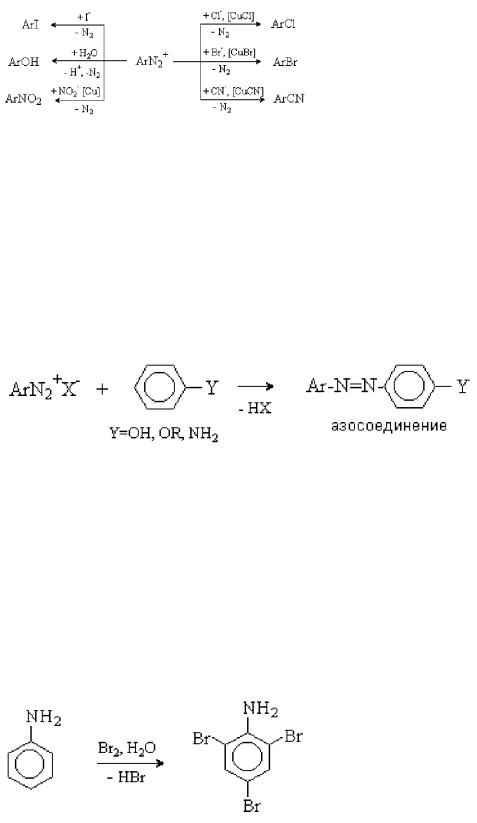
Реакции, протекающие с выделением азота. Этот тип реакций представляет собой замещение в ароматическом кольце, уходящей группой в котором является молекула азота N2 (Рис. 37):
СПБГУАП группа 4736 https://new.guap.ru/i03/contacts
Рис. 37. Реакции солей арилдиазония
Реакции используются для введения различных заместителей в ароматическое кольцо.
Реакции, протекающие без выделения азота. Наиболее важной реакцией этого типа является азосочетание. Катион диазония обладает слабыми электрофильными свойствами и вступает в реакции электрофильного замещения с аренами, содержащими сильные электронодонорные заместители. При этом образуются азосоединения (Рис.
38):
Рис. 38. Реакции азосочетания
Азосоединения содержат длинную систему сопряженных связей и поэтому окрашены. Они используются как красители. Образование окрашенных соединений при взаимодействии солей арилдиазония с ароматическими аминокислотами (тирозин, гистидин) используется для их качественного и количественного определения.
Аминогруппа является сильным активирующим заместителем и ориентантом II рода.
Анилин легко бромируется бромной водой с образованием триброманилина (Рис. 39):
Рис. 39. Реакция бромирования анилина
В большинстве реакций электрофильного реакционноспособная аминогруппа предварительно защищается путем ацилирования. После проведения реакции ацильную защиту снимают кислотным или щелочным гидролизом (Рис. 40) [1]:

СПБГУАП группа 4736 https://new.guap.ru/i03/contacts
Рис. 40. Реакция ацилирования
Методы получения аминов
Алкилирование аммиака и аминов
Аммиак взаимодействуют с алкилгалогенидами RX с образованием на первой стадии соли алкиламмония, которая с избытком аммиака дает алкиламин. Алкиламин, будучи более сильным нуклеофилом, чем аммиак, далее вступает в реакцию алкилгалогенидом с образованием продукта диалкилирования. Таким образом образуется смесь моно-, ди-, триалкиламинов и четвертичной аммониевой соли (Рис. 41):

СПБГУАП группа 4736 https://new.guap.ru/i03/contacts
Рис. 41. Реакции с алкилгалогенидом
Спирты алкилируют аммиак и амины в присутствии катализаторов дегидратации (Al2O3, SiO2) при 300-5000C. В этом случае также образуется смесь продуктов алкилирования (Рис. 42) [10]:
Рис. 42. Алкилирование аммиака и аминов спиртами
Восстановление азотсодержащих органических соединений Нитросоединения могут быть восстановлены до первичных аминов.
Реакция используется в основном для получения первичных ароматических аминов из доступных нитроаренов:
 ArNH2 (15)
ArNH2 (15)
В качестве восстановителей используют водород в присутствии катализаторов (Ni, Pt, Pd), металл (Fe, Zn, Sn) и кислоту, соли металлов в низших степенях окисления (SnCl2, TiCl3).
Нитрилы при восстановлении также дают первичные амины (Рис. 43):
СПБГУАП группа 4736 https://new.guap.ru/i03/contacts
RCN  RCH2NH2 [H]: H2/Ni; LiAlH4
RCH2NH2 [H]: H2/Ni; LiAlH4
Рис. 43. Восстановление нитрилов
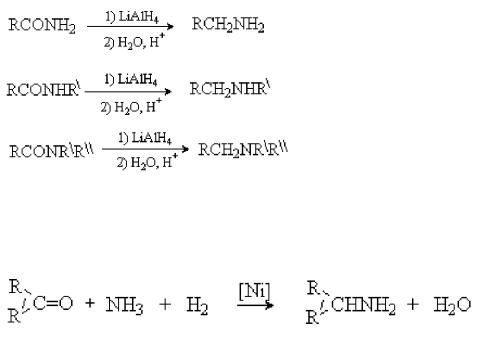
Амиды карбоновых кислот восстанавливаются до аминов комплексными гидридами металлов. Из соответствующих амидов могут быть получены первичные, вторичные и третичные амины (Рис. 44):
Рис. 44. Восстановление амидов карбоновых кислот
Восстановительное аминирование альдегидов и кетонов (Рис. 45) [3]:
Рис. 45. Восстановительное аминирование альдегидов и кетонов
Перегруппировка Гофмана
+ Br2 + 2NaOH → RNH2 + 2NaBr + CO2 + H2O (16)
Используется для получения первичных аминов [2].
СПБГУАП группа 4736 https://new.guap.ru/i03/contacts
2.4 Биологически активные амины и их производные
Биологическую активность проявляют гетерофункциональные соединения, содержащие аминогруппу - аминокарбоновые кислоты, аминоспирты, аминофенолы, аминосульфокислоты.
К ним можно отнести гормоны надпочечников (норадреналин, адреналин), щитовидной железы (тироксин, трийодтиронин), а также медиаторы ЦНС (ацетилхолин, ГАМК и др.), медиатор воспаления (гистамин) и другие соединения.
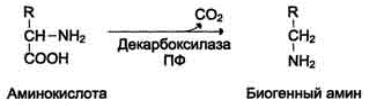
Некоторые аминокислоты и их производные могут подвергаться декарбоксилированию - отщеплению карбоксильной группы. В тканях млекопитающих декарбоксилированию может подвергаться целый ряд аминокислот или их производных: Три, Тир, Вал, Гис, Глу, Цис, Apr, Орнитин, SAM, ДОФА, 5-окситриптофан и др. Продуктами реакции являются СО2 и амины, которые оказывают выраженное биологическое действие на организм (биогенные амины) (Рис. 46):
Рис. 46. Реакция получения биогенных аминов
Реакции декарбоксилирования необратимы и катализируются ферментами декарбоксилазами. Простетическая группа декарбоксилаз в клетках животных - пиридоксальфосфат. Некоторые декарбоксилазы микроорганизмов могут содержать вместо ПФ остаток пирувата - гистидиндекарбоксилаза Micrococcus и Lactobacilus, SAM-декарбоксилаза Е. coli и др. Механизм реакции напоминает реакцию трансаминирования с участием пиридоксальфосфата и также осуществляется путём формирования Шиффова основания и аминокислоты на первой стадии.
Амины, образовавшиеся при декарбоксилировании аминокислот, часто являются биологически активными веществами. Они выполняют функцию нейромедиаторов (серотонин, дофамин, ГАМК и др.), гормонов (норадреналин, адреналин), регуляторных факторов местного действия (гистамин, карнозин, спермин и др.).
Этаноламин (коламин) HOCH2CH2NH2 является структурным компонентом сложных липидов. В организме образуется при декарбоксилировании аминокислоты серина [9].
Холин HOCH2CH2N+(CH3)2 - гидроокись 2-
оксиэтилтриметиламмония. Относят к витаминам группы В, хотя животные и микроорганизмы способны его синтезировать. Холин входит в состав фосфолипидов (например, лецитина, сфингомиелина), служит источником метильных групп в синтезе метионина. Из холина в организме животных
СПБГУАП группа 4736 https://new.guap.ru/i03/contacts
синтезируется ацетилхолин - один из важнейших химических передатчиков нервных импульсов. Холин является т.н. липотропным веществом - предотвращает тяжёлые заболевания печени, возникающие при её жировом перерождении.
Холин - в медицине для лечения заболеваний печени применяют хлорид холина. Его вводят также в состав комбикормов сельскохозяйственным животных. Для аналитических целей используют способность холина давать плохо растворимые соли с фосфорновольфрамовой, платинохлористоводородной и некоторыми др. гетерополикислотами.
Ацетилхолин CH3COOCH2CH2N+(CH3)2 - посредник при передаче нервных импульсов (нейромедиатор). Накопление ацетилхолина в организме приводит к непрерывной передаче нервных импульсов и сокращению мускульной ткани. На этом основано действие нервнопаралитических ядов (зарин,табун), которые ингибируют действие фермента ацетилхолинэстеразы, катализирующего расщепление ацетилхолина.
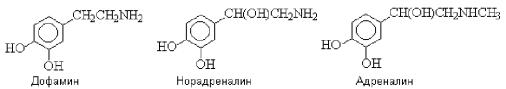
Катехоламины - дофамин, норадреналин, адреналин - биогенные амины, продукты метаболизма аминокислоты фенилаланина (Рис. 47):
Рис. 47. Формулы катехоламинов
Дофамин обладает рядом физиологических свойств, характерных для адренергических веществ.
Дофамин вызывает повышение сопротивления периферических сосудов (менее сильное, чем под влиянием норадреналина). Он повышает систолическое артериальное давление в результате стимуляции α- адренорецепторов. Также дофамин увеличивает силу сердечных сокращений в результате стимуляции β-адренорецепторов. Увеличивается сердечный выброс. Частота сердечных сокращений увеличивается, но не так сильно, как под влиянием адреналина.
Потребность миокарда в кислороде под влиянием дофамина повышается, однако в результате увеличения коронарного кровотока обеспечивается повышенная доставка кислорода.
В результате специфического связывания с дофаминовыми рецепторами почек дофамин уменьшает сопротивление почечных сосудов, увеличивает в них кровоток и почечную фильтрацию. Наряду с этим повышается натрийурез. Происходит также расширение мезентериальных сосудов. Этим действием на почечные и мезентериальные сосуды дофамин отличается от других катехоламинов (норадреналина, адреналина и др.). Однако в больших концентрациях дофамин может вызывать сужение почечных сосудов.
СПБГУАП группа 4736 https://new.guap.ru/i03/contacts
Дофамин ингибирует также синтез альдостерона в коре надпочечников, понижает секрецию ренина почками, повышает секрецию простагландинов тканью почек.
Основной физиологический эффект мелатонина заключается в торможении секреции гонадотропинов. Кроме того, снижается, но в меньшей степени, секреция других тропных гормонов передней доли гипофиза - кортикотропина, тиротропина, соматотропина.
Секреция мелатонина подчинена суточному ритму, определяющему, в свою очередь, ритмичность гонадотропных эффектов и половой функции. Синтез и секреция мелатонина зависят от освещённости - избыток света тормозит его образование, а снижение освещённости повышает синтез и секрецию гормона [3,5].
Серотонин - это вещество, являющееся химическим передатчиком импульсов между нервными клетками человеческого мозга и контролирующее аппетит, сон, настроение и эмоции человека.
Серотонин «руководит» очень многими функциями в организме. Например, очень интересны исследования его влияния на проявление боли. Доктором Виллисом доказано, что при снижении серотонина повышается чувствительность болевой системы организма, то есть даже самое слабое раздражение отзывается сильной болью.
Катехоламины - физиологически активные вещества, выполняющие роль химических посредников в межклеточных взаимодействиях.
Адреналин оказывает стимулирующее воздействие на ЦНС. Он повышает уровень бодрствования, психическую энергию и активность, вызывает психическую мобилизацию, реакцию ориентировки и ощущение тревоги, беспокойства или напряжения, гегенируется при пограничных ситуациях.
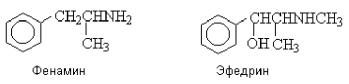
Структурно близки к катехоламинам некоторые природные и синтетические биологически активные вещества, также содержащие аминогруппу в b-положении к ароматическому кольцу (Рис. 48):
Рис. 48. Формулы фенамина и эфедрина
Фенамин является стимулятором центральной нервной системы, снимает чувство усталости. Эфедрин - алкалоид, обладающий сосудорасширяющим действием.
Производные п-аминофенола - парацетамол и фенацетин - лекарственные препараты, обладающие обезболивающим и жаропонижающим действием (Рис. 49):
