
- •2. Гликопротеины и протеогликаны: химические и структурные различия и ихфункции. Липопротеины, классификация, химический состав, структурная организация, функциональная активность.
- •3. Гемопротеины. Миоглобин, структурная организация, строение гема, глобина. Роль миоглобина. Гемоглобины, структурная организация.
- •4. Флавопротеины, фосфопротеины, металлопротеины, нуклеопротеины: организация, строение, биологическое значение, представители.
- •5. Ферменты. Химическая природа и структурная организация ферментов. Активный центр фермента. Механизм действия ферментов. Специфичность действие ферментов.
- •6. Факторы, влияющие на активность ферментов. Ферментативные эффекторы (активаторы и ингибиторы). Виды ингибирования. Применения лекарств — ингибиторов ферментов (примеры).
- •7. Регуляция активности ферментов: на уровне транскрипции (на примере лактозного оперона), аллостерическая регуляция, ковалентная модификация
- •8. Энзимодиагностика и энзимотерапия
- •9. Тиамин, рибофлавин, никотиновая кислота, фолиевая кислота, цианокобаламин: название, биологическая роль, гиповитаминозы, пищевые источники
- •10. Пиридоксин, пантотеновая кислота, аскорбиновая кислота, биотин: названием, биологическая роль, гиповитаминоз, пищевые источники
- •11. Ретинол, кальциферол, филлохинон, токоферол: название, биологическая роль, гиповитаминоз, пищевые источники
- •12. Гормоны, общее понятие, классификация. Регуляции синтеза и высвобождения гормонов (привести примеры)
- •13. Аденилатциклазная и гуанилатциклазная система передачи гормонального импульса (на конкретных примерах)
- •14. Инозитолфосфатная система передачи гормонального сигнала (на конкретных примерах)
- •15. Механизм действия липофильных гормонов (на конкретных примерах)
- •16. Гормоны щитовидной железы: синтез, химическая природа, механизм действия, биологическое значение. Регуляция синтеза и секреция гормонов
- •17. Гормоны гипоталамуса и гипофиза, их химическая природа, биологическая роль. Гормоны гипотоламуса
- •Гормоны передней и промежуточной доли гипофиза
- •Гормоны задней доли гипофиза
- •18. Половые гормоны: предшественники, химическая природа, механизм действия, биологическое значение. Регуляция секреции и синтез гормонов мужские половые гормоны
- •Женские половые гормоны
- •19. Гормоны коркового слоя надпочечников: предшественники, химическая природа, механизм действия, биологическое значение. Регуляция секреции и синтез гормонов
- •20. Гормоны мозгового слоя надпочечников: химическая природа, механизм действия, биологическое значение
- •21. Гормоны поджелудочной железы: химическая природа, механизм действия, биологическое значение
- •23. Активный и пассивный транспорт веществ через мембраны
- •29. Цикл Кребса: продукты, роль витаминов. Связь окислительного декарбоксилирования пирувата и цикла Кребса с дыхательной цепью
- •32. Глюконеогенез: локализация в клетке, биологическое значение. Регуляция, взаимосвязь с процессом гликолиза, цикл Кори
- •33. Синтез и распад гликогена, последовательность реакций, биологическое значение. Гормональная регуляция процессов гликогенолиза и гликогенеза
- •34. Гормональная регуляция уровня глюкозы в крови. Тест толерантности к глюкозе
- •35. Физиологические важные липиды, классификация, биологическая роль
- •36. Переваривание липидов в желудочно-кишечном тракте (триацилглицеролов, фосфолипидов и эфиров холестерола)
- •37. Выведение липидов из клеток тонкого кишечника
- •38. Окисление жирных кислот: локализация в клетке, продукты реакции, участие витаминов. Регуляция распада жирных кислот гормонами
- •39. Синтез насыщенных и ненасыщенных жирных кислот: локализации в клетке, необходимые источники и их происхождение, продукты реакции, участие витаминов. Регуляции синтеза жирных кислот гормонами
- •40. Синтез и использование организмом кетоновых тел в качестве источника энергии
- •41. Биосинтез триацилглицеролов, фосфолипидов. Регуляция процессов. Распад триацилглицеролов и его гормональных регуляция, биологическое значение
- •42. Выведение липидов из клеток печени
- •43. Холестерин, его биомедицинское значение. Биосинтез холестерина, последовательность реакций, регуляция интенсивности синтеза. Транспорт холестерина к тканям и из тканей
- •2 Ацетил-КоА
- •44. Желчные кислоты: биосинтез, его регуляция. Кишечно-печёночная циркуляция и экскреция желчных кислот. Желчекаменная болезнь.
- •45. Классификация аминокислот по пищевой ценности. Азотистый баланс организма и причины его нарушения
- •46. Переваривание белков и всасывание продуктов распада белков в желудочно-кишечном тракте. Особенности переваривания белков у детей
- •48. Декарбоксилирование аминокислот. Биогенные амины, синтез, биологическое значение
- •49. Транспорт аммиака из тканей. Глюкозо-аланиновый цикл
- •50. Биосинтез мочевины, последовательность реакций, биологическое значение. Гипераммониемии и их коррекция
- •51. Метаболизм отдельных аминокислот: фенилаланин и тирозин. Нарушение метаболизма аминокислот
- •52. Метаболизм метионина и цистеина, глицина и серина
- •53. Метаболизм пуриновых нуклеотидов (общие схемы реакций), регуляция. Подагра
- •54. Метаболизм пиримидиновых нуклеотидов (общие схемы реакций), регуляции. Оротацидурия
- •55. Основные белки плазмы крови, их биологическая роль
- •56. Клинико-диагностическое значение белков плазмы крови (на примере протеинограмм)
- •57. Химический состав эритроцитов. Антиоксидантная система эритроцитов
- •58. Транспорт кислорода в клетки
- •59. Синтез гема и его регуляция. Распад гема. Образование билирубина
- •60. Нормальный обмен билирубина
- •61. Нарушение обмена билирубина: гемолитическая желтуха
- •62. Нарушение обмена билирубина: паренхиматозная желтуха
- •63. Нарушение обмена билирубина: обтурационная желтуха
- •64. Обмен железа: всасывание, транспорт кровью, депонирование. Регуляция обмена железа
- •65. Детоксикационная функция печени (на примере обезвреживание продуктов гниения аминокислот в кишечнике)
- •69. Механизм действия предсердного натрийуретического фактора на водно-минеральный обмен
- •70. Гормон, регулирующий уровень кальция в крови
46. Переваривание белков и всасывание продуктов распада белков в желудочно-кишечном тракте. Особенности переваривания белков у детей
Переваривание белков ЖКТ
Процесс начинается в полости желудка, необходимо 2 компонента желудочного сока: НСl и фермент пепсиноген.
Синтез НСl
Процесс осуществляется в парентеральных клетках желудка. СО2 из плазмы — парентальные клетки желудка, где происходит всаимодействие с водой, образуется угольная кислота Н2СО3 ф-т карбоангедраза.
Н2СО3 диссоциирует на Н+ и НСО3-.
Н+ — в полость желудка при помощи актив. белка Н-АТФазы, локализованная в мембране парентеральных клеток.
НСО3- — в плазму, в ответ на это из плазмы хлорид-ионы перемещаются в парентальные — полость желудка, где образуется НСl.
Роль соляной кислоты:
1)нейтрализация м/о
2)денатурация пищевых белков: теряется третичная структура белков; молекула белка разворачивается и пептидные связи становятся доступными для действия ферментов.
3)создается рН 1,5-2
4)активация пипсиногена, с образованием активного пепсина
Защита клеток желудка от действия НСl.
НСl – агрессивное вещество, поэтому клетки желудка вырабатывают механизмы защиты
1. Клетки формируют мукополисахариды, которые образуют подслизистый слой
2. В подслизистый слой пребывают НСО3- , в результате создается рН 5,5-6
Активация пепсиногена
Неактивный пепсиноген образуется в клетках желудка — полость желудка, где подвергается активации. Процесс осуществляется двумя путями:
1) медленный; осуществляется под действием НСl, частичным протеолизом (отцепление N-концевого пептида, который участвует в образовании активного центра фермента)
2) быстрый; осуществляется молекулой пепсина, который образовался в первом пути. Процесс активации — частичный протеолиз.
Пипсин активно расцепляет пищевые белки, поэтому клетки желудка вырабатывают механизмы защиты от действия пепсина:
1. в клетках образуется неактивный пепсиноген, а активный пепсин образуется в клетках желудка.
2. подслизистым слоем желудка рН 5,5-6, что не является оптимумом для действия пепсина (оптимальный рН 1,5-2)
3. в полость желудка обращены углеводная часть мукополисахарида, который не является субстратом для действия пипсина.
Пищевые белки под действием пепсина расщепляются на более короткие фрагменты — пептиды, которые далее — в полость дуаденума.
В ответ на поступление кислых пептидов происходит секрация кишечного гормона секретина, который стимулирует 1ую порцию панкреатического сока, содержит гидрокарбонаты. В результате в полости дуаденума создается рН 7,5-8, что необходимо для действия ферментов, расщепляет белки. Далее стимулируется кишечный гормон холицестокинин, который способен перемещать 2ую порцию панкреатического сока в полость дуаденума.
2я порция панкреатического сока содержит неактивные протеолетические ферменты: трипсиноген, химотрепсиноген, проэластаза и прокарбоксипептидаза. Эти ферменты активируются в полости дуаденума следующим образом:
сначала кишечный фермент энтеропептидаза частичным протеолизом активирует трипсиноген с образованием активного трипсина — активируются остальные ферменты частичным протеолизом. В результате образуются активные ферменты: хемотрипсин, эластаза, карбоксипептидаза.
Пептиды под действием этих ферментов распадаются до трипептидов, дипептидов и так же образуется немного свободных АК.
Клетки 12-перстной кишки образуют подслизистый слой, который защищают их от действия протеолитических ферментов, однако пантреатические клетки неспособны образовывать подслизистый слой; у них существует другие механизмы защиты.
1) протеолитические ферменты, образуются в клетках поджелудочной железы в неактивной форме и автивируются только в полости дуаденума
2) клетки поджелудочной железы образуют ингибитор трипсина, который играет ключевую роль в активации протеаз
При повреждении клеток поджелудочной железы ↓количество ингибиторов трипсина, создаются условия для преждевременной активации протеолитических ферментов, они способны разрушать клетки поджелудочной железы;
Так же активируются ферменты, выходящие в кровь, достигая другие клетки, где белки подвергаются распаду.
Переваривание ди- и трипептидов в полости тонкой кишки
Ди- и трипептиды и свободные АК, образовавшиеся в полости дуаденума перемещаются ниже в полость кишечника, где свободные АК всасываются, а три- и дипептиды подвергаются распаду ферментов.
Трипептиды подвергаются действию аминопептидаз, которые отщепляют 1ую АК, таким образом образуются свободные АК и дипептид.
Все дипептиды распадаются под действием дипептидаз, таким образом образуются свободные АК, которые далее подвергаются всасыванию.
Всасывание АК в тонком кишечнике
Существует 5 транспортных систем, локализованных в мембранных клетках кишечника:
1) Для транспорта нейтральных АК с перазветвленной цепью
2) Нейтральные АК с разветвленной цепью
3) +заряженные АК
4) -заряженные АК
5) Транспорт пролина и оксапролина
Для транспорта нейтральных АК требуется градиент Nа-вторично-активного транспорта. Сначала иона Na перемещаются из полости кишечника в клетки кишечника пассивным транспортом.ю что стимулирует транспорт АК в клетках кишечника — ионы натрия возвращается в полость кишечника при помощи Nа-К-АТФазе.
Некоторые АК перемещаются в клетки кишечника при помощи гама-глутаминного цикла, процесс осуществляется при помощи мембранно-связанного фермента гама-глутамил-трансферазы и трипептида глупапиона, который имеет следующую структуру: глу-цис-гли
АК переносится гама-глутамин-трансферазой на глутамат, который отщепляюеся от глутатиона. Образуется комплекс АК-глу, который доставляется в кл., где АК высвобождается, остальные реакции направленны на востановлении структуры глутатиона.
После высвобождения АК перемещается в плазму — в клетки, часть АК транспортируются при помощи гамма-глутаминного цикла.
В клетки органов АК включаются:
1) в синтез белков, свойственный данному организму
2) в синтез азотосодерж. в-в: нейромедиаторов, нуклеотидов, карнитина
Особенности переваривания белков у детей грудного возраста
Основной белок молока — козеин, который в полости желудка, под действием фермента ринина подвергается превращению: от козеина отщепления гликопротеин и при воздействии ионов Са2+, образуется денатурированный паракозеин, который далее подвергается распаду.
Организм ребенка с молоком матери получает ингибитор — трипсин, а так же Ат. Поджелудочная железа незрлая, поэтому активность протеолитических ферментов низкая, но способствовать кдетки тонкого кишечника, учитывая выше описаной способности, распад белков ↓ — образуются белковые фрагменты, которые легко могут всасываться в тонком кишечнике. Это актуально для усвоения Ат организмом ребенка.
Если наблюдаются повреждения ЖКТ, то активность протеолитических ферментов еще более низкая, а всасывающая способность кишечника увеличивается, поэтому создаются условия для поступления в кровь большого количества белков и пептидов, что может вызывать аллергическую реакцию.
Аналогичная картина наблюдается у взрослых при заболеваниях ЖКТ.
47. Катаболизм аминокислот. Дезаминирование аминокислот: окислительное дезаминирование, переаминирование на примере реакций, катализируемых аспартатаминотрансферазой и аланинаминотрансферазой, непрямое дезаминирование аминокислот
Дизаменирование — 1ый этап распада АК различают 2 типа дизаминирования
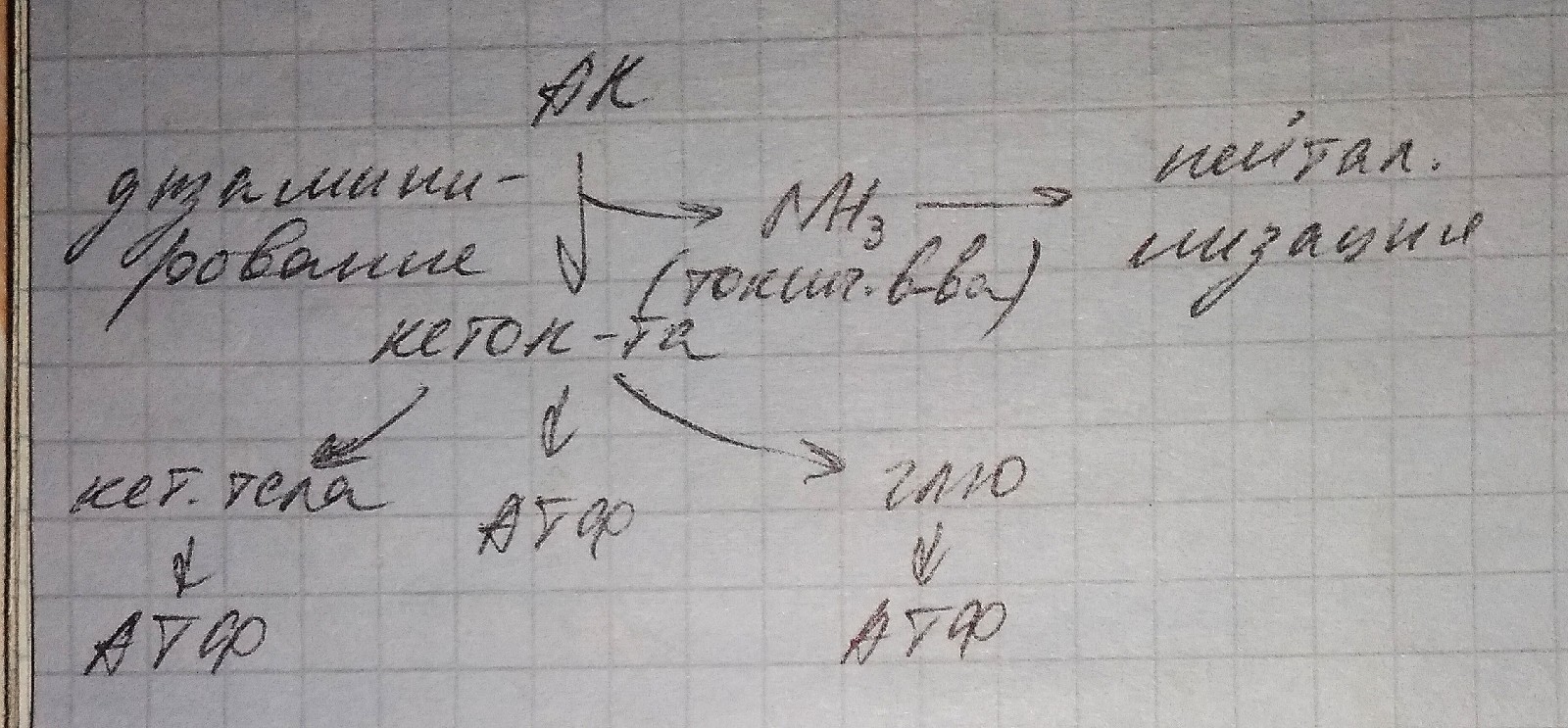
1. Окислительное (прямое). Этому процессу подвергается только глутамат
2. Непрямое дезаминирование АК. Подвергается большая часть АК, включает 2 этапа:
а) тринеаминирование (переаменирование)
АК взаимодействуют с альфа-кето-глутаратом, в результате амино-группа у АК переносится на альфа-кето-глутарат, АК превращается в кето-кислоту, а альфа-кето-глутарат в глутамат.
Процесс катализируется амино-трасферазами, коферментом, который является витамин В6.
б) прямое дезаминирование глутамата



Клинико-диагностическое значение АСТ и АЛТВ норме ферменты работают внутри клетки, поэтому их активность в плазме очень ↓ , при повреждении клеток, ферменты выходят в плазму, где их активность повышается.
Высокая активность АСТ отличается в клетках миокарда, скелетных мышцах, в митохондриях гепатоцитов.
Высокая активность АЛТ отмечается в ЦП гепатоцитов, в скелетных мышцах, миокарде.
