
- •Введение
- •2. ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ВЫПОЛНЕНИЯ КУРСОВОЙ РАБОТЫ
- •2.1. Основные понятия и определения химической термодинамики
- •2.2. Первый закон термодинамики
- •2.3. Термохимия
- •2.4. Второй закон термодинамики
- •2.5. Термодинамические потенциалы
- •4. ОФОРМЛЕНИЕ КУРСОВОЙ РАБОТЫ
- •Вопросы и задания к защите курсовой работы
- •Библиографический список
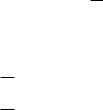
где a, b, c, d, c'– коэффициенты, получаемые после обработки экспериментальных данных; они приведены в справочниках.
2.3. Термохимия
Термохимия – раздел термодинамики, который изучает тепловые |
|||
С |
|
|
|
Q понима- |
|||
эффекты процессов. В термохимии под тепловым эффектом |
|||
ют теплоту, которая выделяется или поглощается в результате процесса, протекающего при постоянном р или V, причём температура исходных веществ продуктов реакции одинакова, а полезная работа равна нулю
( A и= 0).
Закон Гесса – это основной закон термохимии. Формулировка закона: тепловой эффект процесса не зависит от числа и характера промежу-
точных стад й, а определяется только начальным и конечным состоянием |
|
системы. |
б |
|
|
Услов е пр менен я закона Гесса: закон применим только к тепло- |
|
вым эффектам процесса, т.е. к условиям, когда процесс протекает при р = const ли V = const. Закон применим не только к химическим реакциям, но и к любым другимАфизико-химическим процессам.
Термодинамическое о основание закона Гесса заключается в сле-
дующем. Установлено, что QV = ∆U, а QP = ∆Н. Так как внутренняя энергия U и энтальпия H являются функциями состояния системы, т. е. не за-
висят от пути процесса, то Q и Q не будут зависеть от промежуточных
стадий, а определяются только начальным и конечным состояниями системы.
Практическое значение закона Гесса заключается в следующем. За-
затруднено.
V PД
кон позволяет рассчитывать тепловые эффекты процессов, не проводя экспериментов, а также тепловые эффекты неосуществимых процессов и процессов, для которых определение тепловогоИэффекта опытным путём
Уравнение химической реакции с указанием теплового эффекта называется термохимическим уравнением. С термохимическими уравнениями можно обращаться так же, как и с алгебраическими уравнениями (складывать, умножать, делить).
Первое следствие из закона Гесса: тепловой эффект Q обратной ре-
акции равен по величине и противоположен по знаку тепловому эффекту прямой реакции.
aA + bB = cC + dD + Q ;
cC + dD = aA + bB – Q .
13
Второе следствие из закона Гесса: тепловой эффект реакции равен сумме энтальпий (теплот) образования продуктов реакций минус сумма энтальпий (теплот) образования исходных веществ.
H 0 |
298 |
H 0 f ,298(продуктов реакции) H 0 f ,298(исходных |
веществ), |
||||||
здесь индекс f – от лат. foramentum – образование. |
|
|
|||||||
С |
|
|
|
|
|||||
|
|
|
Например, для реакции aA + bB = cC + dD |
|
|||||
|
|
|
∆H0298 = [с∆H0f,298(С) + d∆H0f,298(D) – (a∆H0f,298(А) + b∆H0f,298(В)]. |
||||||
|
|
При сумм рован |
обязательно учитываются стехиометрические |
||||||
коэффиц енты уравнен я реакции. |
|
|
|||||||
если |
|
|
|||||||
|
|
Для расчета тепловых эффектов используются стандартные теплоты |
|||||||
образован я веществ. Стандартной теплотой (энтальпией) образования |
|||||||||
|
|
|
0 |
|
|
|
0 |
|
|
вещества (∆H f,298 |
|
|
∆H 298) называется изменение энтальпии при обра- |
||||||
зовании одного моля вещества из простых веществ, находящихся при |
|||||||||
стандартных услов ях. Стандартная энтальпия простого вещества равна |
|||||||||
нулю. |
|
|
|
|
|
|
|
||
|
|
Напр мер, |
|
вещество получено по реакции, выраженной термо- |
|||||
химическ м уравнен ем |
|
|
|||||||
|
|
|
Ca(тв) |
+ C(граф т) + 1,5O2(газ) = CaCO3(тв) |
+ 1207,7 Дж/моль, |
||||
|
|
|
|
|
|
А |
|
||
его стандартная теплота о разования равна |
|
|
|||||||
|
|
|
|
|
|
|
0 |
|
|
|
|
|
б∆H f,298(CaCO3) = – 1207,7 Дж/моль. |
|
|||||
|
|
Третье следствие из закона Гесса: тепловой эффект реакции равен |
|||||||
сумме теплот сгорания исходных веществ минус сумма теплот сгорания |
|||||||||
продуктов реакции. |
|
|
|
|
|||||
H |
0 |
H |
0 |
|
|
|
0 |
|
|
|
298 |
с,298(исходных веществ) H |
с,298(продуктов реакции), |
||||||
здесь индекс с – от лат. combustum – сгорание. |
|
|
|||||||
|
|
|
Например, для реакции aA + bB = cC + dD |
|
|||||
|
|
|
|
|
|
|
И |
||
|
|
|
∆H0298 = a∆H0с,298(А) + b∆H0с,298(В) – с∆H0с,298(С) – d∆H0с,298(D). |
||||||
|
|
|
|
|
|
|
|
0 |
0 |
|
|
Стандартная теплота сгоранияДвещества (∆H с,298, ∆H сгор) – это |
|||||||
уменьшение энтальпии в реакции сгорания одного моля простого вещест- |
|||||||||
ва или соединения до соответствующих окисленных форм элементов. |
|||||||||
|
|
Соединения, состоящие из углерода и водорода (например, топливо), |
|||||||
сгорают до CO2 |
и H2O. Стандартные теплоты сгорания и образования при- |
||||||||
ведены в справочных таблицах термодинамических величин.
Закон Кирхгофа устанавливает зависимость теплового эффекта реакции от температуры. Формулировка закона: температурный коэффициент теплового эффекта реакции равен изменению теплоемкости в результате процесса.
Уравнение Кирхгофа для изобарного процесса (р = const)
14

|
|
|
|
|
d H |
|
Cp , |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
dT |
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
где |
Cp Cp (продуктов) Cp (исходных |
|
веществ) . |
|||||||||||||||
|
В зависимости от знака ∆Cр |
тепловой эффект реакции (процесса) с |
||||||||||||||||
ростом температуры может увеличиваться или уменьшаться. |
||||||||||||||||||
1. |
Если ∆Cp > 0, то с ростом температуры ∆H увеличивается. |
|||||||||||||||||
2. |
Если ∆Cp < 0, то с ростом температуры ∆H уменьшается. |
|||||||||||||||||
3. |
Если ∆Cp = 0, то тепловой эффект не зависит от температуры. |
|||||||||||||||||
|
Про нтегр руем уравнение Кирхгоффа d∆H = ∆CрdT. |
|||||||||||||||||
|
Пусть теплоемкость Ср не зависит от температуры, т. е. ∆Ср = const, |
|||||||||||||||||
что допуст мо в небольшом интервале температур. |
|
|
|
|
|
|
|
|
||||||||||
С |
|
T2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
H2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
d H Cp dT , H2 H1 Cp (T2 T1 ). |
|||||||||||||||
|
|
H1 |
T1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
Отсюда выведем формулу для вычисления теплового эффекта: |
|||||||||||||||||
и∆H2 = ∆H1 + ∆Cр(T2 – T1) . |
|
|
|
|
|
|
|
|
||||||||||
|
Пусть теплоемкость ∆Cр является функцией от температуры, то есть |
|||||||||||||||||
∆Cp = f(T). Эта зав с мость выражается уравнением |
|
|
|
|
|
|
|
|||||||||||
|
Cp = a + bT + cT² |
или Cp = a + bT + |
|
|
|
|
2 |
. |
||||||||||
|
c T |
|
||||||||||||||||
|
В общембвиде изменение теплоемкости равно |
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
2 |
. |
|
|
|
||
|
|
|
∆Cp = ∆a + ∆bT + ∆cT² + c T |
|
|
|
|
|
|
|||||||||
|
Подставим это выражение в уравнение Кирхгофа, тогда |
|||||||||||||||||
|
|
|
d∆HТ = (∆a + ∆bT + ∆cT² +∆ |
|
|
|
|
2 |
)dT. |
|||||||||
|
|
|
c T |
|
|
|||||||||||||
|
|
|
А |
|
|
|
|
|
|
|||||||||
|
Возьмем неопределённый интеграл и получим выражение |
|||||||||||||||||
|
H |
|
aT |
b T 2 c T 3 c |
|
H |
|
. |
|
|
|
|||||||
|
T |
|
|
|
|
|
||||||||||||
|
|
|
2 |
|
3 |
T |
|
|
|
0 |
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
Полученное уравнение показывает зависимость теплового эффекта |
|||||||||||||||||
|
|
|
|
|
|
Д |
||||||||||||
|
|
|
|
|
|
|
|
И |
||||||||||
реакции от температуры. В нем ∆H0 – постоянная интегрирования, определяемая как значение теплового эффекта при одной из температур.
Уравнение Кирхгофа для изохорного процесса (V = const) d U
dT
2.4. Второй закон термодинамики
Самопроизвольные (спонтанные) процессы описываются следую-
щими характеристиками:
1. Все природные самопроизвольные процессы протекают в одном направлении, т. е. имеют одностороннее направление. Например, тепло от
15
горячего тела переходит к холодному, газы стремятся занять наибольший объём.
2. Часть энергии переходит в теплоту, т. е. система из упорядоченного состояния переходит в состояние с беспорядочным тепловым движением частиц.
3. амопроизвольные процессы можно использовать для получения Сполезной работы. По мере превращения система теряет способность производить работу. В конечном состоянии равновесия она имеет наимень-
ший запас энерг .
4.стему нельзя вернуть в исходное состояние, не производя ка-
сравнению ным по сравненбю с конечным.
ких-либо зменен й в ней самой или в окружающей среде. Все самопроизвольные процессы термодинамически необратимы.
5. В самопро звольном процессе начальное состояние является ме-
нее вероятным по каждым последующим и наименее вероят-
Несамопро звольные процессы протекают при затрате работы,
при этом с стема удаляется от состояния равновесия (например, сжатие газа, электрол з).
1.Теплота не можетАпереходить самопроизвольно от менее нагретого тела к более нагретому.
2.Невозможен процесс, единственнымДрезультатом которого является превращение теплоты в работу.
3.Вечный двигатель второго рода невозможен. Теплота наиболее холодного из участвующих в процессе тел не может служить источником
работы.
Аналитическое выражение второго законаИтермодинамики и его обоснование с использованием цикла Карно. Суть выражения второго за-
кона термодинамики – связь самопроизвольности процесса с ростом энтропии. Это выражение вытекает из рассмотрения вопроса о теоретической полноте превращения теплоты в работу в обратимом цикле Карно.
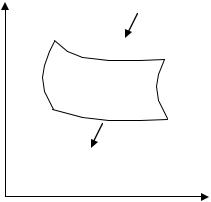
Цикл состоит из четырех процессов (рис. 2):
АВ – изотермическое расширение за счет теплоты Q1, подведенной к газу при температуре Т1;
ВС – адиабатическое расширение;
СД – изотермическое сжатие при температуре Т2, в этом процес-
се газ теряет теплоту Q2;
ДА – адиабатическое сжатие до исходного состояния.Второй закон термодинамики – это постулат. Он имеет стати-
16
|
Р |
|
|
|
|
|
|
|
|
Теплоотдатчик |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
А |
|
|
|
Q1 |
|
|
|
|
|
|
|
|
|||
|
|
|
|
Т1 |
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Давление |
|
|
|
|
|
|
|
|
|
|
|
|
|
В |
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Т2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
С |
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
Д |
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
С |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
Q2 |
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
Теплоприемник |
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
Мольный объем |
|
|
|
|
|
|
V |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
Р с. 2. Схема цикла Карно |
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Теплота, поглощаемая (или выделяемая) при изотермическом рас- |
||||||||||||||||||||
ширении ( |
сжат ) одного моля идеального газа, равна работе: |
|||||||||||||||||||
|
|
|
|
|
Q A RT ln |
vкон |
. |
|||||||||||||
|
|
|
|
|
|
|||||||||||||||
ли |
|
|
|
vнач |
||||||||||||||||
При ад |
|
ческом расширении (или сжатии) |
||||||||||||||||||
|
|
|
|
|
|
Q 0; |
|
Сv (Tнач Ткон ). |
||||||||||||
Применение этих уравнений к соответствующим процессам цикла |
||||
абат |
|
|
||
приводит к выражению для термодинамического коэффициента полезного |
||||
действия (КПД) |
|
|
|
|
|
Q1 Q2 |
T1 T2 |
. |
|
|
|
|||
|
Q |
Q1 |
T1 |
|
|
А |
|||
Это уравнение является математическимКПДвыражением второго закона термодинамики.
Так как T1 ‹ T2, то η ‹ 1.
Согласно теории Карно, замена идеального газа любым другим ве-
Выражение второго закона термодинамикиИпозволяет ввести понятие энтропии, с помощью которой сущность закона раскрывается в удоб-
ществом не приведет к изменению цикла Карно. Замена цикла Карно
любым другим циклом приведет к меньшему КПД (теорема Клазиуса– Карно). Таким образом, даже в случае идеальной тепловой машины пре-
вращение теплоты в работу не может быть полным.
ной и общей форме. |
|
|
|
|
|
|
|
|
|
|
Изменим выражение |
1 |
Q2 |
1 |
T2 |
на выражение |
Q1 |
|
Q2 |
0 . |
|
Q1 |
T1 |
Т1 |
T2 |
|||||||
|
|
|
|
|
|
17

Отношение Q называется приведенной теплотой. Последнее урав-
T
нение показывает, что алгебраическая сумма приведенных теплот по обратимому циклу Карно равна нулю.
|
Для бесконечно малого обратимого цикла Карно |
|
Q1 |
|
Q2 |
0, |
||||||
|
|
|
|
|||||||||
С |
|
|
|
Q |
|
T1 |
|
T2 |
||||
|
|
|
|
|
|
|
|
|||||
|
Q |
|
|
|
|
|
|
|
|
|
|
|
где |
T – элементарная приведенная теплота. |
|
|
|
|
|
|
|
||||
|
Любой ц кл может быть заменен совокупностью бесконечно малых |
|||||||||||
|
функции |
|
|
|
|
|
|
|
||||
циклов Карно: |
|
Qi |
0 . |
|
|
|
|
|
|
|
||
|
|
|
|
T |
|
|
|
|
|
|
|
|
|
В пределе |
i эта сумма превратится в |
|
T |
0. |
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
В теор |
нтегралов доказывается, что если интеграл по замкнутому |
||||||||||
контуру равен нулю, то подынтегральное выражение есть полный диффе- |
||||||||||||
ренциал некоторой |
|
от параметров, определяющих состояние |
||||||||||
системы. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Q dS, |
|
|
|
|
|
|
|
|
|
|
|
|
А |
|
|
|
|
|
||
|
|
|
|
|
T |
|
|
|
|
|
|
|
где S – это энтропияб, такая функция состояния системы, полный диффе- |
||||||||||||
ренциал которой в о ратимом процессе равен отношению бесконечно ма- |
||||||||||||
лого количества теплоты к температуре. |
|
|
|
|
|
|
|
|||||
|
|
|
|
|
Д |
|||||||
Понятие «энтропия» введено Клаузиусом (1850 г.). Последнее уравнение является математическим выражением второго закона термодинамики для обратимых процессов.
Изменение энтропии в обратимом процессе равно изменению энтропии в необратимом процессе, т.е. dSобрат dSнеобрат. Сравним теплоты обратимого и необратимого процессов. Согласно первому закону термодинамики, Q U A. Внутренняя энергия U – это функция состояния сис-
темы, |
поэтому dUобрат dUнеобрат. |
Максимальная работа совершается |
|
при обратимом процессе, поэтому Аобрат >> Анеобрат, тогда Qобрат > Qнеобрат и |
|||
dS |
Qнеобрат |
. |
И |
|
|||
|
T |
|
|
В общем случае для обратимого и необратимого процессов второй закон термодинамики имеет следующее математическое выражение:
dS Q . T
18
Здесь dS = const, а изменяется только правая часть уравнения, т.е. значение величины теплоты. Единицы измерения энтропии: [S] = Дж/моль·К.
Объединенное уравнение первого и второго законов термодинамики:
Q = dU + A,
отсюда TdS dU pdV A .
Постулат Планка имеет следующую формулировку: при абсолютном нуле энтропия правильно образованных кристаллов чистых веществ равна нулю. Постулат позволяет рассчитать абсолютное значение энтро-
пии, если |
звестны теплоты фазовых переходов и теплоёмкости вещества |
||||||||||||||||
в различных агрегатных состояниях. |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
Рассмотр м выч сление изменения энтропии в различных процес- |
|||||||||||||||||
сах. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
С |
S при фазовых переходах (T = const) опре- |
||||||||||||||||
1. Изменен е |
|||||||||||||||||
деляется по формуле |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
энтропии |
S n |
H |
, |
|
|
|
|
||||||||||
|
|
T |
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
где ∆H – теплота фазового перехода (кипение, испарение, возгонка, плав- |
|||||||||||||||||
ление); n – ч сло молей вещества, переходящего из одной фазы в другую, |
|||||||||||||||||
n = g/M, здесь g – масса вещества; M – его молярная масса. |
|||||||||||||||||
2. Изменение энтропии ∆S при нагревании. |
|
|
|
||||||||||||||
|
б |
|
|
|
|
|
|
||||||||||
а) Пусть p = const, тогда |
Q Cp dT , |
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
dS |
Cp dT |
. |
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
T |
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
А |
||||||||||||||||
Если Cр = const, тогда |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
∆S = Cр ln |
T2 |
, |
|
|
|
|
|||||||||
|
|
T |
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|||
где Т1 |
и Т2 – температуры начала и окончания нагревания вещества. |
||||||||||||||||
Пусть Cр выражается в Дж/мольД·К, тогда |
|||||||||||||||||
|
|
∆S = n Cр ln |
T2 |
. |
И |
||||||||||||
|
|
T |
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|||||
Пусть Cp выражается в Дж/г·К, тогда |
|
|
|
|
|||||||||||||
|
|
|
|
|
T2 |
|
|
|
|
|
|||||||
|
∆S = g Cр ln T . |
|
|
||||||||||||||
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
Если |
Cp зависит от температуры, т.е. |
|
Cр = f (T), тогда |
||||||||||||||
|
T2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
dT |
|
|
dS |
|
|
|
|
|
2 |
|
|
|
|
2 |
|
|
|||
|
(a bT cT |
|
|
|
с Т |
|
) |
|
. |
||||||||
|
|
|
|
|
T |
||||||||||||
|
T1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
б) Пусть V = const, тогда
19
