
Нефть
.pdf
vk.com/club152685050
Рис. 10. Пути образования изопренанов – пристана (изо-С19) и фитана (изо-С20)
струкции более высокомолекулярных источников. Однако, в отличие от реликтовых неразветвленных алканов, в изопреноидах всегда можно обнаружить «провалы» в концентрациях тех или иных гомологов. Например, в нефтях отсутствуют изопренаны состава
С12 и С17.
Это обусловлено тем, что невозможен разрыв цепи (образование гомолога) в том месте, где находятся замещающие метильные радикалы:
50
СПБГУАП | Институт 4 | Группа 4736

vk.com/club152685050
Этот факт является краеугольным камнем органической гипотезы образования нефти.
Задача типизации нефтей в осадочной оболочке Земли в течение нескольких десятилетий является одной из центральных
вгеологии и геохимии нефти и газа. Геохимические (генетические) классификации рассматривают нефти с позиций их геологогеохимической истории, фундаментом для их создания служит теория нефтеобразования. Еще в прошлом веке выделяли нефти парафинового и нафтенового основания. Вопрос о том, что же является определяющим моментом в формировании состава нефти (и есть ли вообще такой момент), до сих пор остается дискуссионным. Из имеющихся на этот счет гипотез и предположений можно выделить две основных.
Гипотеза А.Ф. Добрянского, полагающая, что основным фактором, определяющим образование того или иного химического типа нефти, является не состав исходного органического вещества, а геохимические (термодинамические) условия его преобразования
внефть. При этом первично генерированные нефти нафтенового основания путем термокаталитических воздействий в недрах по мере погружения постепенно переходят в нефти парафинового основания.
Гипотеза В.А. Успенского – А.А. Петрова по существу своему прямо противоположна первой. Суть ее состоит в допущении, что первично генерированные из рассеянного органического вещества
взоне катагенеза нефти являются нефтями парафинового основания, которые под влиянием гипергенных процессов (биодеградация, выветривание) постепенно преобразуются в нефти нафтенового основания. Нужно отметить, что обе столь противоположные гипотезы отталкиваются от одного и того же твердо установленного факта: с увеличением глубины залегания в абсолютном большинстве нефтей отмечается повышение содержания алкановых углеводородов.
На наш взгляд, правомерными являются обе выдвинутые гипотезы – и гипотеза В.А. Успенского – А.А. Петрова, и гипотеза А.Ф. Добрянского. Однако хроматографические картинки нефтей типа «Б» (по классификации А.А. Петрова, см. далее) в обоих случаях могут быть близкими. Для того, чтобы сделать вывод,
51
СПБГУАП | Институт 4 | Группа 4736

vk.com/club152685050
по какой причине на хроматограммах присутствует только нафте- но-ароматический «горб» (т.е. нефть типа «Б»), необходимо провести детальный анализ этих нефтей методом хроматомасс-спек- трометрии для определения закономерностей распределения высокомолекулярных три-, тетра- и пентациклических углево- дородов-биомаркеров – стеранов и терпанов. В слабо преобразованных нефтях (нефтях ранней генерации) будут превалировать термадинамически менее устойчивые эпимеры стеранов, а в преобразованных нефтях эпимеры стеранов будут находится в равновесных концентрациях.
2.4. По стеранам и терпанам
Тетрациклические изопреноиды представляют собой наиболее обширную и интересную группу изопреноидных углеводородов нефти. Нефть является источником совершенно новых типов органических молекул. Особенно велика роль стерановых углеводородов, поскольку этисоединениячрезвычайноинформативныпри решении ряда геохимических задач. Кроме того, образующиеся из химически достаточно лабильных стероидов, стераны претерпевают в земной коре ряд интересных структурных и стереохимических превращений, приводящих к получению серии углеводородов, не имеющих аналогов в живой природе и присутствующих лишь в нефтях. Например, изостераны (14β(Н),17β(Н)-эпимеры), перегруппированные стераны и пр. (здесь и далее для обозначения положения атомов водорода, направленных вниз и вверх по отношению к плоскости циклической системы, при соответствующих хиральных центрах мы будем использовать буквы «α» и «β», а обозначение атома водорода опустим).
Стераны обычно содержат 4 кольца, где «D» кольцо всегда пятичленное.
Регулярные стераны. Структурная и пространственная формулы регулярных, т.е. обычных, стеранов с указанием особенностей пространственного строения и нумерации атомов углерода приведены ниже.
Хиральные центры С5, С14, С17, С20 и С24 (для стеранов С28 и С29) способны к эпимеризации. Приведенная структура соответствует природному α-холестану, имеющему конфигурацию
52
СПБГУАП | Институт 4 | Группа 4736

vk.com/club152685050
5α,14α,17α,20R соответствующих хиральных центров. Наименование «α-холестан» углеводород получил согласно ориентации атома водорода при С5. В более привычной для химиков-нефтяников номенклатуре α-холестан имеет транс-сочленение всех циклов А/В, В/С и C/D и цис-относительную ориентацию связей 17–20 и 13–18. Кроме 5α-стеранов, в природных объектах имеются и 5β-стера- ны – углеводороды, отличающиеся от α-стеранов только лишь сочленением колец А/В (цис).
Кроме самого холестана, не имеющего заместителей при С24, в природных объектах и, в частности, в нефтях весьма распространены также 24-метилхолестаны (эргостан, кампестан и др.) и 24-этилхолестаны (ситостан, пориферастан и др.). В этих углеводородах появляются, как было отмечено выше, новый хиральный центр при С24.
Хотя α-стераны обычно присутствуют во всех нефтях, не менее значительны и концентрации стереохимически измененных углеводородов, так как синтезированный живой материей 5α-эпимер термодинамически менее стабилен. Особенно неблагоприятным является транс-сочленение циклов C/D, поскольку в системе ангулярно замещенного гидриндана значительно более устойчивы углеводороды с цис-сочленением циклов.
53
СПБГУАП | Институт 4 | Группа 4736

vk.com/club152685050
Поэтому в земной коре под влиянием каталитического воздействия пород происходят конфигурационные изменения исходных молекул. Кроме изменения конфигурации атома С14, что приводит к молекулам, имеющим уже цис-сочленение колец C/D (14β), в нефтяных (геологических) стеранах возможна также эпимеризация 17-го и 20-го углеродных атомов. В результате этих превращений образуются так называемые изостераны (два изомера), имеющие следующую конфигурацию: 5α,14β,17β,20R и 20S. Эти два углеводорода обычно хорошо разделяются при ГЖХ и хорошо видны на хроматограммах и массхроматограммах нефтей.
Кроме рассмотренных трех стереоизомеров, для геохимических целей используется также первичный продукт эпимеризации хирального центра С20 биостеранов – 5α, 14α, 17α, 20S-изомер (для краткости эти изомеры будут дальше называться 5α, 20R; 5α, 20S; 14β, 20R и 14β, 20S).
Для суждения о «зрелости» OB в нефтяной геохимии обычно используют отношение изо-стеранов к α-стеранам.
Катагенез стеранов по соотношениям новообразованных изостеранов (αββ20R + 20S) и исходного биостерана (ααα20R) называют коэффициентом созревания. Иногда используют отношение
54
СПБГУАП | Институт 4 | Группа 4736

vk.com/club152685050
Рис. 11. Связь между составом стеранов и условиями накопления ОВ
значений абсолютной концентрации изостеранов: ααα(20R + 20S)/ (ααα(20R + 20S)+αββ(20R + 20S)). По существу обе эти величины равноценны и отличаются только цифровыми значениями.
Для катагенно более мягких условий, т.е. до пределов главной фазы нефтеобразования (ГФН): Rо<0.4, можно использовать отношение между ααα20S- и ααα20R-стеранами. Связано это с тем, что в стеранах эпимеризация хиральных центров в алифатической цепи (С20) протекает легче, чем в циклической части молекулы.
Кроме того, известный интерес в генетическом плане представляет собой соотношение стеранов С27:С28:С29, которое позволяет установить возможные условия осадконакопления согласно диаграмме (рис. 11).
Кроме того, по соотношению стеранов С28/С29 предложено определять возраст нефти (рис. 12), под которым мы понимаем возраст нефтематеринских толщ. Определение возраста нефти − одна из сложных проблем. Определение возраста на основании указанного отношения справедливо лишь для нефтей морского генезиса, поскольку в ОВ континентального генезиса уже генетически заложена высокая относительная концентрация стерана С29.
55
СПБГУАП | Институт 4 | Группа 4736

vk.com/club152685050
Рис. 12. Отношение С28/С29 регулярных стеранов как функция геоло-
гического времени (Grantham and Wаkеfiе1d, 1988)
Рис. 13. С21-С22-прегнановый индекс как функция геологического времени (на примере нефтей Тимано-Печорской провинции)
(по А.А. Петрову, И.А. Матвеевой, Г.Н. Гордадзе, 2001)
56
СПБГУАП | Институт 4 | Группа 4736

vk.com/club152685050
Возраст органического вещества можно определять также и по низкомолекулярным стеранам состава С21–22 – прегнанам
(рис. 13).
Перегруппированные стераны (диастераны).Перегруппиро-
ванные (структурно измененные) стераны имеют иную структуру, образующуюся вследствие карбоний-ионной перегруппировки стеренов. Реакция эта протекает также и с участием алюмосиликатов, поскольку подобные соединения обнаружены в ряде нефтей. Ниже приведена структурная формула перегруппированных стеранов:
Волнистой чертой отмечены С–Н-связи хиральных центров, реально способных к эпимеризации.
По сравнению с регулярными (обычными) стеранами, в перегруппированных стеранах произошла миграция метильных групп от С10 к С5 и от С13 к С14. Таким образом, перегруппированные стераны являются 5-метил- и 14-метилстеранами и, соответственно, 10-норметил- и 13-норметилстеранами.
Повышенные содержания диастеранов (величины отношения диа/рег стеранов выше 0,3) в нефтях или в ОВ пород свидетельствуют о преимущественно терригенном (глинистом) составе материнских отложений. Низкое отношение диастераны/регулярные стераны в нефтях говорит о бескислородной среде отложения осадка и малоглинистых карбонатных материнских породах.
Гопаны. Тритерпаны наравне с тетрациклическими углеводородами занимают одно из важнейших мест в химии углеводородов каустобиолитов. Они также являются биологическими метками благодаря явной связи с биологическими продуктами. В основе этих углеводородов лежат ядра циклопентанопергидрохризена.
57
СПБГУАП | Институт 4 | Группа 4736
vk.com/club152685050
Углеводороды ряда гопана интересны также тем, что в природных объектах содержатся не только истинные тритерпаны, т.е. различные стереоизомеры состава С30Н52, но и большое число гомологов состава С27–С35, т.е. серия соединений, имеющих одинаковую полициклическую систему, но различающихся длиной алифатического заместителя.
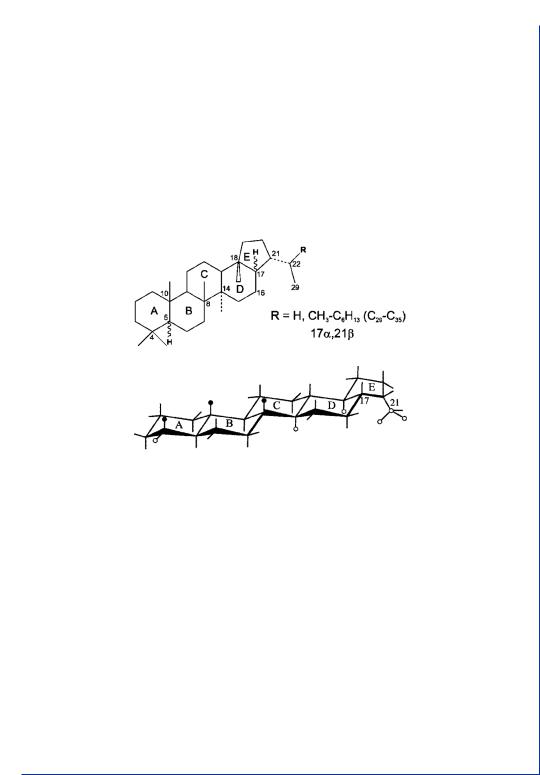
Структурная и пространственная формула и особенности пространственного строения гопанов приведены ниже (сам гопан – родоначальник данной гомологической серии – углеводород состава С30Н52, для него R = СН3):
Углеводороды ряда гопана имеют 21 атом углерода в циклах, шесть метильных заместителей в цикле, из которых четыре являются ангулярными. Сочленение циклов А/В, В/С и C/D – транс-. Сочленение циклов D/Е транс- в биогопане и цис- – в нефтяном гопане. Таким образом, существуют два основных типа гопанов: 17α,21β – нефтяной и 17β, 21β – биологический. Наиболее лабильными в стереохимическом аспекте являются система сочленения циклов D/E и пространственная ориентация замещающего при С-21 радикала. Биологический гопан термодинамически неустойчив из-за неустойчивости транс-сочленения циклов D/E и заслонения связей 21–22 и 17–16 (цис-ориентация замещающего радикала). Эпимеризация хирального центра С17 снимает оба этих напряжения.
58
СПБГУАП | Институт 4 | Группа 4736

vk.com/club152685050
В нефтях, как правило, присутствуют лишь следы гопанов, имеющих «биологическую» конфигурацию (17β,21β). Главная масса гопанов представлена углеводородами 17α,21β-ряда. Биогопаны как весьма неустойчивые соединения найдены лишь в торфе, бурых углях, молодых сланцах и в рассеянном органическом веществе начальных этапов катагенеза. Отметим также, что биогопаны имеют более высокую температуру кипения и при ГЖХ элюируются значительно позже стереоизомерных им нефтяных гопанов (например, биогопан состава С30 элюируется в области нефтяного
гопана С32).
Собственно говоря, название «гопан» применимо лишь к углеводороду состава С30. Углеводород состава С29 называют норметилгопаном или адиантаном, состава С27 (отсутствует заместитель при С21) – триснорметилгопаном. Углеводороды состава C31, C32 и т.д. называются, соответственно, гомогопаном, бисгомогопаном и т.д или, в общем, гомогопанами С31–С35.
Для углеводородов ряда гопана состава C31 и выше, т.е. в тех случаях, когда атом С22 становится хиральным, возможно сущест- вованиедвухэпимеров,отличающихсяR-илиS-конфигурациейхи- рального центра С22. В исходных биогопанах состава С31 и выше атом С22 имеет строго определенную R-конфигурацию. В то же время переход к нефтяным гопанам, кроме уже отмечавшейся эпимеризации С17, сопровождается эпимеризацией центра С22, что проявляется в ряде дублетных пиков, характерных для хроматограмм смеси нефтяных гопанов. Следует отметить несколько большую устойчивость эпимера с S-конфигурацией. В условиях равновесия, а также в нефтях соотношение 22S- и 22R-эпимеров обычно равно 1.2–1.4 (приблизительно 60 и 40%, соответственно). Изомеры, различающиеся конфигурацией С22, несколько напоминают по свойствам аналогичные эпимеры стеранов, различающиеся конфигурацией углеродного атома С20, особенно в βα-диастеранах.
Величина отношения гомогопанов С35/С34 (или С34/С33), большая единицы, свидетельствует о восстановительной среде осадконакопления.
Структурно измененные гопаны. Представляет интерес рассмотрение особенностей стереохимического строения ряда нефтяных гопанов, имеющих несколько измененную структу-
59
СПБГУАП | Институт 4 | Группа 4736
