
Строение атома и периодическая система элементов. Часть 2
.pdfИ. М. ЗЫРЯНОВА, Л. Н. КРУГЛОВА
СТРОЕНИЕ АТОМА И ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ
Часть 2
ОМСК 2000

Министерство путей сообщения Российской Федерации Омский государственный университет путей сообщения
И. М. ЗЫРЯНОВА, Л. Н. КРУГЛОВА
СТРОЕНИЕ АТОМА И ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ
Часть 2
Утверждено редакционно-издательским советом университета в качестве методических указаний к программированному контролю
по химии для студентов 1-го и 2-го курсов
Омск 2000

УДК 546
Строение атома и периодическая система элементов. Часть 2: Методи-
ческие указания к программированному контролю / И.М. Зырянова, Л.Н. Круглова. Омский гос. ун-т путей сообщения. Омск, 2000. 42 с.
Методические указания составлены в соответствии с программой по химии для нехимических вузов. В них рассмотрена структура периодической системы элементов, периодическая зависимость физических и химических свойств веществ от заряда их ядер, предложен ряд контрольных вопросов и заданий.
Предназначены для проведения практических аудиторных занятий и контрольных работ по теме "Строение атома и периодическая система элементов" для студентов заочного и очного обучения нехимических вузов.
Могут оказать помощь при самостоятельном изучении химии.
Библиогр.: 17 назв. Табл. 3. Черт. 22.
Рецензенты: доктор техн. наук В. Р. Ведрученко; доктор физ.-мат. наук И. И. Гончар; канд. техн. наук В. А. Мухин.
C Омский гос. университет путей сообщения, 2000
С О Д Е Р Ж А Н И Е
Введение….................................................……………………………….…5
1.Структура периодической системы. Периодический закон……….......5
1.1.Электронная структура элементов малых периодов (I-III).………….6
1.2.Электронная структура элементов IV и V периодов .......……………9
1.3.Электронная структура элементов VI и VII периодов .....………….10
1.4.Выводы...............................................………………………………….12
2.Периодичность свойств атомов............................……………………...13
2.1.Энергия ионизации атома. Сродство к электрону...............….……..13
2.2.Электроотрицательность................................………………………...15
2.3.Атомные и ионные радиусы..............................……………………...15
2.4.Степень окисления.....................................……………………………18
2.4.1.Периодичность окислительно-восстановительных свойств...................................………………………………………..19
2.4.2.Периодичность свойств соединений………………….....................20
2.4.2.1.Оксиды...........................................………………………………...21
2.4.2.2.Гидроксиды.......................................……………………………...21
2.4.2.3.Гидриды..........................................………………………………..23
2.4.2.4.Галогениды.......................................……………………………....23
3.Контрольные задания................................………………………….......25
4.Семинарское занятие.....................................…………………………...30 Библиографический список.................................………………………....30
Приложения................................................………………………………...32
ВВЕДЕНИЕ
Общая химия представляет собой теоретические основы системы знаний о веществах и химических процессах.
Фундаментальным является учение о строении вещества и о периодичности изменения свойств элементов и их соединений, важность рассмотрения данной темы очевидна: зная строение вещества, можно судить о направлении химического процесса, его скорости и наоборот.
Предлагаемые методические указания предназначены для проведения практических и аудиторных занятий, содержат краткие теоретические сведения, контрольные вопросы и задания.
Одной из форм обучения студентов является самостоятельная работа с учебниками и учебными пособиями. Усвоение курса химии будет успешным при систематической работе.
Для подготовки к практическим занятиям рекомендуется предварительно проработать теоретический материал данных методических указаний, разобрать предложенные примеры. Из библиографического списка рекомендуемой литературы необходимо выбрать несколько учебных пособий и использовать их для более детального и глубокого изучения соответствующего вопроса.
В тексте указаний приведены ссылки на конкретную литературу. Это позволит студентам более эффективно использовать время для подготовки к занятиям.
Практическое занятие по теме "Строение атома и периодическая система элементов" предполагает выполнение конкретного задания и возможность проведения проблемного семинарского занятия для студентов очного обучения. Для подготовки к занятию рекомендуется использовать [3, 7, 9, 10], а также дополнительную научно-техническую литературу, в том числе и по физике.
Студенты заочной формы обучения выполняют рефераты по соответствующей теме.
1. СТРУКТУРА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ. ПЕРИОДИЧЕСКИЙ ЗАКОН
Литература: [4, § 32; 7, § 23; 8, § 8]
Физической основой структуры периодической системы является определенная последовательность формирования электронных конфигураций атомов по мере увеличения заряда ядра (в соответствии с правилом В. Клечковского).
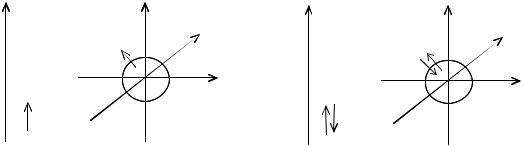
Данная последовательность, которая лежит в основе структуры периодической системы элементов, может быть представлена следующим образом:
n |
1 |
2 |
3 |
4 |
5 |
|
1s2 |
2s22p6 |
3s23p6 |
4s23d104p6 |
5s24d105p6 |
|
|
6 |
|
7 |
|
|
|
6s24f145d106p6 7s25f146d10..., |
(1) |
||
Итак, зная распределение электронов, можно определить строение внешнего электронного уровня, который будет задавать физические и химические свойства веществ, построенных из данного вида атомов.
1.1. Электронная структура элементов малых периодов (I-III)
П е р в ы й п е р и о д (n = 1) состоит из двух элементов: водорода Н (1s1) и гелия Не (1s2) (рис. 1), спин-валентности которых соответственно равны Н(I) и He(0).
W |
Z |
W |
Z |
|
|||
|
|
|
Y |
|
|
|
Y |
|
|
|
|
X |
|
X |
|
|
|
1s1 |
1s1 |
|
|
1s2 |
1s2 |
|
|
|
|
||||
|
|
|
|
||||
1Н |
|
2He |
|
|
|||
|
|
|
а |
|
|
б |
|
|
|
Рис. 1. Энергетические диаграммы водорода и гелия |
|
||||
В т о р о й |
и т р е т и й |
п е р и о д ы |
содержат по восемь элементов. У |
||||
элементов второго периода заполняется второй уровень (n = 2). Рассмотрим эле-
менты Li, B, O, Ne.
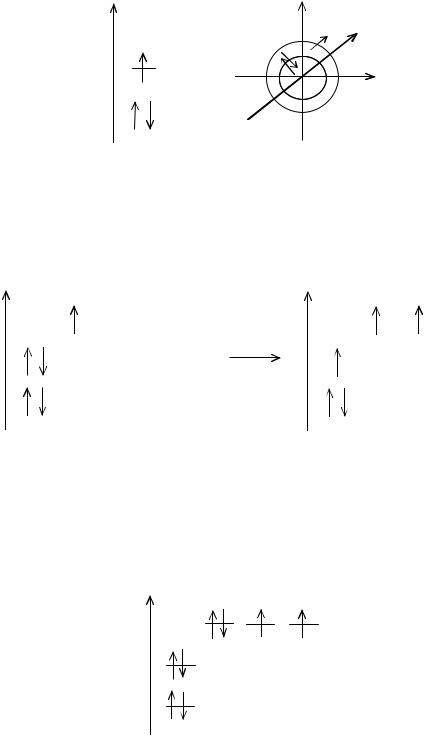
У атома лития 3Li 1s22s1 на внешнем электронном слое находится один элек-трон, спин-валентность Li (I). Элемент проявляет восстановительные свойства (рис. 2).
W |
Z |
||
|
|
2s2 |
Y |
|
|
X |
|
|
|
|
|
|
|
1s1 |
1s22s2 |
|
|
||
3Li |
|
||
Рис. 2. Электронная диаграмма атома лития
Атом бора в возбужденном состоянии проявляет валентность, равную (III) (рис. 3).
W |
W |
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
2p1 |
hν |
|
|
|
|
|
2p2 |
||
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
2s2 |
2s1 |
||||||||||||||
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|||||||||||||
|
|
1s2 |
|
|
|
1s2 |
|||||||||||
|
|
B* |
|||||||||||||||
5B |
|
|
|
|
|
B(III) |
|||||||||||
Рис. 3. Энергетическая диаграмма нормального и возбужденного состояния атома бора
Атом кислорода имеет электронную формулу 8О 1s22s22p4, (рис. 4). Поскольку отсутствуют свободные орбитали в пределах второго слоя, электроны останутся на своих орбиталях. Элемент проявляет постоянную валентность, рав-
ную (II).
W
2p4
2s2
1s2
8О
Рис. 4. Энергетическая диаграмма атома кислорода
Атом Ne имеет завершенный электронный уровень 10Ne 1s22s22p6. У элементов третьего периода (n = 3) заполняется третий слой, состоящий из подуровней 3s, 3p, 3d. Рассмотрим элементы Na, Al, S.
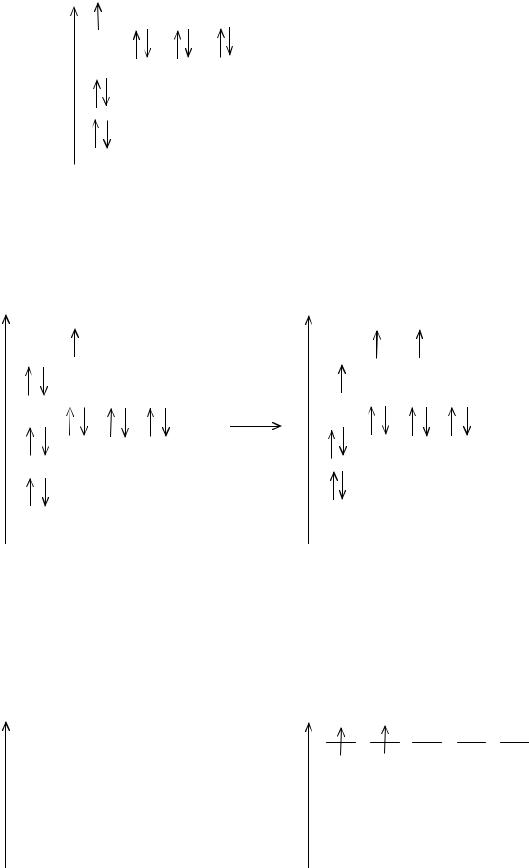
Атом натрия имеет конфигурацию 11Na [1s22s22p6]3s1 или 11Na[Ne]3s1 и проявляет постоянную валентность, равную (I). Является типичным восстановителем: Na0 − 1e = Na+ (рис. 5).
W |
|
|
|
3s1 |
||||||
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
2p6 |
|
|
|
|
|
|
|
|
|
||
|
|
|
|
2s2 |
||||||
|
|
|
|
|||||||
|
|
|
|
1s2 |
||||||
|
|
|
|
|||||||
11Na |
|
|
|
|
|
|
|
|
|
B(I) |
Рис. 5. Энергетическая диаграмма атома натрия
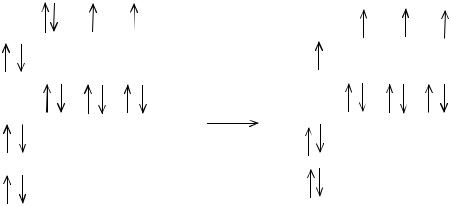
Атом алюминия имеет конфигурацию 13Al1s22s22p63s23p1 13Al[Ne]3s23p1. В возбужденном состоянии проявляет спин-валентность Является восстановителем Al0 − 3e = Al3+ (рис. 6).
W |
|
W |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3p1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3p2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
3s2 |
|
|
|
|
|
|
|
3s1 |
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2p6 |
hν |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2p6 |
|
|
|
|
2s2 |
|
|
|
|
|
|
2s2 |
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
1s2 |
|
|
|
|
|
|
1s2 |
|||||||||||||||||||||
|
|
|
|
|
13Al* |
|||||||||||||||||||||||||||
|
|
|
|
|
||||||||||||||||||||||||||||
13Al |
|
|
|
|
|
|
|
|
|
|
|
|
B(III) |
|||||||||||||||||||
Рис. 6. Энергетическая диаграмма нормального и возбужденного состояния атома алюминия
или
(III).
Валентность атома серы в нормальном состоянии равна (II), в возбуж-
денном состоянии максимальная валентность − (VI). Сера может отдавать электроны (S0 − 6e = S6+) и принимать их (S0 + 2e = S2-). Атом серы имеет конфи-
гурацию 16S 1s22s22p63s23p4 или 16S [Ne] 3s23p4 (рис. 7).
W W
3d2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4s0 |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3p4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3p3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
3s2 |
|
|
|
|
|
|
|
3s1 |
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2p6 |
hν |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2p6 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
2s2 |
|
|
|
|
|
|
2s2 |
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
1s2 |
|
|
|
|
|
|
1s2 |
||||||||||||||||||||||
|
|
|
|
|
16S* |
|
|
|
|
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||
16S |
|
|
|
|
|
|
|
|
|
|
В(II) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
B(III) |
||||||
Рис. 7. Энергетическая диаграмма нормального и возбужденного состояния атома серы
Упоследнего элемента третьего периода Ar (как и у Ne) завершается заполнение s- и p-орбиталей.
Уэлементов третьего периода в отличие от второго во внешнем слое свободными остаются 3d-орбитали, так как согласно правилу Клечковского сначала должны заполняться 4s-орбитали, что равнозначно переходу в четвертый период.
Во втором и третьем периодах наружный слой заполняется до восьми
электронов − конфигурация ns2np6.
1.2. Электронная структура элементов IV и V периодов
Ч е т в е р т ы й п е р и о д содержит восемнадцать элементов. |
Первые |
|
два элемента − К, Са − относятся к s-семейству. |
|
|
Рассмотрим электронную формулу калия: |
|
|
19K[1s22s22p63s23p6]4s1 или |
19K[Ar]4s1. |
(2) |
Ar |
|
|
Спин-валентность калия равна (I), элемент проявляет восстановительные свойства.
В нормальном состоянии электронная формула кальция может быть пред-
ставлена следующим образом: |
|
20Ca[1s22s22p63s23p6]4s2 или 20Ca[Ar]4s2. |
(3) |
Ar |
|
В возбужденном состоянии кальций проявляет валентность, равную (II):
20Ca*[Ar]4s13d04p0. (4)
Уэлементов Sc−Zn идет заполнение 3d-подуровня, эти элементы относятся
кd-семейству. После того, как 3d-орбиталь полностью заселена, начинается за-
полнение p-орбиталей наружного слоя, это происходит у элементов Ga−Kr, они относятся к p-семейству.
Хотя в четвертом периоде количество элементов на десять больше, чем во втором и третьем, наружный слой в завершенном состоянии содержит восемь электронов (s2- и р6-электронов).
В периоде имеется два "проскока" электронов (4s → 3d) − у атомов хрома и
меди.
У элементов V периода наблюдается та же последовательность заполнения, что и в IV периоде: у двух первых s-элементов (Rb, Sr) и шести последних p-элементов (In−Xe) заполняется внешний слой. Между s- и p-элементами располагаются десять d-элементов (Y−Cd), у которых заполняются d-орбитали предвнешнего слоя.
Например,
40Zr [Kr]4d25s2. |
(5) |
Есливчетвертомпериоденаблюдаетсязаполнениеподуровней 4s2 →3d10 →4p6, то в пятом периоде заполнение подуровней электронами осуществляется так: 5s2 →4d10 →5p6.
Электронные "проскоки" свойственны ниобию, молибдену, рутению, серебру и палладию (двойной проскок).
1.3. Электронная структура элементов VI и VII периодов
Шестой период начинается металлами Cs (6s1) и Ba (6s2), спинвалентность которых в нормальном и возбужденном состоянии (I) и (II) соответственно. У элемента 57La (см. f → d переход) очередной электрон находится на 5d-подуровне. Однако последующие элементы (58Ce−57Lu) очередные электроны направляют в глубинный 4f-подуровень.
От элементов 72Hf−80Hg продолжается заполнение 5d-подуровня. Элементы 81Tl−86Rn очередные электроны направляют в 6p-подуровень. Период заканчивается инертным газом (6s26p6).
Седьмой период не окончен и должен быть аналогичен предыдущему, начинается он s-элементами:
87Fr[Rn]7s1 и 88Ra[Rn]7s2. |
(6) |
