
Строение атома и периодическая система элементов. Часть 2
.pdf
2.4.2.1. Оксиды
Кислотно-основной характер соединений меняется от основного к амфотерному, а далее к кислотному:
Na2O, Mgo; |
Al2O3; |
SiO2, P2O5, SO3, Cl2O7. |
Основные |
Амфотерный |
Кислотные оксиды |
оксиды |
оксид |
|
Ионные оксиды образуются s-металлами. Оксиды элементов, расположенных в средней и правой частях периода, являются обычно ковалентными соединениями.
2.4.2.2. Гидроксиды
Na1+OH - очень сильное основание;
Mg2+(OH)2 - основание;
Al3+(OH)3 - амфотерный гидроксид;
H3P5+O4 - слабая кислота;
H2S6+O4 - сильная кислота;
HCl7+O4 -очень сильная кислота.
В периодах радиусы атомов и, соответственно, ионов уменьшаются. Заряд ионов, численно равный высшей степени окисления, соответствующей группы, увеличивается:
Атом |
Na |
Mg |
Al |
Si |
P |
S |
Cl |
Радиус r, нм |
0,156 |
0,136 |
0,125 |
0,117 |
0,110 |
0,104 |
0,099 |
Во всех гидратных соединениях ионы кислорода располагаются вокруг центрального элемента, образуя более или менее прочное соединение. Чем больше заряд и меньше радиус ионов, тем сильнее ионы притягиваются друг к другу, следовательно, прочнее становится связь между центральным ионом и ионом кислорода, а протон удерживается слабее.
Таким образом, по мере уменьшения радиуса и увеличения заряда ионов ослабевают основные свойства гидратных соединений, усиливаются кислотные.
Возможны следующие варианты диссоциации веществ:
1)Э – О – Н Э – О- + Н+;
2)Э – О – Н Э+ + ОН-.

Полярность связей определяется разностью электроотрицательностей. Диссоциация осуществляется по кислотному типу, если
∆ϰэ-о « ∆ϰо-н,
по основному типу, если |
|
∆ϰэ-о » ∆ϰо-н. |
(14) |
В том случае, когда прочности связей близки или равны, то диссоциация может идти по обоим вариантам. В таком случае соединение обладает амфотерным характером.
П р и м е р 3
∆ϰ1 = 2,6; ∆ϰ2 = 1,4 0,9 3,5 2,1
1) Na – O – H; ∆ϰэ-о » ∆ϰо-н.
∆ϰ1 = 2,3; ∆ϰ2 = 1,4
1,2 |
3,5 2,1 |
|
O – H |
2) Mg |
; ∆ϰэ-о > ∆ϰо-н. |
|
O – H |
∆ϰ1 = 2; ∆ϰ2 = 1,4 1,5 3,5 2,1
O − H
3) Al − O − H ; ∆ϰэ-о ≈∆ϰо-н. O − H
(амфотерный характер соединения).
∆ϰ1 = 1; ∆ϰ2 = 1,4 2,5 3,5 2,1
ОO − H
4) |
S |
; ∆ϰэ-о « ∆ϰо-н. |
ОO − H
∆ϰ1 = 0,5 ∆ϰ2 = 1,4
3 3,5 2,1
O
5)O = Cl − O − H; ∆ϰэ-о < ∆ϰо-н. O
Согласно (14) наблюдаем усиление кислотных свойств.
2.4.2.3.Гидриды
Сводородом s-элементы образуют ионные гидриды, которые обладают основными свойствами. Наиболее электроотрицательные р-элементы в правой части периода (S,Cl) образуют ковалентные гидриды, которые обладают кислотными свойствами:
ϰ: 0,9; 2,1; 1,2; 2,1; 1,5; 2,1; 1,8; 2,1; 2,1; 2,1; 2,1; 2,5; 2,1; 3 |
|
|
NaH MgH2 AlH3 SiH4 PH3 |
H2S HCl |
(15) |
В образовании, структуре и свойствах гидридов прослеживается закономерность, описанная выше.
2.4.2.4. Галогениды
Галогениды проявляют сходные периодические изменения. При перемещении вдоль периода от s- к р-элементам наблюдается понижение температуры кипения и температуры плавления.
0,9 3 |
1,2 3 |
1,5 3 |
|
NaCl |
MgCl2 |
AlCl3 |
- твердые вещества; |
1,8 3 |
2,1 3 |
2,5 3 |
|
SiCl4 |
PCl3 |
SCl2 |
- жидкости; |
Cl2 - газообразное вещество.
Ионный характер связи уменьшается при перемещении вправо вдоль периода, ковалентный характер увеличивается.
Итак, расположение элементов в периодической таблице в соответствии с их порядковым номером и внешней электронной конфигурацией обусловливает проявление некоторых важных закономерностей в химических свойствах элементов и их соединений:
1)Элементы со сходными химическими свойствами подразделяются на группы. Например, все щелочные металлы находятся в I группе, а галогены - в VII группе;
2)все наиболее реакционноспособные металлы располагаются в левом углу периодической таблицы. Активность металла постепенно уменьшается при перемещении снизу вверх вдоль каждой группы и при перемещении слева направо вдоль каждого периода;
3)наиболее электроотрицательные элементы, т.е. реакционноспособные неметаллы, располагаются в верхнем правом углу периодической таблицы. Электроотрицательность возрастает при перемещении вдоль каждого периода от I группы к VII и уменьшается при перемещении сверху вниз по каждой группе;
4)электроотрицательность элементов непосредственно связана с типами химических реакций, в которые способны вступить элементы, следовательно, и с типами соединений, образуемых элементами:
а) s-металлы характеризуются способностью легко образовывать катионы, и таким образом, ионные соединения;
б) p-элементы, расположенные ближе к центру периодической таблицы, характеризуются способностью образовывать только ковалентные соединения;
в) более электроотрицательные p-элементы, расположенные ближе к правому краю периодической таблицы, способны образовывать как ковалентные, так и ионные соединения;
5)d-элементы − металлы более электроотрицательные, чем s-элементы. Поэтому их соединения являются либо ионными с высокой степенью ковалентного характера, либо ковалентными. d-элементы обладают способностью образовывать как катионные, так и анионные комплексные ионы, что не характерно для s-элементов.
Таким образом, периодичность электронных структур приводит к периодическому изменению ряда физических и химических свойств: энергии ионизации, сродства к электрону, атомных радиусов, окислительно-восстановительных и других свойств.
Итак, зная положение элемента в периодической системе, строение электронных оболочек, можно предвидеть его основные химические свойства.
П р и м е р 4.
У какого из элементов четвертого периода - марганца или брома - сильнее выражены металлические свойства?
25Mn 1s22s22р63s23p64s23d5; 35Br 1s22s22р63s23p64s23d104p5.
Марганец − d-элемент VII группы; бром − p-элемент VII группы. На внешнем энергетическом уровне у марганца два электрона, у брома − семь.
Атомы металлов характеризуются наличием небольшого числа электронов на внешнем энергетическом уровне. Они легко теряют электроны, проявляя восстановитель–ные свойства. У брома до завершения наружного уровня не хватает одного элек–трона, он легко его принимает, образуя элементарное вещество.
Таким образом, у марганца более выраженные металлические свойства по сравнению с бромом.
П р и м е р 5 Дайте характеристику элементу с порядковым номером 23.
23V1s22s22p63s23p64s23d3.
Двадцать три электрона ванадия располагаются на четырех уровнях, элемент расположен в четвертом периоде. На d-подуровне находятся три электрона, следовательно, это третий d-элемент. Сумма электронов, входящих в наружный уровень 4s2 и в незавершенный 3d3-подуровень, показывает номер побочной (d-элемент) подгруппы. Ванадий находится в VB группе. Это металл, поскольку число электронов на внешнем уровне равно 2, то есть меньше 4. Число электронов, определяющих номер группы, соответствует степени окисления в высшем оксиде элемента (+5). Ванадий образует оксид V2O5. Три неспаренных электрона показывают, что в нормальном состоянии ванадий образует промежуточный оксид V2O3. Следовательно, элемент проявляет две валентности
(III, V).
3. КОНТРОЛЬНЫЕ ЗАДАНИЯ
Литература: [4, § 33,34; 5, § 3; 7, § 23,24]
3.1.Атомы каких элементов четвертого периода не имеют неспаренных электронов в основном состоянии? Напишите электронно-графические формулы этих элементов.
3.2.Внешний электронный уровень атома элемента описывается формулой 4s24p4. Напишите электронно-графическую формулу элемента. Какую валентность может проявлять данный элемент? Напишите формулу соответствующего оксида.
3.3.Определите степень окисления элементов в соединениях: PI3; NH3; C3Cl; H2Se; CaH2; MgCl2; HClO; SiH4. Какие степени окисления характерны для данных элементов? Поясните ответ с помощью электронных конфигураций атомов.
3.4.Вычислите абсолютные значения электроотрицательности элементов
лития и фтора по следующим данным: потенциал ионизации лития − 5,39 эВ;
фтора − 17,42 эВ; сродство к электрону лития − 0,22 эВ; фтора − 3,44 эВ. Какова электроотрицательность фтора, если условно принять электроотрицательность лития равной единице?
3.5.Что такое потенциал ионизации (I1), второй потенциал ионизации (I2), третий потенциал ионизации (I3) и т. д.? Почему I1 < I2 < I3...? Приведите примеры соответствующих энергий ионизаций для отдельных элементов. Используйте табл. П.1.
3.6.Составьте электронно-графические формулы атомов элементов, расположенных: а) в третьем периоде, VI группе; б) в четвертом периоде, IV группе, V ряду; в) в четвертом периоде, IV группе, IV ряду; г) в пятом периоде, VII группе, VII ряду. К какому семейству относится каждый из этих элементов? Дайте общую характеристику каждого элемента.
3.7.Напишите электронные формулы атомов элементов пятого периода VI группы. Что общего у этих элементов и чем они отличаются в химическом отношении?
3.8.Назовите элементы, которым соответствуют следующие электронные формулы: а) 1s22s22p63s23p5; б) 1s22s22p63s23p64s1; в) 1s22s22p63s23p63d104s24p64d105s1.
Ккакому семейству относится каждый из этих элементов? Какие степени окисления проявляют данные элементы? Напишите графические формулы соответствующих ионов. Дайте характеристику каждого элемента.
3.9.Напишите электронно-графические формулы атомов элементов четвертого периода VII группы. Что общего у этих элементов и что отличает их друг от друга в химическом отношении?
3.10.Почему изменение свойств элементов в больших периодах от щелочного металла к благородному газу происходит значительно медленнее, чем в малых периодах?
3.11.Исходя из теории строения атома, объясните, почему хлор при химических реакциях выступает в качестве окислителя, а ионы хлора - в качестве восстановителя?
3.12.Определите, у какого элемента сильнее выражены металлические
свойства: а) Na или Cs; б) K или Cr; в) Rb или Ag. Напишите электронно-графи- ческие формулы ионов: Na+, Cs+, K+, Cr2+, Rb+, Ag+.
3.13.Какими химическими свойствами должен обладать элемент с порядковым номером 34? С каким элементом в периодической системе он должен быть наиболее сходен? Мотивируйте.
3.14.Чем отличаются s-электроны, расположенные на различных уровнях, друг от друга? Что отличает p-электроны друг от друга и от s-электронов в пределах одного и того же уровня? Приведите примеры s- и p-элементов. Найдите соответствующие аналоги в периодической системе.
3.15.Назовите элементы по следующим данным: а) элемент пятого периода (высший его оксид Э2О7) образует с водородом газообразное соединение НЭ;
б) элемент четвертого периода (высший оксид ЭО2) не образует с водородом газообразного соединения; в) элемент четвертого периода (высший оксид ЭО) образует с водородом солеобразное соединение ЭН2. Напишите электронно-гра- фические формулы атомов этих элементов.
3.16.Пользуясь периодической системой элементов, напишите формулы: а) высших оксидов хрома, марганца, олова; б) кислот, соответствующих этим оксидам; в) оксида, гидроксида и нитрата стронция. Напишите электронно-графи- ческие формулы данных элементов, укажите соответствующие степени окисления. Приведите графические формулы ионов.
3.17.Чем отличаются атомы элементов подгруппы скандия от атомов элементов главной подгруппы III группы по строению электронных оболочек? Как это сказывается на их свойствах?
3.18.Чем отличаются атомы лантаноидов от атомов элементов подгруппы скандия по строению электронных оболочек? Какие электроны обусловливают высшую степень окисления лантаноидов?
3.19.В чем выражается периодичность в изменении свойств в ряду лантаноидов? Как это объясняется на основе строения их электронных оболочек? Какова реакционная способность лантаноидов по сравнению с элементами главной подгруппы III группы и подгруппы скандия?
3.20.Какая связь между химической активностью щелочных металлов и строением их атомов? Как изменяются значения первых потенциалов ионизации
вряду Li-Fr? Ответ мотивируйте.
3.21.Напишите электронно-графические формулы атомов элементов скандия и галлия. Почему эти элементы помещены в III группе, но в разных подгруппах?
3.22.Каковы физические и химические свойства бора и таллия? Чем обусловлено различие этих элементов и различие свойств их оксидов?
3.23.Какое сходство и какое различие наблюдается в строении электронных уровней атомов кремния и германия? Как это сказывается на их свойствах?
3.24.Какое сходство и различие наблюдается в строении электронных уровней атомов углерода и олова? Как это отражается на их свойствах?
3.25.Напишите электронно-графические формулы атомов олова и свинца. Какой из этих элементов обладает более выраженными металлическими свойствами? Напишите электронно-графические формулы ионов олова и свинца. Какие окислительно-восстановительные свойства могут проявлять эти ионы?
3.26.Напишите электронное строение атомов элементов побочной подгруппы V группы, сопоставьте их с электронным строением атомов элементов главной подгруппы V группы. Как влияет различие в строении электронных уровней на свойства элементов подгруппы ванадия?
3.27.Укажите различие в строении атомов элементов подгруппы кислорода
ипобочной подгруппы. В чем проявляется сходство свойств элементов главной и побочной подгруппы VI группы и в чем отличие?
3.28.Напишите электронно-графические формулы атомов железа, кобальта, никеля. Почему железо, кобальт и никель обладают высокими температурами плавления и большой твердостью? Почему энергия ионизации атома снижается от железа к никелю?
3.29.Щелочные металлы образуют ионы, имеющие соответствующие электронные конфигурации. Чем эти ионы отличаются от атомов благородных газов? Что у них общего?
3.30.Чем отличаются атомы элементов побочной подгруппы от атомов элементов главной подгруппы II группы по строению электронных оболочек? Почему потенциалы их ионизации больше, чем у атомов элементов главной подгруппы II группы, и как это сказывается на свойствах?
3.31.На каком принципе основана последовательность расположения химических элементов в периодической таблице? Какова закономерность изменения у элементов первых двух периодов: а) атомного радиуса; б) первой энергии ионизации?
3.32.Можно ли по положению элемента в периодической таблице отнести его к металлам или неметаллам? Поясните. Приведите примеры.
3.33.Поясните переход от свойств неметаллических элементов к свойствам металлических элементов, наблюдаемый у элементов IV группы (C, Si, Sn и Pb), основываясь на свойствах их оксидов и хлоридов.
3.34.Опишите закономерности изменения химических свойств хлоридов указанных ниже элементов: а) для элементов третьего периода от Na до S; б) для элементов V группы от N до Bi. Рассмотрите структуру, тип химической связи.
3.35.Чем объясняется относительная химическая инертность благородных газов? Напишите электронно-графические формулы.
3.36.Представьте электронные конфигурации атомов, характерные для элементов четвертого и восьмого периодов.
3.37.Предположим принцип Паули не соблюдается. Изменится ли от этого структура периодической системы элементов?
3.38.Значения первой энергии ионизации атомов элементов второго пе-
риода следующие, эВ: Ne - 21,56; Fe - 17,42; N - 14,53; O - 13,62; C - 11,26; Be - 9,23; B - 8,30; Li - 5,39. Проанализируйте данные, сделайте соответствующие выводы. Можно ли на основании этих данных показать проявление принципа Паули?
3.39.Перечислите основные различия свойств свободных атомов s-, p-, d-
иf-элементов. Напишите электронно-графические формулы.
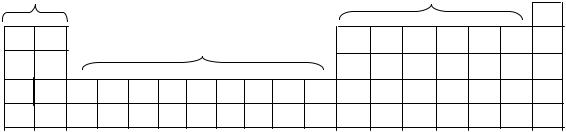
3.40. Часть периодической таблицы элементов изображена на рис. 13. Положение лития, бора и гелия указано их символами (цифрами указано положение элементов, которые предлагаются к рассмотрению).
Область 1 |
|
|
|
Область 3 |
|
|
|
|
Область 2 |
|
|
|
Не |
Li |
|
|
B |
|
|
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
Рис. 13. Фрагмент периодической системы элементов
1) Укажите, в каких областях таблицы расположены s-, p- и d-элементы; 2) Напишите электронное строение элемента № 1. Обозначьте заселенность всех его s- и р-уровней. Больше или меньше первая энергия ионизации элемента № 1, чем у лития? Поясните. 3) Каждый из элементов № 2 и № 5 образует соединение,
вкоторых они имеют степень окисления +3. Укажите, как изменяется электронная конфигурация свободных элементов № 2 и № 5 при изменении степени окисления до +3. 4) Какой из элементов № 2, 3, 4 вероятнее всего имеет наибольшее число степеней окисления? 5) Какой из элементов № 5, 6, 7 должен иметь наибольшую энергию ионизации и почему? 6) Каждый из элементов № 5, 6 имеет валентность, равную трем. Какую форму должны иметь молекулы газообразных мономерных хлоридов этих элементов? В чем причины различия их формы?
3.41.Объясните, от каких важнейших факторов зависит закономерность изменения физических и химических свойств элементов в пределах одной и той же группы периодической таблицы. Предскажите, какими должны быть: а) физические свойства цезия, его реакция с водой; б) металлический характер висмута.
3.42.Объясните следующую электронную формулу: 1s22s22p63s23p63d104s2 4p64d105s2. Назовите элемент. Дайте его характеристику, используя его положение
втаблице Д. И. Менделеева. Напишите, если это возможно, его возбужденное состояние.
3.43.Перечислите электронные аналоги среди элементов VI группы периодической системы элементов. Напишите в общем виде электронные формулы этих элементов.
3.44.На каком основании хром и сера, фосфор и ванадий расположены в одной группе периодической системы? Почему их помещают в разных подгруппах?
3.45.Назовите элемент, у которого количество электронных слоев не совпадает с номером периода. Почему? Дайте обоснованный ответ.
3.46.У какого элемента четвертого периода − хрома или селена − сильнее выражены металлические свойства? Какой из этих элементов образует газообразное соединение с водородом? Ответ мотивируйте строением атомов хрома и селена.
3.47.У какого из р-элементов пятой группы периодической системы − фосфора или сурьмы − сильнее выражены неметаллические свойства? Какое из водородных соединений данных элементов будет более сильным восстановителем? Ответ мотивируйте строением атомов этих элементов.
3.48.Исходя из положения металла в периодической системе дайте мотивированный ответ на вопрос: какой из двух гидроксидов более сильное основание: Ba(OH)2 или Mg(OH)2; Ca(OH)2 или Fe(OH)2; Cd(OH)2 или Sr(OH)2.
3.49.Атомные массы элементов в периодической системе постепенно увеличиваются, тогда как свойства простых веществ изменяются периодически. Почему? Дайте мотивированный ответ.
3.50.Какова современная формулировка периодического закона? Объясните, почему в периодической системе элементов аргон, кобальт, теллур, торий помещены соответственно перед калием, никелем, иодом, протактинием, хотя и имеют большую атомную массу.
3.51.Элементы кремний и титан расположены в одной группе периодической системы. Составьте электронные формулы этих элементов и скажите, можно ли считать их элементами-аналогами. Ответ поясните.
4.СЕМИНАРСКОЕ ЗАНЯТИЕ
Кобсуждению предлагаются следующие темы:
1)Идеальная периодическая система элементов. Прогнозирование.
2)Элементы больших периодов. Синтез и химические свойства.
3)Периодичность физических свойств простых веществ.
4)Положение элемента в периодической системе элементов и его способность образовывать соединения различного типа.
5)Темы, предложенные студентами.
Библиографический список
1. А х м е т о в Н. С. Общая и неорганическая химия. М.: Высшая школа, 1981. 670 с.
