
- •Цитохимическая характеристика лимфобластов:
- •Классификация Всемирной Организации Здравоохранения:
- •Иммунофенотипическая классификация Европейской группы по иммунологической характеристике лейкозов (EGIL).
- •Критерии высокого риска [2, 11-14]:
- •Протоколы GMALL.
- •Исследования GMALL 01/81-04/89.
- •Исследование GMALL 05/93.
- •Исследования GMALL 06/99 и 07/2003.
Таким образом, было решено для пожилых пациентов, разработать протокол с меньшей токсичностью, для пациентов из группы высокого риска предусмотреть раннее проведение трансплантации костного мозга. Pro-B-ОЛЛ требует более интенсивной терапии, которая может улучшить прогноз при этом варианте, даже без трансплантации костного мозга.
Протокол GMALL 05/93. [35]
Препарат |
Доза |
Дни |
|
Индукция (Фаза I) |
|
|
|
Преднизолон |
60 |
мг/м2внутрь |
1-28 |
Винкристин |
2 мг/м2в/в |
1, 8, 15, 22 |
|
Даунорубицин |
45 |
мг/м2 в/в (30 мин) |
1, 8, 15, 22 |
L-аспарагиназа |
5000 Ед/м2 в/в (30 мин) |
15-28 |
|
Метотрексат |
15 |
мг интратекально |
1 |
Индукция (Фаза II) |
|
|
|
Циклофосфамид |
1000 мг/м2в/в |
29, 43, 57 |
|
Цитозин-арабинозид |
75 |
мг/м2 в/в (1 ч) |
31-34, 38-41, 45-48, 52-55 |
6-Меркаптопурин |
60 |
мг/м2 внутрь |
29-57 |
Метотрексат |
15 |
мг интратекально |
31, 38, 45, 52 |
Консолидация I |
|
|
|
HDAC/MITOX |
|
|
|
Цитозин-арабинозид |
2 х 1000 мг/м2в/в (3 ч) |
1-4 |
|
Митоксантрон |
10 |
мг/м2 в/в (30 мин) |
3-5 (2-5) |
HDMTX/ASP |
|
|
|
Метотрексат |
1500 мг/м2в/в (24 ч) |
1, 15 |
|
Аспарагиназа |
10 |
000 Ед/м2 в/в |
2, 16 |
6-Меркаптопурин |
60 |
мг/м2 внутрь |
1-5, 15-19 |
Реиндукция (фаза I) |
|
|
|
Преднизолон |
60 |
мг/м2 внутрь |
1-28 |
Винкристин |
2 мг/м2 в/в |
1, 8, 15, 22 |
|
Доксорубицин |
25 |
мг/м2 в/в (30 мин) |
1, 8, 15, 22 |
Метотрексат |
15 |
мг интратекально |
1 |
Цитарабин |
40 |
мг интратекально |
1 |
Дексаметазон |
4 мг интратекально |
1 |
|
Реиндукция (фаза II) |
|
|
|
Циклофосфамид |
1000 мг/м2 в/в |
29 |
|
Цитозин-арабинозид |
75 |
мг/м2 в/в (1 ч) |
31-34, 38-41 |
Тиогуанин |
60 |
мг/м2 внутрь |
29-42 |
Метотрексат |
15 |
мг интратекально |
29 |
Цитарабин |
40 |
мг интратекально |
29 |
Дексаметазон |
4 мг интратекально |
29 |
|
Консолидация II |
|
|
|
VM26/ARAC |
|
|
|
Этопозид |
100 мг/м2 в/в (1 ч) |
1-5 |
|
Цитозин-арабинозид |
150 мг/м2 (1 ч) |
1-5 |
|
CYCLO/ARAC |
|
|
|
Циклофосфамид |
1000 мг/м2 в/в |
1 |
|
Цитозин-арабинозид |
500 мг/м2 (24 ч) |
1 |
|
Исследования GMALL 06/99 и 07/2003.
Протокол GMALL 06/99 был начат как пилотное исследование. Основная цель заключалась в разработке нового, более короткого и интенсивного режима
индукции, построенному на новых принципах в сравнении с предыдущими протоколами. Основные отличия заключались в следующем:
•Использование дексаметазона вместо преднизолона для повышения антилейкемического эффекта и профилактики нейролейкоза;
•Предфаза с циклофосфамидом и кортикостероидами;
•Использование G-CSF одновременно с химиотерапией;
•Интенсификация введения даунорубицина – два двухдневных введения вместо четырех еженедельных;
•Одно введение PEG-аспарагиназы вместо 14 введений L-аспарагиназы в индукции.
IIфаза индукции и консолидация I остались без изменений. Пациентам с высоким и очень высоким (Ph+) риском планировалась аллогенная трансплантация ГСК в первой ремиссии. Пациенты со стандартным риском получали шесть курсов консолидации и реиндукцию. Поддерживающая терапия выбиралась в зависимости от наличия минимальной резидуальной болезни.
Протокол GMALL 07/2003.
Препарат |
Доза |
Дни |
|
Предфаза |
|
|
1-5 дни |
Метотрексат |
15 |
мг интратекально |
1 |
Дексаметазон |
10 |
мг/м2 внутрь |
1-5 |
Циклофосфамид |
200 мг/м2 в/в (1 ч) |
3-5 |
|
Ритуксимаб |
375 мг/м2 в/в |
6 |
|
(При CD20+ В-ОЛЛ) |
|
|
|
Индукция (Фаза I) |
|
|
6-10 дни |
Дексаметазон |
10 |
мг/м2внутрь |
6-7 и 13-16 |
Винкристин |
2 мг/м2в/в (болюс) |
6, 13, 20 |
|
Даунорубицин |
45 |
мг/м2 в/в (15 мин) |
6-7, 13-14 |
> 55 лет |
30 мг/м2 |
|
|
PEG-аспарагиназа |
2000 Ед/м2в/в (2 ч) |
20 |
|
> 55 лет |
1000 Ед/м2 |
|
|
G-CSF |
5 мкг/кг п/к |
С 6 дня |
|
При инициальной нейтропении |
|
|
С 1 дня |
менее 500 /мкл |
|
|
|
Контроль ремиссии |
|
|
11 |
|
|
|
26 (+ МРБ) |
Индукция (Фаза II) |
|
|
26-46 дни |
Метотрексат |
15 |
мг интатекально |
28, 35, 42 |
Циклофосфамид |
1000 мг/м2в/в (1 ч) |
26, 46 |
|
Цитозин-арабинозид |
75 |
мг/м2 в/в (1 ч) |
28-31, 35-38, 42-45 |
6-Меркаптопурин |
60 |
мг/м2 внутрь |
33-53 |
G-CSF |
5 мкг/кг п/к |
С 26 дня |
|
Облучение ЦНС |
24 |
Гр |
26-46 |
Контроль ремиссии |
|
|
46 (+МРБ) |
Консолидация I |
|
|
71 |
Дексаметазон |
10 |
мг/м2 внутрь |
1-5 |
Виндезин |
3 мг/м2 в/в (болюс) |
1 |
|
|
Max 5 мг |
|
|
Метотрексат |
1,5 г/м2 в/в (24 ч) |
1 |
|
> 55 лет |
1 г/м2 |
|
|
Этопозид |
250 мг/м2 (1 ч) |
4, 5 |
|
Цитозин-арабинозид |
2 х 2 г/м2 (3 ч) |
5 |
|
> 55 лет |
2 х 1 г/м2 |
|
|
G-CSF |
5 мкг/кг п/к |
С 7 дня |
|
Профилактика |
|
12 |
|
нейролейкемии (триплет) |
|
|
|
Аферез ГСК |
Все пациенты |
|
|
Контроль ремиссии |
|
71 |
(+ МРБ) |
Консолидация II |
|
16 |
неделя |
Метотрексат |
1,5 г/м2 в/в (24 ч) |
1, 15 |
|
> 55 лет |
1 г/м2 |
|
|
PEG-аспарагиназа |
2000 Ед/м2в/в (2 ч) |
2, 16 |
|
> 55 лет |
1000 Ед/м2 |
|
|
6-Меркаптопурин |
60 мг/м2 внутрь |
1-7, 15-21 |
|
Контроль ремиссии |
|
22 |
неделя |
Реиндукция I |
|
22 |
неделя |
Преднизолон |
60 мг/м2внутрь |
1-14 |
|
Виндезин |
3 мг/м2 в/в (болюс) |
1, 7 |
|
|
Max 5 мг |
|
|
Доксорубицин |
50 мг/м2 (15 мин) |
1, 7 |
|
Профилактика |
|
1, 15 |
|
нейролейкемии (триплет) |
|
|
|
Реиндукция II |
|
24 |
неделя |
Циклофосфамид |
1000 мг/м2в/в (1 ч) |
15 |
|
Цитозин-арабинозид |
75 мг/м2 в/в (1 ч) |
17-20, 24-27 |
|
Тиогуанин |
60 мг/м2 внутрь |
15-28 |
|
Контроль ремиссии |
|
30 |
неделя (+МРБ) |
Консолидация III |
|
30 |
неделя |
Метотрексат |
1,5 г/м2 в/в (24 ч) |
1, 15 |
|
> 55 лет |
1 г/м2 |
|
|
PEG-аспарагиназа |
2000 Ед/м2в/в (2 ч) |
2, 16 |
|
> 55 лет |
1000 Ед/м2 |
|
|
6-Меркаптопурин |
60 мг/м2 внутрь |
1-7, 15-21 |
|
Консолидация IV |
|
36 |
неделя |
Цитозин-арабинозид |
1000 мг/м2 в/в (3 ч) |
1, 3, 5 |
|
Профилактика |
|
6 |
|
нейролейкемии (триплет) |
|
|
|
Контроль ремиссии |
|
41 |
неделя |
Консолидация V |
|
41 |
неделя |
Циклофосфамид |
1000 мг/м2в/в (1 ч) |
1 |
|
Цитозин-арабинозид |
500 мг/м2 в/в (24 ч) |
1 |
|
Профилактика |
|
1 |
|
нейролейкемии (триплет) |
|
|
|
Консолидация VI |
|
46 |
неделя |
Метотрексат |
1,5 г/м2 в/в (24 ч) |
1, 15 |
|
> 55 лет |
1 г/м2 |
|
|
PEG-аспарагиназа |
2000 Ед/м2в/в (2 ч) |
2, 16 |
|
> 55 лет |
1000 Ед/м2 |
|
|
6-Меркаптопурин |
60 мг/м2 внутрь |
1-7, 15-21 |
|
Профилактика |
|
52 |
неделя |
нейролейкемии (триплет) |
|
|
|
Контроль ремиссии |
|
52 |
неделя (+МРБ) |
В исследование было включено 843 пациента с медианой возраста 36 лет. Частота полных ремиссий составляла 83%. Ранняя смертность – 7%. Использование в индукционной терапии дексаметазона увеличило вероятность достижения ремиссии. Снижение дозы дексаметазона привело к уменьшению
летальности на фоне индукционной терапии за счет снижения частоты тяжелых инфекционных осложнений. Более раннее использование G-CSF привело к существенному уменьшению нейтропений III/IV степени и, вероятно, мукозитов [36]. Оптимизированный режим индукции использовался в протоколе GMALL 07/2003 и продолжает использоваться в протоколе GMALL 08/2010. Предварительные результаты подтверждают высокую эффективность модифицированного режима индукции – полные ремиссии достижимы в 89% случаев при ранней летальности 4% [36]. Дополнительными модификациями были использование иматиниба в процессе индукции при Ph позитивном ОЛЛ и ритуксимаба при В-ОЛЛ с экспрессией CD20.
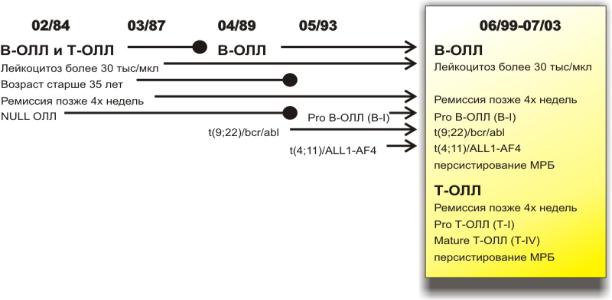
Эволюция критериев высокого риска в исследованиях GMALL 02/84 - 07/2003.
Одним из важных достижений Немецкой группы по изучению ОЛЛ у взрослых является разработка прогностических критериев заболевания, которые позволяют оптимизировать лечение. В течение 30 лет критерии, которые позволяли отнести пациента к группе высокого риска, менялись (рисунок), но два клинических критерия сохраняют актуальность до настоящего времени – лейкоцитоз более 30 х 109/л и отсутствие ремиссии после завершения первой фазы индукции. Очень важным было введение в число критериев цитогенетических, молекулярногенетических маркеров и, в последних исследованиях, минимальной резидуальной болезни.
a) Терапия спасения (уровень доказательности D) [37].
Блинатумомаб представляет собой биспецифическое одноцепочное антитело, таргетное к антигену CD 19. Данный препарат относится к новому классу антител, которые перенаправляют Т-клетки для специфического лизиса опухолевых клеток. В настоящее время блинатумомаб используется для лечения пациентов с рецидивом, рефрактерным течением острого лимфобластного лейкоза, либо персистенцией МРБ. В США проведено исследование, в которое была включена группа, состоящая из 21 пациента с персистенцией МРБ, включая специфические абберации – BCR/ABL и MLL/AF4, которые получали блинатумомаб по
следующей схеме: 15 мкг/м2 в виде 24-часовой инфузии в течение 4х недель. Далее делался перерыв в течение 2х недель. У 16 пациентов из данной группы достигнута полная ремиссия, с отрицательной МРБ. У 12 пациентов из этих 16 было рефрактерное течение заболевание, без ответа на предыдущую химиотерапию. Таким образом, безрецидивная выживаемость составила 78%, медиана наблюдения
405дней.
b)Особенности введения беременных с острым лимфобластным лейкозом
(уровень доказательности С) [38-39].
При диагностике острого лимфобластного лейкоза в первый триместр беременности до начала химиотерапии рекомендуется обсудить вопрос о прерывании беременности. Химиотерапия в первом триместре беременности имеет 10-20% риск развития тяжелых аномалий развития. Химиотерапию у беременных рекомендуется начинать не раньше второго триместра (после 14-15 недель гестации), когда завершается формирование гемоплацентарного барьера. Препараты в высоких дозах могут проникать через гематоэнцефалический барьер. Использование высоких доз метотрексата во время беременности ассоцируется с развитием аминоптеринового синдрома (диостоз черепа, задержка окостенения, гипертелоризм, микрогнатия, аномалия глаз). Иматиниб не проникает через гематоэнцефалический барьер и, вероятно, через гематоплацентарный барьер. Поэтому врожденные аномалии очек, костей, головного мозга, кишечника и сердца при использовании данного препарата возможны только при использовании в первом триместре, причем данная патология возникает в 19% случаев.
При проведении терапии у беременных необходимо исключить использование фторхинолонов (риск развитии артропатии, нарушение остеогенеза), сульфаниламидов (дефекты нервной трубки, мальформация сердца).
Применение циклофосфамида, треотинина, ритуксимаба во втором и третьем триместрах является безопасным для плода.
По данным двух ретроспективных исследований, охвативших соответственно 84 и 111детей, матери которых получали в период беременности химиотерапию по поводу гемобластозов и других опухолей, в отдаленном периоде (медиана наблюдения 18,7 лет) не выявлено нарушений нервно-психического, полового развития и увеличения риска новообразований.
c)Трансфузионая поддержка.
Показания к проведению трансфузионной терапии определяются в первую
очередь клиническими проявлениями индивидуально для каждого пациента с учетом возраста, сопутствующих заболеваний, переносимости химиотерапии и развития осложнений на предыдущих этапах лечения.
Лабораторные показатели для определения показаний имеют вспомогательное значение, в основном для оценки необходмиости профилактичесиких трансфузий концентрата тромбоцитов.
Показания к трансфузиям также зависят от времени, после проведения курса химиотерапии – принимаются во внимание, прогнозируемое снижение показателей
вближайшие несколько дней.
Эритроцитарная масса/взвесь (уровень доказательности D):
•Уровень гемоглобина не нужно повышать, пока обычные резервы и компенсационные механизмы достаточны для удовлетворения потребностей тканей в кислороде;
•Существует только одно показание для трансфузий эритроцитсодержащих сред при хронических анемиях – симптомная анемия (проявляющаяся тахикардией, одышкой, стенокардией, синкопе, de novo депрессией или элевацией ST);
•Уровень гемоглобина менее 30 г/л является абсолютным показанием для трансфузии эритроцитов;
•При отсутствии декомпенсированных заболеваний сердечно-сосудистой системы и легких показаниями для профилактической трансфузии эритроцитов при хронических анемиях могут быть уровни гемоглобина:
Возраст (лет) |
Триггерный уровень Hb (г/л) |
<25 |
35-45 |
25-50 |
40-50 |
50-70 |
55 |
>70 |
60 |
Концентрат тромбоцитов (уровень доказательноти D):
•При снижении уровня тромбоцитов менее 10 х109/л или появлении геморрагических высыпаний на коже (петехии, синячки) проводится профилактическая трансфузия аферезных тромбоцитов.
•Профилактическая трансфузия аферезных тромбоцитов у пациентов с
лихорадкой, пациентам, которым планируется инвазивное вмешательство может проводится при более высоком уровне - 10 х109/л.
•При наличии геморрагического синдрома петехиально-пятнистого типа (носовые, десневые кровотечения, мено-, метроррагии, кровотечения других локализаций) трансфузия концентрата тромбоцитов проводится с лечебной целью.
Свежезамороженная плазма (уровень доказательноти D):
•Трансфузии СЗП проводятся у пациентов с кровотечением или перед проведением инвазивных вмешательств;
•Пациенты с МНО ≥2.0 (при нейрохирургических вмешательствах ≥1.5) рассматриваются как кандидаты для трансфузии СЗП при планировании инвазивных процедур. При плановых вмешательствах возможно назначение не менее, чем за 3 дня до вмешательства фитоменадиона не менее 30 мг/сут внутривенно или внутрь.
14.2.1 Медикаментозное лечение, оказываемое на амбулаторном уровне:
− перечень основных лекарственных средств с указанием формы выпуска (имеющих 100% вероятность применения):
Антинеопластические и иммуносупрессивные лекарственные средства
•винкристин, 1 мг, для инъекций;
•даунорубицин, порошок лиофилизированный для приготовления раствора для инъекций или раствор для внутривенного введения 20мг;
•дексаметазон, раствор для инъекций 4мг/мл 1 мл;
•доксорубицин, для инфузий, 10мг;
•идарубцин*, 5 мг, флакон;
•иматиниб, таблетка 100 мг;
•нилотиниб, таблетка 100 мг;
•меркаптопурин*, таблетка 50 мг;
•метилпреднизолон, порошок для приготовления раствора для внутривенных инфузий, 250 мг;
•метотрексат, раствор для инъекций 10 мг/мл 1,5 мл, лиофилизат для приготовления раствора для инъекций, 500 мг;
•преднизолон, таблеки 5мг;
•ритуксимаб, концентрат для приготовления раствора для внутривенных инфузий 10мг/50мл, 10мг/10мл;
•циклофосфамид, лиофилизат/порошок для приготовления раствора для инъекций 200 мг, 500 мг, 1000 мг;
•цитарабин, порошок лиофилизированный для приготовления раствора для инъекций 100 мг, 1000 мг;
•L-аспарагиназа, лиофилизат для приготовления раствора для внутривенного и внутримышечного введения 10 000 МЕ, 5000 МЕ;
•ПЭГ-L-аспарагиназа, 3750 МЕ, флакон.
−перечень дополнительных лекарственных средств с указанием формы выпуска (менее 100% вероятности применения):
Лекарственные средства, ослабляющие токсическое действие противоопухолевых препаратов:
•филграстим, раствор для инъекций 0,3мг/мл, 1 мл;
•ондансетрон, раствор для инъекций 8 мг/4мл;
•уромитексан, флакон;
•кальция фолинат, раствор ИЛИ натрия фолинат, раствор.
Антибактериальные средства:
•азитромицин, таблетка/капсула, 500 мг;
•амоксициллин/клавулановая кислота, таблетка, покрытая пленочной оболочкой, 1000мг;
•моксифлоксацин, таблетка, 400 мг;
•офлоксацин, таблетка, 400 мг;
•ципрофлоксацин таблетка, 500 мг;
•метронидазол, таблетка, 250 мг, гель стоматологический 20г;
•эритромицин, таблетка 250мг.
Противогрибковые лекарственные средства:
•анидулафунгин, лиофилизированный порошок для приготовления раствора для инъекций, 100 мг/флакон;
•вориконазол, таблетка, 50 мг;
•итраконазол, раствор для приема внутрь10мг/мл 150,0;
•каспофунгин, лиофилизат для приготовления раствора для инфузий 50 мг;
•клотримазол, раствор для наружного применения 1% 15мл;
•микафунгин, порошок лиофилизированный для приготовления раствора для инъекций 50 мг, 100 мг;
•флуконазол, капсула/таблетка 150 мг.
Противовирусные лекарственные средства:
•ацикловир, таблетка, 400 мг, гель в тубе 100000ЕД 50г;
•валацикловир, таблетка, 500 мг;
•валганцикловир, таблетка, 450 мг;
•фамцикловир, таблетки, 500 мг.
Лекарственные средства, применяемые при пневмоцистозе:
• сульфаметоксазол/триметоприм, таблетка 480 мг.
Растворы, применяемые для коррекции нарушений водного, электролитного
икислотно-основного баланса:
•вода для инъекций, раствор для инъекций 5мл;
•декстроза, раствор для инфузий 5% 250мл;
•натрия хлорид, раствор для инфузий 0,9% 500мл.
Лекарственные средства, влияющие на свертывающую систему крови:
•гепарин, раствор для инъекций 5000 МЕ/мл, 5 мл; (для промывания катетера);
•надропарин, раствор для инъекций в предварительно наполненных шприцах, 2850 МЕ анти-Ха/0,3 мл, 5700 МЕ анти-Ха/0,6 мл;
•ривароксабан, таблетка;
•транексамовая кислота, капсула/таблеткаь 250 мг;
•эноксапарин, раствор для инъекций в шприцах 4000 анти-Ха МЕ/0,4 мл, 8000 анти-Ха МЕ/0,8 мл.
Другие лекарственные средства:
•амброксол, раствор для приема внутрь и ингаляций, 15мг/2мл, 100мл;
•амлодипин, таблетка/капсула 5 мг;
•атенолол, таблетка 25мг;
•ацетилцистеин, порошок для приготовления раствора для приема внутрь, 3 г;
•дексаметазон, капли глазные 0,1% 8 мл;
•дифенгидрамин, раствор для инъекций 1% 1 мл;
•дротаверин, таблетка 40 мг;
•кетопрофен, раствор для инъекций 100 мг/2мл;
•лактулоза, сироп 667г/л по 500 мл;
•левофлоксацин, таблетка, 500 мг;
•лидокаин, раствор для инъекций, 2% по 2 мл;
•лизиноприл, таблетка 5мг;
•метилпреднизолон, таблетка, 16 мг;
•метилурацил, мазь для местного применения в тубе 10% 25г;
•омепразол, капсула 20 мг;
•повидон– йод, раствор для наружного применения 1 л;
•преднизолон, таблетка, 5 мг;
•смектит диоктаэдрический, порошок для приготовления суспензии для приема внутрь 3,0 г;
•спиронолактон, капсула 100 мг;
•торасемид, таблетка 10мг;
•фентанил, система терапевтическая трансдермальная 75 мкг/ч; (для лечения хронических болей у онкологических больных)
•хлорамфеникол, сульфадиметоксин, метилурацил, тримекаин мазь для
наружного применения 40г;
•хлоргексидин, раствор 0,05% 100мл;
•хлоропирамин, раствор для инъекций 20 мг/мл 1мл.
14.2.2Медикаментозное лечение, оказываемое на стационарном уровне:
−перечень основных лекарственных средств с указанием формы выпуска (имеющих 100% вероятность применения) [27]:
Антинеопластические и иммуносупрессивные лекарственные средства:
•винкристин, 1 мг, для инъекций;
•даунорубицин, порошок лиофилизированный для приготовления раствора для инъекций или раствор для внутривенного введения 20мг;
•дексаметазон, раствор для инъекций 4мг/мл 1 мл;
•доксорубицин, для инфузий, 10мг;
•идарубцин*, 5 мг, флакон;
•иматиниб, таблетка 100 мг;
•нилотиниб, таблетка 100 мг;
•меркаптопурин*, таблетка 50 мг;
•метилпреднизолон, порошок для приготовления раствора для внутривенных инфузий, 250 мг;
•метотрексат, раствор для инъекций 10 мг/мл 1,5 мл, лиофилизат для приготовления раствора для инъекций, 500 мг;
•преднизолон, таблеки 5мг;
•ритуксимаб, концентрат для приготовления раствора для внутривенных инфузий 10мг/50мл, 10мг/10мл;
•циклофосфамид, лиофилизат/порошок для приготовления раствора для инъекций 200 мг, 500 мг, 1000 мг;
•цитарабин, порошок лиофилизированный для приготовления раствора для инъекций 100 мг, 1000 мг;
•L-аспарагиназа, лиофилизат для приготовления раствора для внутривенного и внутримышечного введения 10 000 МЕ, 5000 МЕ;
•ПЭГ-L-аспарагиназа, 3750 МЕ, флакон.
−перечень дополнительных лекарственных средств с указанием формы выпуска (менее 100% вероятности применения):
Антинеопластические и иммуносупрессивные лекарственные средства:
•блинотумомаб*, 35 мкг, флакон;
Лекарственные средства, ослабляющие токсическое действие противоопухолевых препаратов:
•филграстим, раствор для инъекций 0,3мг/мл, 1 мл;
•ондансетрон, раствор для инъекций 8 мг/4мл;
•уромитексан, флакон;
•кальция фолинат, раствор ИЛИ натрия фолинат, раствор.
Антибактериальные средства:
•азитромицин, таблетка/капсула, 500 мг, порошок лиофилизированный для приготовления раствора для внутривенных инфузий, 500 мг;
•амикацин, порошок для инъекций, 500 мг/2 мл или порошок для приготовления раствора для инъекций, 0,5 г;
•амоксициллин/клавулановая кислота, таблетка, покрытая пленочной оболочкой, 1000мг, порошок для приготовления раствора для внутривенного и внутримышечного введения 1000 мг+500 мг;
•ванкомицин, порошок/лиофилизат для приготовления раствора для инфузий
1000 мг;
•гентамицин, раствор для инъекций 80мг/2мл 2мл;
•имипинем, циластатин порошок для приготовления раствора для инфузий, 500 мг/500 мг;
•колистиметат натрия*, лиофилизат для приготовления раствора для инфузий 1 млн ЕД/флакон;
•метронидазол таблетка, 250 мг, раствор для инфузий 0,5% 100мл, гель стоматологический 20г;
•левофлоксацин, раствор для инфузий 500 мг/100 мл, таблетка 500 мг;
•линезолид, раствор для инфузий 2 мг/мл;
•меропенем, лиофилизат/порошок для приготовления раствора для инъекций
1,0 г;
•моксифлоксацин, таблетка 400 мг, раствор для инфузий 400 мг/250 мл
•офлоксацин, таблетка 400 мг, раствор для инфузий 200 мг/100 мл;
• пиперациллин, тазобактам |
порошок для приготовления раствора для |
инъекций 4,5г; |
|
•тигециклин*, лиофилизированный порошок для приготовления раствора для инъекций 50 мг/флакон;
•тикарциллин/клавулановая кислота, порошок лиофилизированный для приготовления раствора для инфузий 3000мг/200мг;
•цефепим, порошок для приготовления раствора для инъекций 500 мг, 1000 мг;
•цефоперазон, сульбактам порошок для приготовления раствора для инъекций 2 г;
•ципрофлоксацин, раствор для инфузий 200 мг/100 мл, 100 мл, таблетка 500 мг;
•эритромицин, таблетка 250мг;
•эртапенем лиофилизат, для приготовления раствора для внутривенных и внутримышечных инъекций 1 г.
Противогрибковые лекарственные средства:
•амфотерицин В*, лиофилизированный порошок для приготовления раствора для инъекци, 50 мг/флакон;
•анидулофунгин, лиофилизированный порошок для приготовления раствора для инъекций, 100 мг/флакон;
•вориконазол, порошок для приготовления раствора для инфузий 200 мг/флакон;
•вориконазол, таблетка, 50 мг;
•итраконазол, раствор для приема внутрь10мг/мл 150,0;
•каспофунгин, лиофилизат для приготовления раствора для инфузий 50 мг;
•клотримазол, крем для наружного применения 1% 30г, раствор для наружного применения 1% 15мл;
•микафунгин, порошок лиофилизированный для приготовления раствора для инъекций 50 мг, 100 мг;
•флуконазол, капсула/таблетка 150 мг, раствор для инфузий 200 мг/100 мл, 100 мл.
Противовирусные лекарственные средства:
•ацикловир, крем для наружного применения, 5% - 5,0, таблетка - 400 мг, порошок для приготовления раствора для инфузий, 250 мг;
•валацикловир, таблетка, 500мг;
•валганцикловир, таблетка, 450мг;
•ганцикловир*, лиофилизат для приготовления раствора для инфузий 500мг;
•фамцикловир, таблетки,500мг №14.
Лекарственные средства, применяемые при пневмоцистозе:
•сульфаметоксазол/триметоприм, концентрат для приготовления раствора для инфузий (80мг+16мг)/мл, 5 мл, таблетка 480 мг.
Дополнительные иммуносупрессивные лекарственные средства:
•дексаметазон, раствор для инъекций 4 мг/мл 1 мл;
•метилпреднизолон, таблетка 16 мг, раствор для инъекций 250 мг;
•преднизолон, раствор для инъекций 30 мг/мл 1мл, таблетка 5 мг;
Растворы, применяемые для коррекции нарушений водного, электролитного
икислотно-основного баланса, парентерального питания:
•альбумин, раствор для инфузий 10 %, 100мл;
•альбумин, раствор для инфузий 20 % 100 мл;
•вода для инъекций, раствор для инъекций 5мл;
•декстроза, раствор для инфузий 5% - 250м, 5% - 500мл; 40% - 10 мл, 40% - 20 мл;
•калия хлорид, раствор для внутривенного введения 40мг/мл, 10мл;
•кальция глюконат, раствор для инъекций 10%, 5 мл;
•кальция хлорид, раствор для инъекций 10% 5мл;
•магния сульфат, раствор для инъекций 25% 5 мл;
•маннитол, раствор для инъекций 15%-200,0;
•натрия хлорид, раствор для инфузий 0,9% 500мл;
•натрия хлорид, раствор для инфузий 0,9% 250мл;
•натрия хлорид, калия хлорид, натрий уксуснокислый раствор для инфузий во флаконе 200мл, 400мл;
•натрия хлорид, калия хлорид, натрия ацетат раствор для инфузий 200мл, 400мл;
• натрия хлорид, калия хлорид, натрия гидрокарбонат раствор для инфузий
400мл;
•L-аланин, L-аргинин, глицин, L-гистидин, L-изолейцин, L-лейцин, L-лизина гидрохлорид, L-метионин, L-фенилаланин, L-пролин, L-серин, L-треонин, L- триптофан, L-тирозин, L-валин, натрия ацетат тригидрат, натрия глицерофосфата пентигидрат, калия хлорид, магния хлорид гексагидрат, глюкоза, кальция хлорид дигидрат, оливкового и бобов соевых масел смесь эмульсия д/инф.: контейнеры трехкамерные 2 л
•гидроксиэтилкрахмал (пентакрахмал), раствор для инфузий 6 % 500 мл;
•комплекс аминокислот, эмульсия для инфузий, содержащая смесь оливкового и соевого масел в соотношении 80:20, раствор аминокислот с электролитами, раствор декстрозы, с общей калорийностью 1800 ккал 1 500 мл трехсекционный контейнер;
•нутрикомп* 500 мл в контейнерах.
Лекарственные средства, применяемые для проведения интенсивной тепрапии (кардиотонические средства для лечения септического шока, миорелаксанты, вазопрессоры и средства для наркоза):
•аминофиллин, раствор для инъекций 2,4%, 5 мл;
•амиодарон, раствор для инъекций, 150 мг/3 мл;
•атенолол, таблетка 25мг;
•атракурий безилат, раствор для инъекций, 25мг/2,5мл;
•атропин, раствор для инъекций, 1 мг/ мл;
•диазепам, раствор для внутримышечного и внутривенного применения 5мг/мл
2мл;
•добутамин*, раствор для инъекций 250 мг/50,0 мл;
•допамин, раствор/конценрат для приготовления раствора для инъекций 4%, 5 мл;
•инсулин простой;
•кетамин, раствор для инъекций 500 мг/10 мл;
•морфин, раствор для инъекций 1% 1мл;
•норэпинефрин*, раствор для инъекций 20мг/мл 4,0;
•пипекурония бромид, порошок лиофилизированный для инъекций 4 мг;
•пропофол, эмульсия для внутривенного введения 10 мг/мл 20 мл, 10 мг/мл 50 мл;
•рокурония бромид, раствор для внутривенного введения 10мг/мл, 5 мл;
•тиопентал натрий, порошок для приготовления раствора для внутривенного введения 500мг;
•фенилэфрин, раствоp для инъекций 1% 1мл;
•фенобарбитал, таблетка 100мг;
•человеческий нормальный иммуноглобулин, раствор для инфузий;
•эпинефрин, раствор для инъекций 0,18 % 1 мл.
Лекарственные средства, влияющие на свертывающую систему крови:
•аминокапроновая кислота, раствор 5%-100 мл;
•антиингибиторный коагулянтный комплекс, лиофилизированный порошок для приготовления инъекционного раствора, 500 МЕ;
•гепарин, раствор для инъекций 5000 МЕ/мл, 5 мл, гель в тубе 100000ЕД 50г;
•губка гемостатическая, размер 7*5*1, 8*3;
•надропарин, раствор для инъекций в предварительно наполненных шприцах, 2850 МЕ анти-Ха/0,3 мл, 5700 МЕ анти-Ха/0,6 мл;
•эноксапарин, раствор для инъекций в шприцах 4000 анти-Ха МЕ/0,4 мл, 8000 анти-Ха МЕ/0,8 мл.
Другие лекарственные средства:
•бупивакаин, раствор для инъекций 5 мг/мл, 4 мл;
•лидокаин, раствор для инъекций, 2% по 2 мл;
•прокаин, раствор для инъекций 0,5% по 10 мл;
•иммуноглобулин человека нормальный [IgG+IgA+IgM] раствор для внутривенного введения 50 мг/мл50 мл;
•омепразол, капсула 20 мг, порошок лиофилизированный для приготовления раствора для инъекций 40 мг;
•фамотидин, порошок лиофилизированный для приготовления раствора для инъекций 20 мг;
•амброксол, раствор для инъекций, 15 мг/2 мл, раствор для приема внутрь и ингаляций, 15мг/2мл, 100мл;
•амлодипин, таблетка/капсула 5 мг;
•ацетилцистеин, порошок для приготовления раствора для приема внутрь, 3 г;
•дексаметазон, капли глазные 0,1% 8 мл;
•дифенгидрамин, раствор для инъекций 1% 1 мл;
•дротаверин, раствор для инъекций 2%, 2 мл;
•каптоприл, таблетка 50мг;
•кетопрофен, раствор для инъекций 100 мг/2мл;
•лактулоза, сироп 667 г/л по 500 мл;
•левомицетин, сульфадиметоксин, метилурацил, тримекаин мазь для наружного применения 40г;
•лизиноприл, таблетка 5мг;
•метилурацил, мазь для местного применения в тубе 10% 25г;
•нафазолин, капли в нос 0,1% 10мл;
•ницерголин, лиофилизат для приготовления раствора инъекций 4 мг;
•повидон– йод, раствор для наружного применения 1 л;
•сальбутамол, раствор для небулайзера 5мг/мл-20мл;
•смектитдиоктаэдрический, порошок для приготовления суспензии для приема внутрь 3,0 г;
•спиронолактон, капсула 100 мг;
•тобрамицин, капли глазные 0,3% 5мл;
•торасемид, таблетка 10мг;
•трамадол, раствор для инъекций 100 мг/2мл; капсулы 50 мг, 100 мг;
•фентанил, система терапевтическая трансдермальная 75 мкг/ч (для лечения хронических болей у онкологических больных);
•фолиевая кислота, таблетка, 5 мг;
•фуросемид, раствор для инъекций 1% 2 мл;
•хлорамфеникол, сульфадиметоксин, метилурацил, тримекаин мазь для
наружного применения 40г;
•хлоргексидин, раствор 0,05% 100мл
•хлоропирамин, раствор для инъекций 20 мг/мл 1мл.
14.3. Другие виды лечения:
14.3.1Другие виды лечения, оказываемые на амбулаторном уровне: не применяются.
14.3.2Другие виды, оказываемые на стационарном уровне:
Лучевая терапия.
Если вследствие осложнений или технических трудностей не представляется возможным провести полную программу профилактики нейролейкемии интратекальными введениями цитостатических препаратов, то больным рекомендуется выполнить краниальное облучение в дозе 24 Гр.
Трансплантация костного мозга.
Трансплантация стволовых гемопоэтических клеток от родственного донора показана всем больным в первой полной ремиссии острого лимфобластного лейкоза после завершения им программы индукции/консолидации, у кого есть HLA-идентичные сиблинги, за исключением группы стандартного риска (уровень доказательности В) [2-12].
Пациентам, у которых не удается получить полную ремиссию ни на одном этапе лечения, ТКМ при наличии донора может обсуждаться в качестве терапии «спасения».
Трансплантация костного мозга проводится согласно показаниям, указанным в протоколе лечения пациента. Если проведение трансплантации не предусмотрено протоколом, пациент не является кандидатом для ТКМ.
14.3.3 Другие виды лечения, оказываемые на этапе скорой медицинской помощи: не применяются.
14.4. Хирургическое вмешательство:
14.4.1Хирургическое вмешательство, оказываемое в амбулаторных условиях:
не проводится.
14.4.2Хирургическое вмешательство, оказываемое в стационарных условиях:
проводится по жизненным показаниям при развитии острой хирургической
патологии.
14.5.Профилактические мероприятия: нет.
14.6.Дальнейшее ведение: После завершения лечения согласно протоколу, пациенты в течение 2х лет получают поддерживающую терапию. При условии сохранения ремиссии заболевнаия, после окончания поддерживающей терапии, пациенты находятся на «Д» учёте и наблюдаются у гематолога по месту жительства в течение 5 лет.
15. Индикаторы эффективности лечения:
Критерии ремиссии: Периферическая кровь
•отсутствие бластемии;
•абсолютное количество нейтрофилов более 1,0 х109/л;
•тромбоциты более 100 х 109/л;
•отсутствие бластов и промиелоцитов в периферической крови.
Костный мозг
•менее 5% бластов при клеточном костном мозге;
Отсутствие экстрамедуллярных очагов. Нейролейкоз
•Отсутствие бластов в спинномозговой жидкости при цитологическом исследовании. Может наблюдаться цитоз более 5 кл/мкл, но данный признак не является обязательным [2].
Рефрактерность:
• Отсутствие ремиссии после завершения I фазы индукции Прогрессия:
•Увеличение не менее чем на 25% количества циркулирующих бластов или бластов в костном мозге или появление новых экстрамедуллярных очагов
Рецидив:
•Костно-мозговой рецидив – выявление при очередном исследовании в костном мозге более 5% бластов у пациента с ранее подтвержденной костномозговой ремиссией;
•Нейрорецидив – выявление бластов в спинномозговой жидкости вне зависимости от цитоза или объемного внутричерепного образования с гистологическим подтверждением. При отсутствии возможности проведения биопсии образования может быть выполнена ПЭТ/КТ.
•Тестикулярный рецидив – диагностируется на основании одноили двустороннего безболезненного опухания яичка, уплотненного при пальпации.
•Другие экстрамедуллярные рецидивы – поражение кожи, орбиты, средостения, лимфоузлов, миндалин и др. верифицируется гистологически и иммуногистохимически.
III.ОРГАНИЗАЦИОННЫЕ АСПЕКТЫ ВНЕДРЕНИЯ ПРОТОКОЛА:
16. Список разработчиков протокола с указанием квалификационных данных:
1)Кемайкин Вадим Матвеевич – кандидат медицинских наук, АО «Национальный научный центр онкологии и трансплантологии», заведующий отделением онкогематологии и трансплантации костного мозга.
2)Клодзинский Антон Анатольевич – кандидат медицинских наук, АО «Национальный научный центр онкологии и трансплантологии», врач гематолог отделения онкогематологии и трансплантации костного мозга.
3)Рамазанова Райгуль Мухамбетовна – доктор медицинских наук, профессор АО «Казахский медицинский университет непрерывного образования», заведующая курсом гематологии.
4)Габбасова Сауле Телембаевна – РГП на ПХВ «Казахский научноисследовательский институт онкологии и радиологии» заведующая отделением гемобластозов.
5)Каракулов Роман Каракулович – доктор медицинских наук, профессор, Академик МАИ РГП на ПХВ «Казахский научно-исследовательский институт онкологии и радиологии» главный научный сотрудник отделения гемобластозов.
6)Рапильбекова Гульмира Курбановна – доктор медицинских наук, профессор АО «Национальный научный центр материнства и детства», старший ординатор акушерского отделения №1, врач акушер-гинеколог.
7)Табаров Адлет Берикболович – Начальник отдела инновационного менеджмента РГП на ПХВ "Больница медицинского центра Управление делами Президента Республики Казахстан" клинический фармаколог, врач педиатр.
17. Указание на отсутствие конфликта интересов: отсутствует.
18. Рецензенты:
1)Афанасьев Борис Владимирович - Доктор медицинских наук, директор Научно-Исследовательского Института Детской онкологии, гематологии и трансплантологии имени Р.М. Горбачевой, Заведующий кафедрой гематологии, трансфузиологии и трансплантологии Государственного бюджетного общеобразовательного учреждения высшего профессионального образования Первого Санкт-Петербургского Государственного Медицинского Университета им. И.П. Павлова.
2)Рахимбекова Гульнара Айбековна – доктор медицинских наук, профессор, АО «Национальный научный медицинский центр», руководитель отдела.
3)Пивоварова Ирина Алексеевна – Medicinae Doctor, Master of Business Administration, Главный внештатный гематолог Министерства здравоохранения и социального развития Республики Казахстан.
19.Указание условий пересмотра протокола: пересмотр протокола через 3 года и/или при появлении новых методов диагностики и/или лечения с более высоким уровнем доказательности.
20.Список использованной литературы:
1.Scottish Intercollegiate Guidelines Network (SIGN). SIGN 50: a guideline developer’s handbook. Edinburgh: SIGN; 2014. (SIGN publication no. 50). [October 2014]. Available from URL: http://www.sign.ac.uk.
2.NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines) Acute lymphoblastic leukemia. www.nccn.org.
3.Гематология; Новейший справочник. Под общей редакцией доктора медицинских наук. Профессора К.М. Абдулкадырова. Москва: Издательство Эксмо; Санкт-Петербург: Издательство Сова, 2004; 414-422.
4.Паровичникова Е. Н., Давидян Ю. Р., Исаев В. Г., Соколов А. Н., Клясова Г.А., Менделеева Л. П. Итоги лечения острых лимфобластных лейкозов взрослых по протоколу ОЛЛ-2005 как основа для новых исследований. Терапевтический архив №7 2009.
5.Yanada M., Matsuo K., Suzuki T., Naoe T. Allogeneic hematopoietic stem cell transplantation as part of postremission therapy improves survival for adult patients with high-risk acute lymphoblastic leukemia: A metaanalysis. Cancer 2006; 106: 1657-1663.
6.Pui C.H., Evans W.E.Treatment of acute lymphoblastic leukemia. N Engl J Med. 2006; 354:166-178.
7.Ribera J.M., Oriol A., Bethencourt C. et al. Comparison of intensive chemotherapy, allogeneic or autologous stem cell transplantation as post-remission treatment for adult patients with high-risk acute lymphoblastic leukemia. Results of the PETHEMA ALL-93 trial. Haematologica. 2005; 90:1346-1356.
8.Pui C.H., Evans W.E.Treatment of acute lymphoblastic leukemia. N Engl J Med. 2006; 354:166-178.
9.Annino L., Vegna M.L., Camera A. et al. Treatment of adult acute lymphoblastic leukemia (ALL): long-term follow-up of the GIMEMA ALL 0288 randomized study. Blood. 2002; 99:863-871.
10.Hoelzer D., Gökbuget N., Ottmann O., Pui C.H. et al. Acute lymphoblastic leukemia Hematology Am SocHematolEduc Program. 2002:162-92.
11.Goldstone A.H., Richards S.M., Lazarus H.M. et al: In adults with standard-risk acute lymphoblastic leukemia, the greatest benefit is achieved from a matched sibling allogeneic transplantation in first complete remission, and an autologous transplantation is less effective than conventional consolidation/ maintenance chemotherapy in all patients: Final results of the International ALL trial (MRC UKALL XII/ECOG E2993). Blood 111:1827-1833, 2008
12.Gokbuget N., Hoelzer D., Arnold R. et al. Treatment of adult ALL according to the protocols of the German Multicenter Study Group for Adult ALL (GMALL). Hemat/OncolClin North Am. 2000 14:1307–1325.
13.Kantarjian H.M., O'Brien S., Smith T.L., Cortes J. et al. Results of treatment with hyper-CVAD, a dose-intensive regimen, in adult acute lymphocytic leukemia J ClinOncol. 2000 Feb; 18(3):547-61.
14.Thomas D.A. Philadelphia chromosome positive acute lymphocytic leukemia: a new era of challenges Hematology Am SocHematolEduc Program. 2007:435-43.
15.Chalandon Y., Thomas X., Hayette S. et al. First results of the GRAAPH-2005 study in younger adult patients with de novo Philadelphia positive acute lymphoblastic leukemia. Blood. 2008;112(11):Abstract 12.
16.R. Hehlmann and S. Saussele. Treatment of chronic myeloid leukemia in blast crisis. Haematologica, 2008; 93(12); 1765 – 1769.
17.Rüdiger Hehlmann. How I treat CML blast crisis. July 26, 2012; Blood: 120 (4).
18.Moody K, Finlay J, Mancuso C, Charlson M. Feasibility and safety of a pilot randomized trial of infection rate: neutropenic diet versus standard food safety guidelines. J Pediatr Hematol Oncol. 2006 Mar; 28(3):126-33.
19.Gardner A, Mattiuzzi G, Faderl S, Borthakur G, Garcia-Manero G, Pierce S, Brandt M, Estey E. Randomized comparison of cooked and noncooked diets in patients undergoing remission induction therapy for acute myeloid leukemia. J Clin Oncol. 2008 Dec 10; 26(35):5684-8.
20.Carr SE, Halliday V. Investigating the use of the neutropenic diet: a survey of UK dietitians. J Hum Nutr Diet. 2014 Aug 28.
21.Boeckh M. Neutropenic diet-good practice or myth? Biol Blood Marrow Transplant. 2012 Sep; 18(9):1318-9.
22.Trifilio, S., Helenowski, I., Giel, M. et al. Questioning the role of a neutropenic diet following hematopoetic stem cell transplantation. Biol Blood Marrow Transplant. 2012; 18: 1387–1392.
23.DeMille, D., Deming, P., Lupinacci, P., and Jacobs, L.A. The effect of the neutropenic diet in the outpatient setting: a pilot study. Oncol Nurs Forum. 2006; 33: 337–343.
24.Yahya Buyukasik, Kadir Acar, Engin Kelkitli, Burak Uz Songul Serefhanoglu Hyper-CVAD Regimen in Routine Management of Adult Acute Lymphoblastic Leukemia: Retrospective Multicenter Study. Acta Haematologica 2013; 130:199–205.
25.Kantarjian H.M., Thomas D., O’Brien S. et al. Long-termfollow-up results of hyperfractionated cyclophosphamide,vincristine, doxorubicin, and dexamethasone
(hyper-CVAD), a dose-intensive regimen, in adult acute lymphocyticleukemia. Cancer. 2004;101:2788-2801.
26.Abla O, Ye CC. Acute lymphoblastic leukemia with massive myelofibrosis. J Pediatr Hematol Oncol 2006; 28:633-4.
27.Gokbuget N., Baur K-H., Beck J. et al. Dexamethasone dose and schedule significantly influences remission rate and toxicity of induction therapy in adult acute lymphoblastic leukemia (ALL): Results of the GMALL pilot trial 06/99 [abstract]. Blood. 2005 106:1832.
28.Gökbuget N., Hoelzer D. Treatment of Adult Acute Lymphoblastic Leukemia. Seminars inHematology. 2009;46(1):64-75.
29.Bassan R., Hoelzer D. Modern therapy of acute lymphoblastic leukemia. J Clin Oncol. 2011;29(5):532-543.
30.GökbugetN., KnebaM., RaffTh., TrautmannH., BartramC-R., Arnold R.et al. Adults with acute lymphoblastic leukemia and molecular failure display a poor prognosis and are candidates for stem cell transplantation and targeted therapies Blood. 2012 Aug 30;120(9):1868-1876.
31.Folber F., Sálek C., Doubek M., Soukupová Maaloufová J, Valová T, Trka J. et al. Treatment of adult acute lymphoblastic leukemia according to GMALL 07/2003 study protocol in the Czech Republic - the first experience Vnitr Lek. 2010 Mar; 56 (3):176-82. (abstr).
32.Hoelzer D., Thiel E., Loffler H. et al. Prognostic factors in a multicenter study for treatment of acute lymphoblastic leukemia in adults. Blood. 1988 71:123–131
33.Ludwig W.D., Rieder H., Bartram C.R., Heinze B., Schwartz S., Gassmann W., Löffler H. et al. Immunophenotypic and genotypic features, clinical characteristics, and treatment outcome of adult pro-B acute lymphoblastic leukemia: results of the German multicenter trials GMALL 03/87 and 04/89 Blood. 1998 Sep 15; 92 (6):1898-909.
34.Gokbuget N., Hoelzer D., Arnold R. et al. Treatment of adult ALL according to the protocols of the German Multicenter Study Group for Adult ALL (GMALL). Hemat/Oncol Clin North Am. 2000 14:1307–1325.
35.Hoelzer D., Gökbuget N., Digel W., Faak T., Kneba M. et al. Outcome of adult patients with T-lymphoblastic lymphoma treated according to protocols for acute lymphoblastic leukemia Blood. 2002 Jun; 15; 99 (12):4379-85.
36.Gokbuget N., Baur K-H., Beck J. et al. Dexamethasone dose and schedule significantly influences remission rate and toxicity of induction therapy in adult acute lymphoblastic leukemia (ALL): Results of the GMALL pilot trial 06/99 [abstract]. Blood. 2005 106:1832.
37. Topp MS, Kufer P, Gökbuget N, Goebeler M, Klinger M, Neumann S, Horst HA, Raff T, Viardot A, Schmid M, Stelljes M, Schaich M, Degenhard E, Köhne-Volland
R, Brüggemann |
M, Ottmann |
O, Pfeifer |
H, Burmeister |
T, Nagorsen D, Schmidt |
|
M, Lutterbuese |
R, Reinhardt |
C, Baeuerle |
PA, Kneba |
M, Einsele |
H,Riethmüller |
G, Hoelzer D, Zugmaier G, Bargou RC. Targeted therapy with the |
T-cell-engaging |
||||
antibody blinatumomab of chemotherapy-refractory minimal residual disease in B- lineage acute lymphoblastic leukemia patients results in high response rate and prolonged leukemia-free survival. J Clin Oncol. 2011 Jun 20; 29(18):2493-8. http://www.ncbi.nlm.nih.gov/pubmed/21576633
38.Aviles A, Neri N. Hematological malignancies and pregnancy: a final report of 84 children who received chemotherapy in utero. Clin Lymphoma 2001; 2:173-3.
39.Nulman I, Laslo D, Fried S, Uleryk E, Lisher M, Koren G. Neurodevelopment of children exposed in utero to treatment of maternal malignancy. Br J Cancer 2001; 85:1611-8.
