
1.2. Les fonctions des proteines
La fonction catalytique. La plupart des enzymes connus à present, nommés les catalyseurs biologiques, sont les protéines. À présent on a caractérisé quelques milles enzymes.
La fonction de transport. La fonction respiratoire du sang, en particulier le transfert de l'oxygène, se réalise par les molécules de l'hémoglobine-albumine des erythrocytes. Les albumines du sérum du sang participent au transport des lipides.
La fonction protectrice. En réponse à l'entrée à l'organisme des bactéries, des toxines, des virus ou des albumines xénogéniques, des albumines-anticorps protecteurs sont synthétisés (la protection réfractaire, immune). Une série des protéines du plasma du sang sont capables à la coagulation, ce qui protège des pertes sanguines aux blessures (la protection physique).
La fonction hormonale. Une série d'hormones est présentée par les protéines ou les polypeptides, par exemple, l'hormone du pancréas l'insuline.
La fonction structurale. En complexe avec les lipides, les protéines participent à la formation des biomembranes des cellules. Les albumines structurales du cytosquelette donnent la forme aux cellules et plusieurs organites. Les albumines structurales - le collagène dans le tissu conjonctif, la kératine dans les cheveux, les ongles, la peau, l'élastine dans la paroi vasculaire etc.
La fonction nutritive (de réserve). Les protéines de l'oeuf (les ovalbumines) sont les sources d'alimentation pour le fétus. L'albumine principale du lait (la caséine) accomplit aussi la fonction nutritive.
La fonction réceptive. Les récepteurs albuminés sont insérés dans la membrane cellulaire ou ils se trouvent dans le cytoplasme. Le récepteur perçoit le signal, dont la substance chimique sert le plus souvent.
La fonction contractile (motrice). La fonction contractile est propre aux albumines musculaires (l`actine et la myosine), aux albumines du cytosquelette, ce qui assure la disjonction des chromosomes au prosessus de la mitose.
D'autres fonctions importantes des protéines - la capacité de soutenir la pression oncotique dans les cellules et le sang, les propriétés tampon soutenant l`importance physiologique de рН du milieu intérieur, etc.
1.3. La composition acido-aminée des proteines
Pour la constatation de la composition acido-aminée des protéines, on se sert de la combinaison de l`hydrolyse acide (НС1), alcalin (Ва (OH) 2) et, moins souvent, enzymatique ou l`un d'eux. Fait établi, qu'à l'hydrolyse de la protéine pure ne contenant pas d`additions, environs 20 divers aminoacides se libèrent.
Les aminoacides faisant partie des protéines, sont les -aminoacides. Ils appartiennent tous à une L-série, et la valeur et le signe de la rotation optique dépendent de la nature des radicaux des aminoacides et la signification рН de la solution. Aux protéines de l`homme les D-aminoacides ne sont pas découverts, cependant ils se rencontrent dans la paroi cellulaire des bactéries, au nombre de certains antibiotiques (les actinomycines).
Les aminoacides se distinguent l'un de l'autre par la nature chimique du radical R, qui ne participe pas à la formation de la liaison peptidique. La classification moderne rationnelle des aminoacides est fondée sur la polarité des radicaux.
On distingue les aminocides: 1) non polaires (hydrophobes); 2) polaires (hydrophiles); 3) aromatiques (particulièrement non polaires), 4) chargés négativement et 5) chargés positivement.
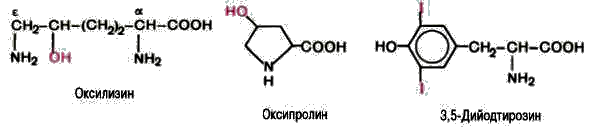
Dans certaines albumines on découvre les dérivées des aminoacides. Dans l'albumine du tissu conjonctif, le collagène, se trouvent l`oxyproline et l`oxylysine. La diiodotyrosine (DIT) est la base de la structure des hormones de la glande thyroïde.

Les aminoacides possèdent la propriété générale – l`amphotérisme (du grec. amphoteros - bilatéral). Dans l'intervalle de рН de 4,0 jusqu'à 9,0 presque tous les aminoacides existent principalement en état zwitterionique (les ions bipolaires). On peut calculer la signification du point iso-électrique de l'aminoacide selon la formule:
![]()
Pour les monoaminoacidesdicarboxyliques on calcule рI comme la demi-somme des significations рК - et - fonctions carboxyles, pour les diaminoacidesdicarboxyliques – comme la demi-somme des significations рК - et - les aminogènes.
Il existent les aminoacides remplaçables, qui peuvent être synthétisés dans l'organisme de l`homme, et irremplaçables, qui ne se forment pas dans l'organisme et doivent y entrer avec la nourriture.
Les aminoacides irremplaçables : la valine, la leucine, l'isoleucine, la lysine, la méthionine, la thréonine (l`acide α-amino-β-hydroxybutyrique), la tryptophane, la phénylalanine.
Les aminoacides remplaçables: la glycine, l'alanine, l'asparagine, l`aspartate, la glutamine, le glutamate, la proline, la sérine.
Les aminoacides remplaçables sous condition (peuvent être synthétisés dans l'organisme d'autres aminoacides) : l`arginine (de citrulline), la thyrosine (de phénylalanine), la cystéine (de sérine), l'histidine (à la participation de glutamine).
La teneur en divers aminoacides dans les albumines est inégale.
Pour la découverte dans les objets biologiques et la détermination quantitative des aminoacides on utilise la réaction avec la ninhydrine.
