
- •Органическая химия
- •I. Методические рекомендации по изучению теоретических основ органической химии
- •Раздел 1. Теоретические основы органической химии
- •1.1. Введение. Теория химического строения имени а.М. Бутлерова
- •1.2. Классификация органических соединений. Номенклатура органических соединений
- •Название соединения:
- •4. Составить название соединения:
- •Префиксы и суффиксы характеристических групп (функциональные группы, заместители, радикалы)
- •Название некоторых радикалов
- •1. Укажите, какое число соединений обозначено приведенными ниже структурными формулами:
- •2. Укажите основные классификационные признаки органических соединений.
- •3. Среди представленных соединений укажите моно-, поли - и гетерофункциональные соединения ациклического и циклического строения:
- •4. Назовите соединения по заместительной номенклатуре июпак:
- •5. Напишите структурные формулы соединений:
- •1. Дать названия по заместительной номенклатуре июпак следующим соединениям.
- •2. Написать структурную формулу 2 –амино – 4 – этоксипентандиовой кислоты.
- •1.3. Химическая связь. Типы межмолекулярных взаимодействий. Взаимное влияние атомов в молекуле
- •1. В каких из указанных ниже соединений следует ожидать образования водородных связей:
- •3. Рассмотрите взаимное влияние атомов в молекулах пропиламина, виниламина и анилина.
- •4. Рассмотрите распределение электронной плотности в молекулах пропеналя и хлорэтена.
- •1. 4. Изомерия органических соединений
- •1. Напишите структурные формулы структурных изомеров состава с4н8о. Укажите, к каким классам относятся изомеры. Назовите соединения по заместительной номенклатуре.
- •4. Определите число оптических изомеров хлоряблочной кислоты (2-гидрокси-3-хлорбутандиовая кислота). Назовите и представьте их в виде проекций Фишера.
- •5. Определите число оптических изомеров винной кислоты (2,3-дигидроксибутандиовая кислота). Назовите и представьте их в виде проекций Фишера.
- •Раздел 2. Углеводороды
- •2.1. Алканы (Предельные углеводороды)
- •1. Напишите структурные формулы изомерных углеводородов состава с6н14. Назовите их по номенклатуре июпак.
- •2. Какие углеводороды можно получить по реакции Вюрца, используя смесь галогеналканов (алкилгалогенидов) – хлорэтана и хлорметана?
- •3. Какой углеводород получится при сплавлении ацетата натрия со щелочью?
- •4. Какие продукты образуются при галогенировании и нитровании по Коновалову (14-20% раствор нnо3, 1400с) пропана?
- •2.2. Алкены (Этиленовые углеводороды)
- •2. Напишите схему реакции присоединения воды к 2- метилбутену-2. Назовите полученное соединение.
- •3. Напишите схемы реакций окисления 2-метилпентена-2 перманганатом калия в слабощелочной и кислой средах.
- •4. Какой алкен получится в качестве основного продукта в реакции дегидратации бутанола-2?
- •2.3. Алкины (Ацетиленовые углеводороды)
- •1. Напишите структурные формулы изомеров состава с5н8. Назовите изомеры по номенклатурам – рациональной и июпак.
- •2. Закончите уравнения реакций (в соответствующих условиях) бутина-1 со следующими реагентами:
- •3. Осуществите следующие превращения:
- •4. Осуществите превращение: бутин-1 → бутин-2
- •2.4. Арены (Ароматические углеводороды)
- •1. Напишите структурные формулы изомерных алкилбензолов состава с9н 12. Назовите их.
- •3. Определите характер группы - осн3 (заместитель 1 или 2 рода, о-, п - или м-ориентант) в молекуле метоксибензола.
- •5. Предложите наиболее рациональный способ получения из бензола 2-хлор-4-нитротолуол.
- •6. Осуществите превращения:
- •Раздел 3. Кислородсодержащие соединения
- •3.1. Спирты. Фенолы.
- •1. Напишите структурные формулы изомеров состава с4н10о. Назовите соединения по рациональной номенклатуре и июпак. Среди них укажите первичные, вторичные и третичные спирты, простые эфиры.
- •2. С помощью каких реакций и реагентов можно из бутанола-2 получить следующие соединения:
- •3. Как с помощью химических реакций отличить друг от друга глицерин, фенол, бензиловый спирт?
- •4. Какие соединения могут быть получены при окислении раствором kMnO4 пропилового спирта, изопропилового спирта, фенола?
- •5. Какой спирт можно получить в результате следующих превращений:
- •6. Осуществить превращения:
- •3.2. Альдегиды и кетоны (карбонильные соединения)
- •1. Напишите структурные формулы изомеров карбонильных соединений с общей формулой c5h10o и назовите их по рациональной номенклатуре, номенклатуре июпак.
- •2. Напишите уравнения реакций окисления хромовой смесью бутаналя и 2-метилпентанона-3.
- •3. Напишите схемы реакций ацетона и уксусного альдегида с синильной кислотой, гидроксиламином. Сравните реакционную активность карбонильных соединений в этих реакциях.
- •4. Получите возможными способами ацетон.
- •3.3. Карбоновые кислоты и их производные
- •1. Сравните кислотные свойства кислот: бутановой (масляной), пропановой (пропионовой),
- •2. Сравните кислотные свойства бензойной, п-нитробензойной и п-оксибензойной кислот.
- •3. Получите пропионовую кислоту (пропановую) всеми возможными способами.
- •4. Напишите уравнение реакции взаимодействия уксусной кислоты с этиловым спиртом. Назовите полученное соединение. Напишите уравнения гидролиза сложного эфира в кислой и щелочной средах.
- •5. Напишите уравнение реакции, протекающей при нагревании β-гидроксимасляной кислоты.
- •6. Напишите уравнения реакции олеииодистеарина с водородом, бромом, перманганатом калия, полного щелочного гидролиза стеарина. Назовите продукты реакций.
- •7. Напишите уравнения реакций, протекающих при последовательном действии на пропановую кислоту следующих реагентов: 1. Хлора (в присутствии следов фосфора); 2. Гидроксида калия в спиртовой среде;
- •3. Бромоводорода; 4. Водного раствора гидроксида калия; 5. Избытка хлорида фосфора (III). Назовите промежуточные и конечные продукты реакций.
- •Раздел 4. Углеводы
- •2. Напишите, используя перспективные формулы Хеуорса, пиранозные и фуранознгые и- формы рибозы. Назовите эти формы, укажите гликозидный (полуацетальный) гидроксил.
- •3. Напишите уравнения реакций окисления (реакция «серебряного зеркала») d-рибозы и её взаимодействия с метиловым спиртом. Назовите продукты реакций.
- •1. Напишите уравнения образования восстанавливающего и невосстанавливающего дисахарида из двух молекул ,d–рибофуранозы. Назовите полученные соединения.
- •Раздел 5. Азотсодержащие соединения
- •5.1. Амины. Аминокислоты
- •1. Напишите структурные формулы следующих аминов:
- •2. Сравните основные свойства следующих аминов: этиламин, аммиак, диэтиламин, анилин, п-нитроанилин. Напишите уравнения реакций диэтиламина и анилина с соляной кислотой.
- •4. Сравните действие азотистой кислоты на метиламин, п-толуидин, n-метиланилин.
- •5. Из нитробензола получите м-, о- и п- нитроанилины.
- •6. Представьте формулы биполярных ионов аланина (2-аминопропановая кислота), аспарагиновой кислоты (аминобутандиовая кислота), орнитина (2,5-диаминопентановая кислота).
- •7. Напишите уравнение образования трипептида из аланина.
- •II. Методические рекомендации по выполнению лабораторных работ
- •1. Фильтрование
- •2. Кристаллизация (перекристаллизация)
- •3. Перегонка
- •4. Экстракция
- •5. Возгонка
- •1.3. Лабораторная работа №2. Качественный элементный анализ органических соединений
- •1. Обнаружениеуглерода пробой на обугливание
- •2. Обнаружение углерода и водорода
- •4. Обнаружение галогенов
- •5. Обнаружение серы
- •1. 1. Отношение алканов к брому
- •1. 2. Отношение алканов к окислителям
- •1. 3. Горение алканов
- •2. Алкены, диены, алкины (Непредельные углеводороды)
- •2.1. Отношение непредельных углеводородов к брому
- •2.2. Отношение непредельных углеводородов к окислителям
- •2.3. Особые свойства алкинов (получение ацетиленида меди)
- •3 Арены (Ароматические углеводороды)
- •3. 1. Отношение бензола к брому (тяга!)
- •3. 2. Отношение бензола и его гомологов к окислителям
- •5. Горение ароматических углеводородов (тяга!)
- •1. Спирты
- •2. Альдегиды и кетоны (Карбонильные соединения)
- •2. 1. Отношение альдегидов и кетонов к нуклеофильным реагентам
- •2. 2. Отношение карбонильных соединений к слабым окислителям
- •3. Карбоновые кислоты и их производные
- •3. 1. Растворимость предельных монокарбоновых кислот кислот в воде и органических растворителях
- •3. 2. Кислотные свойства предельных карбоновых кислот
- •3.3. Сравнение кислотных свойств карбоновых и минеральных кислот
- •3. 4. Производные карбоновых кислот
- •1. Реакция на гидроксильные группы в углеводах
- •2. Реакции на карбонильную группу в углеводах
- •3. Взаимодействие крахмала с иодом
- •III. Задания для самостоятельного решения
- •1) Назовите соединения по заместительной номенклатуре июпак (а-п):
- •2. Напишите структурные формулы следующих соединений (а-п):
- •2. Обозначьте графически электронные эффекты в нижепредставленных соединениях. На примере одного соединения рассмотрите виды сопряжения и напишите его мезоформулу (а-п):
4. Рассмотрите распределение электронной плотности в молекулах пропеналя и хлорэтена.
Решение:
Молекула пропеналя содержит чередующиеся σ- и π – связи, то есть в молекуле имеет место сопряженная система. Взаимное влияние, передающееся по цепи сопряженных π – связей, называется мезомерным электронным эффектом (π, π – сопряжение), действие его приводит к перераспределению (выравниванию) электронной плотности в сопряженной системе (число атомов: 3С+О и число электронов: 2π + 2π):
![]()
![]()
СН2δ+
= СН – СН
= Оδ-
↔ δ+![]() δ-.
δ-.
структурная формула мезоформула
π,π - сопряжение в молекуле пропеналя можно показать и таким образом:
![]() ↔ δ+
↔ δ+![]() δ-.
δ-.
Группа – СН=О электронную плотность на углеводородном радикале понижает, поэтому это электроноакцепторный заместитель, а мезомерный электронный эффект – отрицательный (-М). В результате перераспределения электронной плотности в молекуле расстояния между атомами углерода и кислорода становятся близкими. Вращение атомов углерода относительно друг друга по связи 1С-2С становится невозможным.
В молекуле хлорэтена взаимное влияние передается по сопряженной системе, образованной 2π- электронами связи С-С и 2р-электронами атома хлора (р, π- сопряжение). Перераспределение электронной плотности (четырех электронов - 2π+2р) происходит между тремя атомами (2С+CI):
![]()
![]() ..
δ- δ+
..
δ- δ+
δ-СН2
= СН → CIδ+
↔
![]() ↔
↔
 .
.
Атом хлора увеличивает электронную плотность на углеводородном радикале (-I несколько меньше +М), поэтому это электронодонорный заместитель.
Действие мезомерных электронных эффектов приводит к уменьшению энергии молекул (к увеличению стабильности), к изменению реакционной активности, направления и величины дипольного момента молекул. Например, подвижность атома хлора в молекуле хлорэтена значительно меньше по сравнению с подвижностью атома хлора в молекуле хлорэтана СН3-СНδ+2→CIδ-, такой атом хлора с трудом замещается (или вовсе не замещается) другим заместителем.
1. 4. Изомерия органических соединений
Литература
1. Иванов, В.Г. Органическая химия: учеб. пособие для вузов / В.Г. Иванов, В.А. Горленко. – М.: Издательский центр «Академия», 2009. -С. 4-6, 76-90.
2. Грандберг, И.И. Органическая химия: учеб. для вузов / И.И. Грандберг. - М.: Дрофа, 2002. -С. 14, 147-148, 165-166, 178-179, 430-451.
3. Артеменко, А.И. Органическая химия: учеб. для вузов / А.И. Артеменко. - М.: Высшая школа, 2009. -С. 35-40.
Вопросы этой части программы достаточно подробно рассмотрены в рекомендуемых учебниках, поэтому при изучении данной темы можно пользоваться любым учебником. Однако в учебнике [1] материал представлен более компактно, в других учебниках вопросы по изомерии рассмотрены в отдельных разделах, посвященных изучению классов соединений.
Изомерия - явление существования веществ с одинаковым качественным и количественным составом, но с различными строением (химическим, пространственным) и свойствами.
Структурные изомеры отличаются химическим строением. Различают следующие виды структурной изомерии: изомерия углеродного скелета, изомерия положения функциональных групп, межклассовая изомерия (в том числе метамерия), таутомерия. Структурные изомеры следует изображать в виде структурных формул и называть по номенклатуре ИЮПАК.
Пространственные виды изомерии: конформационная и конфигурационная (оптическая и геометрическая). Изображают пространственные изомеры с помощью стереохимических формул и различных проекций.
К конфигурационной изомерии относят геометрическую и оптическую изомерии.
Геометрические изомеры возникают в результате отсутствия в молекуле:
1. вращения атомов углерода относительно друг друга - следствие жесткости двойной связи С=С или циклической структуры;
2. двух одинаковых групп при одном атоме углерода.
Различают цис-транс-(Z,E) изомеры. Различие в пространственном строении создает разницу в физических, химических свойствах соединений. Геометрические изомеры, в отличие от конформеров, могут быть выделены в чистом виде и существуют как индивидуальные, устойчивые вещества. Для их взаимного превращения необходима более высокая энергия - порядка 125-170 кДж/моль (30-40 ккал/моль).
Студенту следует подробно рассмотреть номенклатуру и способы изображения геометрических изомеров.
Среди органических соединений встречаются вещества, способные вращать плоскость поляризации света. Это явление называют оптической активностью, а соответствующие вещества - оптически активными. Оптически активная молекула хиральна, в такой молекуле присутствует асимметрический атом углерода (существуют и другие причины хиральности молекулы). Так называют атом углерода в sp3-гибридизации, связанный с четырьмя различными заместителями. Возможны два расположения заместителей вокруг асимметрического атома углерода. Обе пространственные формы нельзя совместить никаким вращением; одна из них является зеркальным изображением другой:
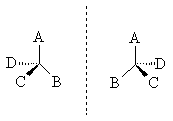
Такие оптически активные вещества называются оптическими антиподами (энантиомерами) - изомерами, у которых удельное вращение одинаково по абсолютной величине и противоположно по знаку: один вращает плоскость поляризации влево (-) - левовращающий, другой – вправо (+) - правовращающий. При этом физические и химические свойства энантиомеров в обычных условиях одинаковы.
Смесь с одинаковым содержанием энантиомеров называется рацематом. Рацемат не обладает оптической активностью, характеризуется отличными от энантиомеров физическими свойствами.
Другой вид оптических изомеров - диастереомеры, т.е. пространственные изомеры, не составляющие друг с другом оптических антиподов.
Диастереомеры отличаются друг от друга не только оптическим вращением, но и всеми другими физическими константами: температурами плавления и кипения, растворимостью и т.д. Различия в свойствах диастереомеров иногда ничуть не меньше, чем различия в свойствах структурных изомеров.
Контрольные вопросы и упражнения:
1. Структурная изомерия, основные виды. Для каждого вида структурной изомерии приведите по 2-3 примера структурных изомеров состава С5Н10О, назовите их по заместительной номенклатуре ИЮПАК. Укажите, к каким классам соединений относятся данные изомеры.
2. Геометрическая изомерия (цис, транс, Z-, Е). Какие из указанных соединений образуют геометрические изомеры: 1,1-дихлорциклопропан; 2-хлорбутен-2; 1,2 – диэтилциклогексан; 2,3-диметилбутен-2; 3-бромпентен-2? Представьте геометрические изомеры в виде проекций. Назовите изомеры, сравните их некоторые свойства (температура кипения, плавления, плотность, полярность и стабильность молекул).
3. Оптическая изомерия. Понятие о хиральности. Соединения с одним и двумя асимметрическими атомами углерода: энантиомеры, диастереомеры, мезоформы. Способы изображения оптических изомеров. Номенклатура оптических изомеров. Укажите соединения, молекулы которых хиральны: 2-пропанол; пентанол-2; бутандиол-2,3; пентандиол-2,3. В молекулах укажите число асимметрических атомов углерода. Изобразите с помощью проекционных формул Фишера оптические изомеры. Укажите энантиомеры, диастереомеры, мезоформы. Определите конфигурации асимметрических центров оптических изомеров (R, S- конфигурации).
П р и м е р ы р е ш е н и я т и п о в ы х з а д а ч
