
- •Органическая химия
- •I. Методические рекомендации по изучению теоретических основ органической химии
- •Раздел 1. Теоретические основы органической химии
- •1.1. Введение. Теория химического строения имени а.М. Бутлерова
- •1.2. Классификация органических соединений. Номенклатура органических соединений
- •Название соединения:
- •4. Составить название соединения:
- •Префиксы и суффиксы характеристических групп (функциональные группы, заместители, радикалы)
- •Название некоторых радикалов
- •1. Укажите, какое число соединений обозначено приведенными ниже структурными формулами:
- •2. Укажите основные классификационные признаки органических соединений.
- •3. Среди представленных соединений укажите моно-, поли - и гетерофункциональные соединения ациклического и циклического строения:
- •4. Назовите соединения по заместительной номенклатуре июпак:
- •5. Напишите структурные формулы соединений:
- •1. Дать названия по заместительной номенклатуре июпак следующим соединениям.
- •2. Написать структурную формулу 2 –амино – 4 – этоксипентандиовой кислоты.
- •1.3. Химическая связь. Типы межмолекулярных взаимодействий. Взаимное влияние атомов в молекуле
- •1. В каких из указанных ниже соединений следует ожидать образования водородных связей:
- •3. Рассмотрите взаимное влияние атомов в молекулах пропиламина, виниламина и анилина.
- •4. Рассмотрите распределение электронной плотности в молекулах пропеналя и хлорэтена.
- •1. 4. Изомерия органических соединений
- •1. Напишите структурные формулы структурных изомеров состава с4н8о. Укажите, к каким классам относятся изомеры. Назовите соединения по заместительной номенклатуре.
- •4. Определите число оптических изомеров хлоряблочной кислоты (2-гидрокси-3-хлорбутандиовая кислота). Назовите и представьте их в виде проекций Фишера.
- •5. Определите число оптических изомеров винной кислоты (2,3-дигидроксибутандиовая кислота). Назовите и представьте их в виде проекций Фишера.
- •Раздел 2. Углеводороды
- •2.1. Алканы (Предельные углеводороды)
- •1. Напишите структурные формулы изомерных углеводородов состава с6н14. Назовите их по номенклатуре июпак.
- •2. Какие углеводороды можно получить по реакции Вюрца, используя смесь галогеналканов (алкилгалогенидов) – хлорэтана и хлорметана?
- •3. Какой углеводород получится при сплавлении ацетата натрия со щелочью?
- •4. Какие продукты образуются при галогенировании и нитровании по Коновалову (14-20% раствор нnо3, 1400с) пропана?
- •2.2. Алкены (Этиленовые углеводороды)
- •2. Напишите схему реакции присоединения воды к 2- метилбутену-2. Назовите полученное соединение.
- •3. Напишите схемы реакций окисления 2-метилпентена-2 перманганатом калия в слабощелочной и кислой средах.
- •4. Какой алкен получится в качестве основного продукта в реакции дегидратации бутанола-2?
- •2.3. Алкины (Ацетиленовые углеводороды)
- •1. Напишите структурные формулы изомеров состава с5н8. Назовите изомеры по номенклатурам – рациональной и июпак.
- •2. Закончите уравнения реакций (в соответствующих условиях) бутина-1 со следующими реагентами:
- •3. Осуществите следующие превращения:
- •4. Осуществите превращение: бутин-1 → бутин-2
- •2.4. Арены (Ароматические углеводороды)
- •1. Напишите структурные формулы изомерных алкилбензолов состава с9н 12. Назовите их.
- •3. Определите характер группы - осн3 (заместитель 1 или 2 рода, о-, п - или м-ориентант) в молекуле метоксибензола.
- •5. Предложите наиболее рациональный способ получения из бензола 2-хлор-4-нитротолуол.
- •6. Осуществите превращения:
- •Раздел 3. Кислородсодержащие соединения
- •3.1. Спирты. Фенолы.
- •1. Напишите структурные формулы изомеров состава с4н10о. Назовите соединения по рациональной номенклатуре и июпак. Среди них укажите первичные, вторичные и третичные спирты, простые эфиры.
- •2. С помощью каких реакций и реагентов можно из бутанола-2 получить следующие соединения:
- •3. Как с помощью химических реакций отличить друг от друга глицерин, фенол, бензиловый спирт?
- •4. Какие соединения могут быть получены при окислении раствором kMnO4 пропилового спирта, изопропилового спирта, фенола?
- •5. Какой спирт можно получить в результате следующих превращений:
- •6. Осуществить превращения:
- •3.2. Альдегиды и кетоны (карбонильные соединения)
- •1. Напишите структурные формулы изомеров карбонильных соединений с общей формулой c5h10o и назовите их по рациональной номенклатуре, номенклатуре июпак.
- •2. Напишите уравнения реакций окисления хромовой смесью бутаналя и 2-метилпентанона-3.
- •3. Напишите схемы реакций ацетона и уксусного альдегида с синильной кислотой, гидроксиламином. Сравните реакционную активность карбонильных соединений в этих реакциях.
- •4. Получите возможными способами ацетон.
- •3.3. Карбоновые кислоты и их производные
- •1. Сравните кислотные свойства кислот: бутановой (масляной), пропановой (пропионовой),
- •2. Сравните кислотные свойства бензойной, п-нитробензойной и п-оксибензойной кислот.
- •3. Получите пропионовую кислоту (пропановую) всеми возможными способами.
- •4. Напишите уравнение реакции взаимодействия уксусной кислоты с этиловым спиртом. Назовите полученное соединение. Напишите уравнения гидролиза сложного эфира в кислой и щелочной средах.
- •5. Напишите уравнение реакции, протекающей при нагревании β-гидроксимасляной кислоты.
- •6. Напишите уравнения реакции олеииодистеарина с водородом, бромом, перманганатом калия, полного щелочного гидролиза стеарина. Назовите продукты реакций.
- •7. Напишите уравнения реакций, протекающих при последовательном действии на пропановую кислоту следующих реагентов: 1. Хлора (в присутствии следов фосфора); 2. Гидроксида калия в спиртовой среде;
- •3. Бромоводорода; 4. Водного раствора гидроксида калия; 5. Избытка хлорида фосфора (III). Назовите промежуточные и конечные продукты реакций.
- •Раздел 4. Углеводы
- •2. Напишите, используя перспективные формулы Хеуорса, пиранозные и фуранознгые и- формы рибозы. Назовите эти формы, укажите гликозидный (полуацетальный) гидроксил.
- •3. Напишите уравнения реакций окисления (реакция «серебряного зеркала») d-рибозы и её взаимодействия с метиловым спиртом. Назовите продукты реакций.
- •1. Напишите уравнения образования восстанавливающего и невосстанавливающего дисахарида из двух молекул ,d–рибофуранозы. Назовите полученные соединения.
- •Раздел 5. Азотсодержащие соединения
- •5.1. Амины. Аминокислоты
- •1. Напишите структурные формулы следующих аминов:
- •2. Сравните основные свойства следующих аминов: этиламин, аммиак, диэтиламин, анилин, п-нитроанилин. Напишите уравнения реакций диэтиламина и анилина с соляной кислотой.
- •4. Сравните действие азотистой кислоты на метиламин, п-толуидин, n-метиланилин.
- •5. Из нитробензола получите м-, о- и п- нитроанилины.
- •6. Представьте формулы биполярных ионов аланина (2-аминопропановая кислота), аспарагиновой кислоты (аминобутандиовая кислота), орнитина (2,5-диаминопентановая кислота).
- •7. Напишите уравнение образования трипептида из аланина.
- •II. Методические рекомендации по выполнению лабораторных работ
- •1. Фильтрование
- •2. Кристаллизация (перекристаллизация)
- •3. Перегонка
- •4. Экстракция
- •5. Возгонка
- •1.3. Лабораторная работа №2. Качественный элементный анализ органических соединений
- •1. Обнаружениеуглерода пробой на обугливание
- •2. Обнаружение углерода и водорода
- •4. Обнаружение галогенов
- •5. Обнаружение серы
- •1. 1. Отношение алканов к брому
- •1. 2. Отношение алканов к окислителям
- •1. 3. Горение алканов
- •2. Алкены, диены, алкины (Непредельные углеводороды)
- •2.1. Отношение непредельных углеводородов к брому
- •2.2. Отношение непредельных углеводородов к окислителям
- •2.3. Особые свойства алкинов (получение ацетиленида меди)
- •3 Арены (Ароматические углеводороды)
- •3. 1. Отношение бензола к брому (тяга!)
- •3. 2. Отношение бензола и его гомологов к окислителям
- •5. Горение ароматических углеводородов (тяга!)
- •1. Спирты
- •2. Альдегиды и кетоны (Карбонильные соединения)
- •2. 1. Отношение альдегидов и кетонов к нуклеофильным реагентам
- •2. 2. Отношение карбонильных соединений к слабым окислителям
- •3. Карбоновые кислоты и их производные
- •3. 1. Растворимость предельных монокарбоновых кислот кислот в воде и органических растворителях
- •3. 2. Кислотные свойства предельных карбоновых кислот
- •3.3. Сравнение кислотных свойств карбоновых и минеральных кислот
- •3. 4. Производные карбоновых кислот
- •1. Реакция на гидроксильные группы в углеводах
- •2. Реакции на карбонильную группу в углеводах
- •3. Взаимодействие крахмала с иодом
- •III. Задания для самостоятельного решения
- •1) Назовите соединения по заместительной номенклатуре июпак (а-п):
- •2. Напишите структурные формулы следующих соединений (а-п):
- •2. Обозначьте графически электронные эффекты в нижепредставленных соединениях. На примере одного соединения рассмотрите виды сопряжения и напишите его мезоформулу (а-п):
4. Определите число оптических изомеров хлоряблочной кислоты (2-гидрокси-3-хлорбутандиовая кислота). Назовите и представьте их в виде проекций Фишера.
Решение:
С увеличением числа асимметрических атомов углерода в составе соединений количество оптических изомеров увеличивается. R, S- конфигурация каждого хирального центра определяется отдельно по тем же правилам, что и для соединений с одним асимметрическим атомом углерода.
Молекулы с двумя асимметрическими атомами углерода могут существовать в виде четырех оптических изомеров (N=22=4). Ниже приведены стереоизомеры хлоряблочной кислоты
1 2 3 4
НООС-СН(ОН) –СН(СI)-СООН:
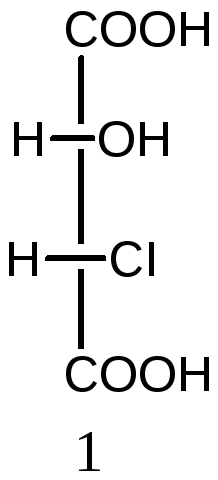
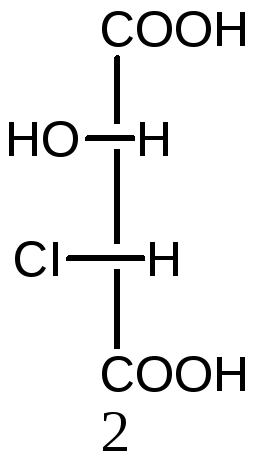
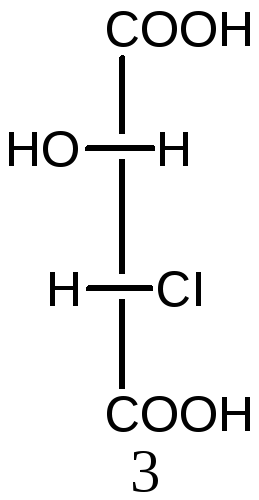
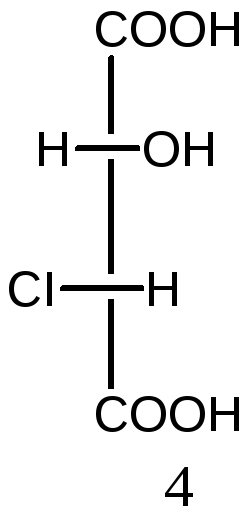
2S,3S-изомер 2R,3R-изомер 2R,3S-изомер 2S,3R-изомер
Пары 1 и 2, а также 3 и 4 являются парами энантиомеров. Изомеры в других парах являются диастереомерами: 1 и 3, а также 2 и 4. Диастереомеры имеют различия в физических и химических свойствах.
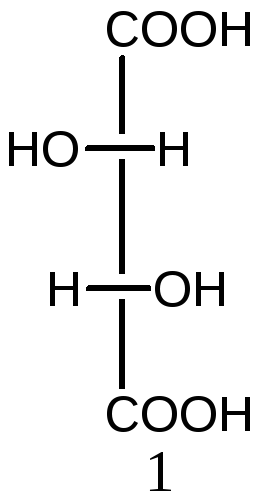
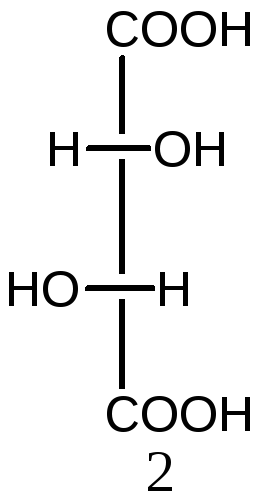
5. Определите число оптических изомеров винной кислоты (2,3-дигидроксибутандиовая кислота). Назовите и представьте их в виде проекций Фишера.
Решение:
Число оптических изомеров в винной кислоте по формуле Фишера соответствует четырем. Однако в кислоте асимметрические атомы углерода имеют одинаковое окружение, поэтому в молекуле изомера 3 появляется плоскость симметрии, проходящая через середину связи 2С-3С. Данная молекула ахиральна (соединения 3 и 4 совместимы), оптически неактивная. Такой изомер называется мезоформой. Таким образом, общее количество изомеров уменьшается на единицу и не соответствует формуле Фишера:
![]() =
=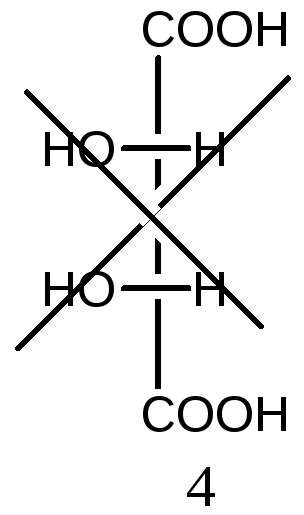
2S,3S-форма 2R,3R-форма 2R,3S- мезоформа
Раздел 2. Углеводороды
Наиболее простыми по составу и строению органическими соединениями являются углеводороды, так как их молекулы содержат только углеродные и водородные атомы. Углеводороды различаются числом атомов углерода, наличием простых, двойных и тройных связей и последовательностью соединения углеродных атомов. Различают углеводороды с открытой (ациклические - предельные, непредельные) и замкнутой углеродной цепью (алициклические и ароматические). Соединения перечисленных углеводородов группируются в гомологические ряды.
Изучению углеводородов следует уделить наибольшее внимание, поскольку при их изучении затрагиваются почти все теоретические вопросы.
Успехи генетического рассмотрения веществ при последующем изучении органической химии во многом определяются знанием исходных соединений – углеводородов.
Изучение углеводородов следует начать с класса предельных углеводородов.
Методические рекомендации по написанию уравнений органических реакций.
Органические реакции могут быть выражены уравнениями, в которых подбирают коэффициенты и уравнивают количество атомов в правой и левой частях. Однако часто пишут не уравнения, а схемы органических реакций. При написании уравненений (схем) необходимо придерживаться следующих правил:
1. направление превращений веществ в реакциях указывают стрелкой;
2. коэффициенты в левой и правой частях не указывают;
3. под стрелкой указывают условия реакций;
4. реагенты изображают над стрелкой, а образующиеся неорганические вещества – под стрелкой со знаком минус.
Например: СН3-СН3 + CI2 → СН3-СН2 – CI + НCI
t
CI2
или СН3-СН3 → СН3-СН2CI
t ,-НCI
Иногда под стрелкой (в скобках) указывают исходные вещества, которые в результате взаимодействия между собой образуют реагент (обозначается над стрелкой). Например:
НОNО
СН3-NН2 → СН3-ОН + N2 + Н2О
(NаNО2 + НCI)
Реагент – азотистая кислота образуется из взятых в реакцию нитрита натрия и соляной кислоты; получаемый хлорид натрия в схеме не обозначен, так как не имеет непосредственного отношения к процессу.
