
Введение гидроксигруппы в углеводород значительно повышает электронодонорные свойства соединения, в том числе его способность отдавать электрон. Ниже сравниваются значения первых потенциалов ионизации бензола и фенола.
Соединение |
С6Н6 |
С6Н5ОН |
|
бензол |
фенол |
I1, эВ |
9,24 |
8,70 |
Эти значения характеризуют простейшие одноэлектронные реакции указанных субстратов, протекающие в газовой фазе. В качестве примера реакций фенолов в жидкой фазе, включающих стадии одноэлектронного переноса, можно указать реакции электрофильного ароматического замещения (см. разд. 17.4.4) и реакции окисления (см. разд. 17.4.5).
17.4.РЕАКЦИИ
17.4.1.Кислотность
Реакции гидроксильной группы фенолов по сравнению с реакциями спиртов имеют значительные особенности. В частности, кислотность фенолов существенно выше кислотности спиртов и воды.
Соединение |
С Н |
ОН |
Н О С Н ОН |
Н СО |
3 |
СН СООН |
НСl |
|
2 |
5 |
|
2 |
6 |
5 |
2 |
3 |
соляная |
|
этанол |
вода |
фенол |
угольная |
уксусная |
|
|
|
|
|
|
|
кислота |
кислота |
кислота |
рКа |
15,9 |
15,7 |
9,98 |
7,0 |
|
4,76 |
–7,0 |
Более высокая кислотность фенолов по сравнению с кислотностью спиртов объясняется резонансной стабилизацией их сопряженных оснований — феноксид-ионов:
O H + H2O |
H3O + |
|
O |
–I, +M |
|
|
|
O |
O |
O |
O |

Заместители в бензольном кольце в значительной мере влияют на кислотность фенолов. Электронодонорные группы уменьшают кислотность, так как затрудняют делокализацию отрицательного заряда в феноксидионе и уменьшают его устойчивость. В пара-положении электроноакцепторные группы повышают кислотность в большей степени, чем в мета-по- ложении, так как способствуют делокализации отрицательного заряда в фе- ноксид-ионе за счет –М-эффекта и увеличивают его устойчивость. Ниже представлены различные фенолы и значения их рКа.
OH |
OH |
OH |
OH |
OH |
OH |
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
NO2 |
OCH3 |
CH3 |
|
|
|
|
CN |
|
|
NO2 |
п-метокси- |
п-крезол |
м-крезол |
фенол п-циано- м-нитро- |
п-нитро- |
фенол |
|
|
|
|
|
|
фенол |
фенол |
фенол |
рКа: 10,26 |
10,21 |
10,01 |
9,98 |
|
7,97 |
|
8,30 |
7,15 |
|
Введение нитрогруппы в пара-положение повышает кислотность особенно сильно (почти на три порядка) вследствие эффективной резонансной стабилизации соответствующего феноксид-иона:
OH |
O |
O |
H2O |
+ |
|
H3O |
|
N |
N |
N |
O O |
O O |
O O |
O |
O |
O |
резонансные структуры п-нитрофеноксид-иона (вклад пятой резонансной структуры наиболее высок)
N N N
 O O
O O  O O
O O  O O
O O
Введение двух и трех нитрогрупп в орто- и пара-положения приводит к еще большему повышению кислотности: значение рКа 2,4-динитрофенола
равно 4,03, а значение рКа 2,4,6-тринитрофенола (пикриновая кислота) равно 0,25.
Особого внимания заслуживает ряд кислотности п-галогенфенолов п-Х–С6Н4–ОН:
Х |
F |
Cl |
Br |
I |
рКа |
9,95 |
9,38 |
9,36 |
9,31 |
Несмотря на то, что электроотрицательность галогенов (а следовательно, и их — I-эффект) снижается в ряду: F > Cl > Br > I, кислотность п-гало- генфенолов уменьшается в обратном направлении — таким образом, что п- фторфенол имеет наименьшую кислотность. Этот факт объясняется тем, что атом фтора обладает также и наиболее высоким положительным эффектом сопряжения. +М-эффект пара-заместителя дестабилизирует сопряженное основание и тем самым снижает кислотность соответствующего фенола (подробнее о количественном соотношении I- и М-эффектов заместителей, присоединенных к бензольному циклу, см. в т. I, гл. 1, разд. «Для углубленного изучения»).
Заместители в орто-положении оказывают на кислотные свойства гидроксильной группы не только электронное, но и стерическое влияние. Некоторые орто-заместители образуют внутримолекулярные водородные связи с гидроксигруппой. Указанные эффекты могут привести как к увеличению, так и к уменьшению кислотности («орто-эффект»).
Задача 17.2. Расположите следующие соединения в порядке повышения кислотности:
а) этиловый спирт; |
г) п-крезол; |
б) 2,4,6-тринитрофенол; |
д) п-хлорфенол; |
в) фенол; |
е) п-нитрофенол. |
17.4.2.Нуклеофильные свойства фенолов и феноксид-ионов
Повышенная кислотность фенолов по сравнению со спиртами проявляется в способности фенолов образовывать с водными растворами
щелочей и спиртовыми растворами алкоголятов соли, называемые фенолятами:
C6H5OH |
NaOH |
C6H5O Na + H2O |
H O |
|
|
2 |
|
|
фенол |
|
|
феноксид натрия |
C6H5OH C2H5O Na
Na C6H5O
C6H5O Na
Na + C2H5OH
+ C2H5OH
(C2H5OH)
Феноляты щелочных металлов имеют ионное строение, растворимы в воде. В отличие от фенола феноксид-ион является хорошим нуклеофилом и основанием, но более слабым, чем гидроксид- и алкоксид-ионы:
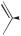
 O
O < H O
< H O < R
< R  O
O
рост основности и нуклеофильности
Фенолы как кислоты не реагируют с карбонатом натрия, однако 2,4-ди- нитрофенол и пикриновая кислота дают феноляты при действии водного раствора соды:
OH |
|
O Na |
|
|
NO2 |
Na2CO3 |
|
NO2 |
|
|
|
|
+ CO2 |
+ H2O |
|
|
(H2O) |
|
NO2 |
NO2 |
|
|
|
2,4-динитрофенол |
|
|
|
|
При действии на феноляты кислот, более сильных, чем соответствующий фенол, последний выделяется из соли:
|
C6H5O Nа |
HCl |
C6H5OH + NaCl |
|
(H2O) |
|
феноксид натрия |
фенол |
|
|
Способность фенолов растворяться в водных растворах щелочей используют для выделения фенолов из смесей с нейтральными или менее кислыми соединениями, а также как качественную реакцию на фенолы.
Большинство фенолов (как и енолов) дают характерное окрашивание с вод-
ным или спиртовым раствором хлорида железа(III) FeCl3 вследствие образования комплексных солей железа (цветная качественная реакция на фенолы).
При этом фенол окрашивается в красно-фиолетовый цвет, крезол — в синий, резорцин — в темно-фиолетовый, а салициловая кислота — в красный цвет.
О-Алкилирование фенолов
Значительное сопряжение НЭП атома кислорода фенола с π-орбиталями бензольного кольца приводит к понижению основности и нуклеофильности фенолов по сравнению со спиртами. Фенолы как нуклеофилы не реагируют да-
же с самыми реакционноспособными галогеналканами. Простые эфиры фенолов получают по реакции Вильямсона (1852 г.) взаимодействием фенок-
сид-иона с галогеналканами, способными вступать в реакции SN2:
|
C6H5OH |
C2H5O Na |
C6H5O Na |
C2H5Br |
C6H5OC2H5 |
+ NaBr |
|
C2H5OH |
|
(SN2) |
|
фенол |
|
этоксибензол |
|
|
|
|
|
|
|
|
|
|
|
|
|
(фенетол) |
|

Как и в других реакциях SN2, в реакции Вильямсона активнее других галогеналканов проявляют себя галогенметаны и первичные галогеналканы. В качестве растворителя в реакции применяют ацетон, диметилформамид и даже спирт. Реакция с этоксид-ионом не оказывается в этом случае сколь- ко-нибудь заметным побочным превращением галогеналкана, поскольку различие величин кислотности фенола и спирта слишком велико:
C6H5O + C2H5OH
+ C2H5OH 
 C6H5OH + C2H5O
C6H5OH + C2H5O
При этом следует иметь ввиду, что феноксид-ионы являются амбидентными нуклеофилами, поскольку отрицательный заряд в них распределен не только на атоме кислорода, но и в орто- и пара-положениях бензольного кольца. Еще раз убедиться в этом можно, обратившись к резонансным структурам феноксид-иона, показанным в разд. 17.4.1. Потенциально эти ионы могут реагировать по двум реакционным центрам — по атому кислорода и по одному из атомов углерода.
В связи с этим отметим, например, что алкилирование феноксид-иона с участием аллилхлорида, склонного реагировать в протонном растворителе (например, в метаноле) по механизму SN1, нацело протекает по атому кислорода: жесткая кислота (аллил-катион) реагирует с жестким основанием — нуклеофильным центром, каким является О-атом в феноксид-ионе. Затруднение О-алкилирования наблюдается лишь в присутствие воды в составе растворителя, что, по-видимому, связано с повышенной сольватацией феноксидного О-атома молекулами воды. В таких условиях при алкилировании аллил- и бензилгалогенидами отмечается появление продуктов С-алкилирова- ния (подробное обсуждение амбидентности нуклеофилов в реакциях нуклеофильного замещения см. на стр. 250).
|
O Na |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ CH2 |
|
CH |
|
|
CH2 |
|
Cl |
|
|
H2O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
аллилхлорид |
|
|
|
|
|
|
фенол, |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Na-соль |
|
|
|
O |
|
|
CH2 |
|
CH |
|
|
CH2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
аллилфениловый |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
эфир (100%) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
CH2 |
|
CH |
|
CH2 |
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH2 |
|
CH |
|
CH2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
аллилфениловый |
+ |
|
орто-аллилфенол |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
эфир (49%) |
|
(41%) |
|
|
|
|
Затруднение О-алкилирования не отмечено при получении метиловых эфиров фенолов их реакцией с эфирами сульфокислот.

Метиловые эфиры фенолов часто получают реакцией фенолов с диметилсульфатом в растворе щелочи. Роль щелочи состоит в превращении фенола в феноксид-ион, который как более сильный нуклеофил легко реагирует с диметилсульфатом по механизму SN2:
|
C6H5OH |
(CH3O)2SO2 |
C6H5OCH3 |
+ CH3OSO2O Na |
|
|
|
|
NaOH, H2O |
|
фенол |
метоксибензол |
|
|
|
|
|
|
|
|
|
(анизол) |
|
Задача 17.3 (17.6). Предложите оптимальные схемы получения следующих соединений: а) анизол; б) 2-бром-4'-нитродифениловый эфир.
О-Ацилирование фенолов
Фенолы обладают низкой нуклеофильностью и поэтому реагируют только с активными ацилирующими реагентами — хлорангидридами и ангидридами. Алифатические хлорангидриды реагируют особенно активно:
|
|
|
O |
|
|
|
|
O |
C6H5OH + R |
|
C |
|
|
R |
|
C |
+ HCl |
|
|
|
|
|
|
фенол |
Cl |
|
|
|
|
OC6H5 |
фениловый эфир карбоновой кислоты
Ароматические хлорангидриды значительно менее реакционноспособны,
чем алифатические. Реакции фенолов с ароматическими хлорангидридами проводят обычно по методу Шоттена–Баумана (1884 г.): к раствору фенола
в щелочи или пиридине прибавляют хлорангидрид и энергично встряхивают:
C6H5OH |
|
|
O |
|
NaOH, H2O |
|
|
|
O |
+ NaCl |
+ C6H5 |
|
C |
|
C6H5 |
|
C |
|
(или пиридин) |
|
фенол |
|
|
Cl |
|
|
OC H |
|
|
|
|
|
|
|
6 |
5 |
|
бензоилхлорид |
|
|
|
фенилбензоат |
|
Сложные эфиры уксусной кислоты часто получают реакцией фенолов с уксусным ангидридом. Реакцию проводят при слабом нагревании в присутствии небольшого количества минеральной кислоты (часто H2SO4) в качестве катализатора; реакция протекает с количественным выходом:
|
H3C |
|
O |
|
|
|
O |
|
C6H5OH + |
|
C |
H |
H3C |
|
+ CH3COOH |
|
|
|
O |
|
C |
|
|
|
|
|
|
40–50 °C |
фенол |
H C |
|
C |
|
|
OC6H5 |
уксусная |
|
|
|
|
|
|
|
|
|
3 |
|
O |
|
|
|
|
кислота |
|
|
|
|
фенилацетат |
|
|
|
|
|
уксусный ангидрид
Фенолы практически не вступают в реакцию этерификации карбоновых кислот, в том числе в присутствии минеральных кислот.
Электрофильное замещение в феноксид-ионе
Как сказано выше, феноксид-ион является высокореакционноспособной частицей и реагирует даже с самыми слабыми электрофильными реагентами.
РЕАКЦИЯ КÓЛЬБЕ–ШМИТТА. СИНТЕЗ ФЕНОЛКАРБОНОВЫХ КИСЛОТ
Феноляты натрия и калия взаимодействуют с диоксидом углерода. Реакции протекают при нагревании и под давлением. В зависимости от температуры
образуются орто- или пара-изомеры фенолкарбоновых кислот (реакция Кольбе–Шмитта, 1860 г.; 1884 г.).
O Na |
OH |
|
|
OH |
|
|
CO2 |
|
|
COO Na |
HCl |
|
|
COOH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
125 °C, p |
|
|
|
|
|
|
|
|
|
фенолят |
|
|
|
|
о-гидроксибензойная |
натрия |
|
|
|
|
(салициловая кислота) |
O K |
OH |
OH |
|
|
CO2 |
|
|
|
HCl |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
250 °C, p |
|
|
|
|
|
|
|
|
|
фенолят |
COO K |
COOH |
калия |
п-гидроксибензойная кислота
Причины высокой региоселективности не вполне ясны. В качестве субстрата в реакции, вероятнее всего, выступает феноксид-ион, а диоксид углерода является электрофильным агентом. Реакция в таком случае должна протекать как процесс SEAr:
O |
|
|
O |
OH |
O |
|
Oδ |
H |
|
|
|
C |
+ |
C |
δ |
C O |
|
O |
|
|
|
|
|
Oδ |
O |
|
|
феноксид- |
|
|
σ-комплекс |
салицилат- |
ион |
|
|
|
|
ион |
Чтобы попытаться понять влияние температуры на результаты карбонизации фенолов, следует остановиться на этой схеме более подробно. Полагают, что ряд реакций SEAr ароматических субстратов, содержащих электронодонорные заместители (и прежде всего заместители, имеющие НЭП), может включать на одной из предкинетических стадий комплексообразова-

ние электрофильного агента по соответствующему атому заместителя, например по атому кислорода (комплекс А).
O
C O
 O
O
A
Логично предположить, что такой комплекс по пространственным причинам и при прочих равных условиях легче будет перегруппировываться в орто-σ-комплекс, нежели в пара-σ-комплекс. Возможно, что при низкой температуре содержание комплекса А достаточно велико, чтобы объяснить предпочтительное образование о-гидроксибензойной кислоты. При более высокой температуре комплекс А, вероятно, не столь прочен. Его содержание недостаточно, чтобы заметно влиять на изомерный состав продуктов карбонизации. Преобладание п-гидроксибензойной кислоты в этих условиях может определяться ее большей термодинамической стабильностью.
Салициловую кислоту и ряд ее производных применяют в качестве лекарственных препаратов.
|
OH |
|
OCOCH3 |
|
OH |
|
COOCH3 |
|
COOH |
|
COOC6H5 |
|
|
|
метилсалицилат |
ацетилсалициловая |
фенилсалицилат |
|
|
кислота (аспирин) |
|
(салол) |
Реакцию Кольбе–Шмитта применяют в промышленности также для получения п-аминосалициловой и гидроксинафтойных кислот. Например, Na-соль 2-нафтола с диоксидом углерода в отсутствии воды при 120–140 °С дает 2-гидрокси-1-нафтойную кислоту, а при 220–240 °С — 3-гидрокси- 2-нафтойную кислоту:
|
|
|
|
|
|
COOH |
|
CO2 H3O |
|
OH |
ONa |
|
2-гидрокси- |
|
|
|
|
|
|
120–140 °C |
|
|
1-нафтойная кислота |
|
|
|
|
|
|
|
|
|
CO2 |
|
H3O |
|
|
OH |
|
Na-соль 2-нафтола |
|
|
|
|
|
|
220–240 °C |
|
|
|
|
|
|
|
|
|
COOH
3-гидрокси-
2-нафтойная кислота
СОЧЕТАНИЕ С СОЛЯМИ ДИАЗОНИЯ. ОБРАЗОВАНИЕ АЗОСОЕДИНЕНИЙ
Реакции азосочетания с феноксид-ионами также протекают по механизму электрофильного ароматического замещения и широко применяются в производстве азокрасителей.
Реакция с феноксид-ионом идет преимущественно в пара-положение; орто-изомер образуется лишь в незначительном количестве.
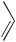
 N
N N Cl +
N Cl + 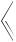
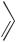
 O
O  Na
Na
хлорид бензолдиазония
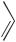
 N
N N
N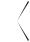
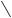
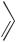
 OH + NaCl
OH + NaCl
4-гидроксиазобензол
РЕАКЦИИ С ФОРМАЛЬДЕГИДОМ
Так же легко протекает реакция феноксид-иона в присутствии разбавленной щелочи с формальдегидом. Эта реакция составляет основу производства фенолоформальдегидных смол.
O Na |
O |
|
H δ |
H |
|
|
|
+ C Oδ |
CH2O |
Na |
H |
|
|
O |
|
O |
CH2 |
OH |
CH2 |
+ OH,
O |
O |
O |
O |
|
CH2 |
|
CH2 |
|
+ |
|
H |
|
|
O |
OH |
|
|
|
CH2 |
К этим смолам принадлежит и бакелит — один из первых коммерческих полимерных материалов.
РЕАКЦИЯ РАЙМЕРА–ТИМАНА
Получение альдегидов бензольного ряда взаимодействием фенолов с хлороформом в щелочном растворе известно как реакция Раймера–Тимана
(1876 г.). Электрофильным агентом в реакции с феноксид-ионом выступает дихлоркарбен (см. разд. 5.4.6). Замещение преимущественно идет в орто- положение.
 CCl3
CCl3 
 CCl2 + Cl ,
CCl2 + Cl ,
O |
|
|
O |
|
OH |
|
|
|
|
|
CHCl2 |
OH, H2O |
CHO |
|
+ |
CCl2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
дихлор- |
|
|
|
феноксид- |
карбен |
|
салициловый |
ион |
|
|
|
|
|
альдегид |
Реакция идет также с полициклическими углеводородами и гетероароматическими соединениями.
17.4.3.Замещение гидроксигруппы в нитрофенолах
Связь кислорода с ароматическим атомом углерода обладает высокой прочностью из-за сопряжения орбитали НЭП кислорода с π-орбиталями кольца. Фенолы в отличие от спиртов не превращаются в арилгалогениды при нагревании с концентрированными галогеноводородными кислотами и при действии галогенидов серы и фосфора. Только фенолы, содержащие нитрогруппы в орто- и пара-положениях к гидроксильной группе, взаимодействуют с PCl5:
OH |
|
Cl |
|
|
NO2 |
PCl5 |
|
NO2 |
|
|
|
|
+ POCl3 |
+ HCl |
|
|
|
|
NO2 |
|
NO2 |
|
2,4-динитро- |
2,4-динитро- |
фенол |
хлорбензол |




 Na
Na C6H5O
C6H5O Na
Na + C2H5OH
+ C2H5OH
 O
O < H O
< H O < R
< R  O
O







 O O
O O  O O
O O  O O
O O
 + C
+ C
 C
C
 O
O
 N
N N Cl +
N Cl + 
 O
O  Na
Na
 N
N N
N
 OH + NaCl
OH + NaCl CCl
CCl
 CCl
CCl