Лекция 3
Ранее мы рассмотрели три группы механизмов репликации вирусной ДНК по способу инициации синтеза ДНК.
1.Образование РНК-затравки на о.ц. ДНК-матрице
а) с помощью РНК полимеразы
б) с помощью праймазы
2.Инициация с внесением разрывов в д.ц. ДНК-матрицу
3.Нуклеотид-белковая затравка
Инициация с образованием внутренней затравки на двуцепочечной днк-матрице без внесения разрывов.
Задача: локально расплести ДНК и посадить хеликазу с праймазой.








Решить эту задачу можно несколькими способами.
Papovaviridae
Papilloma
Polioma
Vacuolating virises (SV 40 (Simian Vacuolating Virus))
Размер генома примерно одинаков: вирусы папилломы – 8 т.п.н., полиомы – 5 т.п.н. Детально мы рассмотрим вирусы полиомы и SV 40.
Хозяева: SV 40 – приматы
Полиомы – мышиные
Место репликации: в ядре, находящемся в S-фазе. SV 40 может переводить клетку в S-фазу клеточного цикла.
Схема репликации: Θ-схема (Cхема Кернса).
Придумана Кернсом 40 л.н для объяснения репликации ДНК E.coli. Было известно, что геном E.coli представлен кольцевой молекулой. Кернс понял, что основной проблемой в ее репликации – устранение топологических препятствий (о сверхспиральности в то время не имели понятия). Он предположил, что должен быть «шарнир», позволяющий вращаться одной цепи ДНК вокруг другой. Сейчас этим «шарниром» мы называем топоизомеру.
У молекулы ДНК, реплицирующейся согласно схеме Кернса, имеется участок, называемый ori.
SV 40.
Геном представлен двуцепочечной кольцевой ДНК. В геноме закодирован белок – большой Т-Ag (80 кДа). Он единственный вирусный белок участвующий в репликации ДНК. Белок полифункционален:
1.способен взаимодействовать с рядом TF (переход клетки в S-фазу)
2.сам является TF (синтез вирусных белков)
3.узнает ori (т.е. отностся к группе белков OBP-Ori Binding Proteins)
4.способен к олигомеризации. В присутствии АТФ и ori образует кольцевой гексамер.
5.обладает хеликазной активностью (3'-5')
Примечание: может неспецифически взаимодействовать с о.ц.ДНК.
С
Ori находится в условном положении 0,67
труктура ori
SV 40.
21 22 22

L






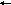








L E III II
I

Pu/Py ORE A/T
CORE


Е
0, 67
o ri
состоит из трех участков. В этих находятся
пентануклеотидные последовательности
GAGGC ( ),
узнаваемые T-Ag.
В III участке находятся
повторы 21, 22 п.н.
ri
состоит из трех участков. В этих находятся
пентануклеотидные последовательности
GAGGC ( ),
узнаваемые T-Ag.
В III участке находятся
повторы 21, 22 п.н.
Во II втором участке находится ORE (Ori Recognition Element), с которым связывается T-Ag, он входит в состав CORE (Core Ori Recognition Element) длиной 64 п.н., и фланкирован c одной стороны А/Т богатым участком, с другой - Pu/Py последовательностью. Общая длина ori со всеми прилегающими участками – 170 п.н.
Сила взаимодействия T-Ag с ORE зависит от степени его фосфорилирования.
Инициация репликации SV 40.
В
области ori рядом друг с
другом связываются два гексамера T-Ag
(при этом форма гексамеров такова, что
в электронном микроскопе видно, будто
каждый состоит из двух колец) и фиксируют
участок ДНК. Затем гексамеры поворачиваются
друг относительно друга гидролизуя
при этом АТФ. В результате меняется
размер внутреннего канала, что
сопровождается плавлением участка ДНК
между ними. Поскольку гексамеры остаются
связанными, происходит выпетлевывание
ДНК.




















Далее T-Ag проявляет хеликазную активность (3'-5') и расплетает область Ori. На о.ц. ДНК тут же садятся олигомеры RPA (Replicating protein A, аналог SSB E.coli). Затем с расплетенным участком связывается ДНКpolα/праймаза. В комплексе устанавливается физическое взаимодействие T-Ag с RPA и ДНКpolα. ДНКpolα синтезирует РНК-ДНК затравку: короткий олигорибонуклеотид (10 нт) и короткий олигодезоксирибонуклеотид (~20 нт).
T-Ag специфически узнает клеточные белки RPA и ДНКpolα только приматов. Этим и ограничен круг хозяев SV40.
Примечание: внешние факторы, определяющие хозяева вирусов – белки оболочки, в данном случае мы встречаемся с внутренними факторами.
В комплекс входят также клеточная топоизомераза I, устраняющая топологические проблемы (также взаимодействует с Т-Ag) и протеинфосфатаза, регулирующая степень фосфорилированности T-Ag.
Примечание: ДНК SV40 упакована в нуклеосомы (около 20 нуклеосом), т.е. представляет собой минихромосому. Одна из нуклеосом позиционирована на ori и делает его недоступным для взаимодействия с T-Ag. Освобождают ori клеточные комплексы ремоделирования.
Инициация репликации у вирусов полиомы.
Все в принципе то же самое отличие в том, что вместо пентануклеотидных повторов в ori находятся гексануклеотидные и их положение немного отличается.
Элонгация репликации SV40.
ДНКpolα непроцессивный фермент, не обладающий 3'-5' экзонуклеазной активностью (proofreading activity), поэтому часто ошибается и часто соскакивает с ДНК. Она далее замещается на высокопроцессивный фермент ДНКpolδ. Репликация двусторонняя (хотя есть случаи односторонней репликации). Считается, гексамеры T-Ag закреплены на ядерных структурах, поэтому ДНК протаскивается через них.
Примечание: при репликации ДНК одна из синтезируемых цепей является "лидирующей", она синтезируется непрерывно, другая цепь называется отстающей, поскольку синтезируется фрагментами. Полимераза должна уметь делать все, при этом оставаясь связанной с T-Ag. Тогда получается, что T-Ag, связанный с 3'-5' цепью, физически движется в противоположную сторону относительно ДНКpolα, находящейся на 5'-3' цепи.
Умозрительное объяснение этого факта – модель "трубы".
5'
3'

5'



3'
В результате работы комплекса, включающего
T-Ag и
полимеразы, образуется репликативный
" глазок ". По мере появления на
5'-3' цепи участков, на которых возможен
синтез
результате работы комплекса, включающего
T-Ag и
полимеразы, образуется репликативный
" глазок ". По мере появления на
5'-3' цепи участков, на которых возможен
синтез
затравки,
ДНКpolα делает затравку.
Синтезировав короткий кусок, она
сваливается и на ее место загружается
ДНКpolδ.




5' 3'


3' 5'





Для
высокопроцессивной работы ДНКpolδ
нужен PCNA, фактор
увеличивающий процессивность полимеразы.
Иначе его называют clamp
(«скрепка»). Фактор является гетеротримером
и загружается на ДНК с помощью комплекса
RF-C (),
называемого clamp-loader.
Лучше всего PCNA загружается
на границе о.ц и д.ц. ДНК.









Соединение фрагментов Оказаки.
Может участвовать РНКазаН, но здесь, видимо, работает иной механизм с участием эндонуклеазы FEN (Flap(фартук) ENdonuclease).
FEN ДНКpolδ
вытесняет кусок длиной около 30нт,
который откусывает FEN.
ДНКpolδ достраивает брешь,
RF-C снимает
clamp и полимераза
отваливается. Клеточная лигаза зашивает
разрыв.




Pol, лигаза