
- •Комплексные
- •Метод валентных связей
- •Метод валентных связей: связь – донорно-
- •Геометрическая конфигурация комплексов
- •Основные положения теории кристаллического поля (ТКП)
- •Влияние октаэдрического поля лигандов на d–подуровень центрального атома:
- •Расщепление d-подуровня
- •Расщепление d-подуровня
- •Искажение октаэдрического комплекса в
- •Расщепление d-подуровня
- •Факторы, влияющие на величину ∆ - энергии расщепления d-подуровня
- •Влияние числа и пространственной ориентации лигандов на расщепление d-подуровня
- •Влияние природы лигандов
- •Влияние природы лиганда
- •Распределение электронов по d-орбиталям
- •Распределение электронов по d-орбиталям:
- •Сильное поле
- •Лиганды сильного и слабого поля и распределение электронов
- •Распределение электронов (d8)
- •Измерение магнитного момента вещества с помощью весов Гюи.
- •Энергия стабилизации кристаллическим полем (ЭСКП)
- •Энергия стабилизации
- •Зависимость ЭСКП от электронной конфигурации центрального иона
- •Энергия кристаллической решетки фторидов (MF2) 3d-металлов
- •Более устойчив
- •Окраска предмета и поглощение света его поверхностью
- •Схема экспериментальной установки для измерения спектра поглощения раствора
- •Окраска комплексных соединений
- •Параметр расщепления
- •Влияние энергии расщепления d-подуровня на окраску комплекса
- •Параметр расщепления
- •Теория кристаллического поля (ТКП)
- •Литература

Зависимость ЭСКП от электронной конфигурации центрального иона
1 – сильное октаэдрическое поле (без учета энергии спаривания);
2 – слабое октаэдрическое поле; 3 – тетраэдрическое поле

Энтальпия гидратации ионов [M(H2O)6]2+
Плавная кривая, соединяющая точки. которые соответствуют данным для Ca2+, Mn2+, Zn2+, (ЭСКП = 0) представляет собой кривую ожидаемой зависимости энтальпии гидратации от атомного номера металла без учета эффектов стабилизации кристаллическим полем.
При переходе от Ca2+ к Zn2+ ионные радиусы последовательно уменьшаются и, следовательно, величина энтальпии гидратации должна была бы монотонно становиться все более отрицательной. На эту общую закономерность накладывается ЭСКП. Наибольшее отклонение соответствует ионам с наибольшей ЭСКП с конфигурациями d3 (V2+) и d8 (Ni2+).
Браун, ЛеМей Химия в центре наук
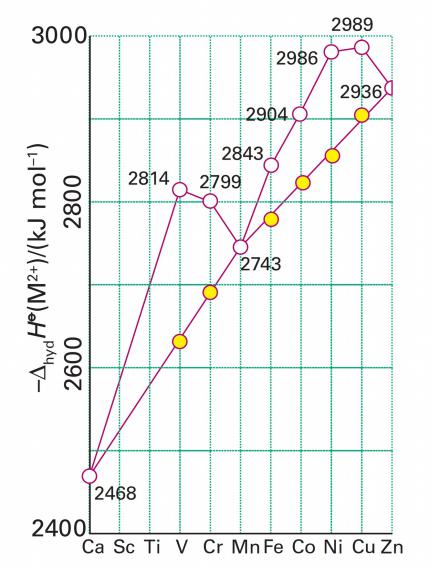
Энтальпия гидратации ионов [M(H2O)6]2+
Shriver and Atkins Inorganic Chemistry, 2010

Энергия кристаллической решетки фторидов (MF2) 3d-металлов
•Катионы металлов в кристаллах фторидов MF2 находятся в слабом октаэдрическом поле лигандов - фторид-ионов. На энергию кристаллической решетки (Uo) фторидов MF2 влияет ЭСКП. Для ионов Ca2+, Mn2+, Zn2+ энергия стабилизации кристаллическим полем равна 0 (ЭСКП = 0), и зависимость Uo от порядкового номера металла – линейная. Наибольшее отклонение значений Uo от линейной зависимости характерно для фторидов ионов с наибольшей ЭСКП с конфигурациями d3 (V2+) и d8 (Ni2+).

Более устойчив

Окраска предмета и поглощение света его поверхностью
C.E. Housecroft, A.G. Sharpe. Inorganic chemistry, 2005

Схема экспериментальной установки для измерения спектра поглощения раствора
Браун, ЛеМей Химия в центре наук

Окраска комплексных соединений
•При облучении образца вещества светом видимой части спектра может наблюдаться:
•отсутствие поглощения света (образец бесцветен)
•полное поглощение света (образец черный)
•поглощение света определенной длины волны (образец имеет цвет, дополнительный к поглощенному).
|
|
Поглощение ( , нм) |
|
|
|
||
495 |
575 |
590 |
625 |
650 |
|
|
|
|
|||||||
|
|
|
760 |
|
|
|
Цвет объекта |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
определяется |
|
|
|
|
|
|
|
частотой полос |
|
|
|
|
|
|
|
поглощения |
|
|
|
|
|
|
|
видимого света |
|
|
|
|
|
|
|
|
|
400 |
440 |
460580 495 |
520 |
|
|
|
|
|
Окраска растворов |
|
|
|
||

Параметр расщепления |
|
= h = h |
c |
= hc |
|
λ |
|||
и волновое число |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
• 1 см–1 соответствует около 12 Дж/моль
: 5000 35000 см–1
Примеры |
: 7800 см–1 |
|
|
Fe2(SO4)3·12H2O |
|
FeSO4·7H2O |
|
|
|
|||||
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
||
[Mn(H2O)6]2+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|||
MnCl2·6H2O |
|
|
|
|
|
|
|
|
|
|
||||
[Fe(H2O)6]2+ : 10400 см–1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
||
[Mn(H2O)6]3+ |
: 21000 см–1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
||
[Fe(H2O)6]3+ : 13700 см–1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Fe(NO3)3·6H2O |
|
FeCl3·6H2O |
|
|
|

d
d
+ h
фиолетовый [Ti(H2O)6]3+
Комплекс иодида титана(III) с карбамидом
Цветность комплексов
Поглощая энергию электромагнитного излучения электрон переходит на выше лежащую свободную орбиталь:
Еизл = hνизл = ∆
d
d
+ h
бесцветный [Cd(H2O)6]2+
•Комплексы c конфигурацией комплексообразователя d0 [Ca(II), Sc(III) и др.] и d10 [Cu(I), Zn(II), Cd(II) и др.]
•не поглощают энергии в видимой области спектра и поэтому бесцветны.
