
- •Комплексные
- •Метод валентных связей
- •Метод валентных связей: связь – донорно-
- •Геометрическая конфигурация комплексов
- •Основные положения теории кристаллического поля (ТКП)
- •Влияние октаэдрического поля лигандов на d–подуровень центрального атома:
- •Расщепление d-подуровня
- •Расщепление d-подуровня
- •Искажение октаэдрического комплекса в
- •Расщепление d-подуровня
- •Факторы, влияющие на величину ∆ - энергии расщепления d-подуровня
- •Влияние числа и пространственной ориентации лигандов на расщепление d-подуровня
- •Влияние природы лигандов
- •Влияние природы лиганда
- •Распределение электронов по d-орбиталям
- •Распределение электронов по d-орбиталям:
- •Сильное поле
- •Лиганды сильного и слабого поля и распределение электронов
- •Распределение электронов (d8)
- •Измерение магнитного момента вещества с помощью весов Гюи.
- •Энергия стабилизации кристаллическим полем (ЭСКП)
- •Энергия стабилизации
- •Зависимость ЭСКП от электронной конфигурации центрального иона
- •Энергия кристаллической решетки фторидов (MF2) 3d-металлов
- •Более устойчив
- •Окраска предмета и поглощение света его поверхностью
- •Схема экспериментальной установки для измерения спектра поглощения раствора
- •Окраска комплексных соединений
- •Параметр расщепления
- •Влияние энергии расщепления d-подуровня на окраску комплекса
- •Параметр расщепления
- •Теория кристаллического поля (ТКП)
- •Литература
Комплексные
соединения. Природа химической связи:
метод валентных связей; теория
кристаллического поля

Метод валентных связей
Браун, ЛеМей Химия в центре наук

Метод валентных связей: связь – донорно-
акцепторная ковалентная полярная, лиганд – донор, комплексообразователь – акцептор пары электронов
L |
|
|
|
|
|
|
|
|
1) |
Лиганд (L) предоставляет пару электронов |
|||
M |
: |
|
|
|
|
|
2) |
Комплексообразователь (M) переходит в |
|||||
|
|
|
|
|
возбужденное состояние, происходит |
||||||||
M* |
гибридизация АО |
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
3) |
Объединение неспареных электронов |
||
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
комплексообразователя и образование |
|||
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
дополнительных вакантных АО происходит |
|||
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
под влиянием лигандов сильного поля |
|||
L |
|
|
|
|
|
|
|
M* |
4) Перекрывание АО пары электронов |
||||
|
|
|
|
|
|
|
|||||||
: |
|
|
|
|
|
|
лиганда и вакантной АО |
|
|||||
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
5) |
Дополнительное дативное -связывание |
||||
Md Lp ; |
|
комплексообразователя и лиганда (L) |
|||||||||||
|
|
|
|
||||||||||
Md Ld |
M |
L |
M |
L |
|||||||||
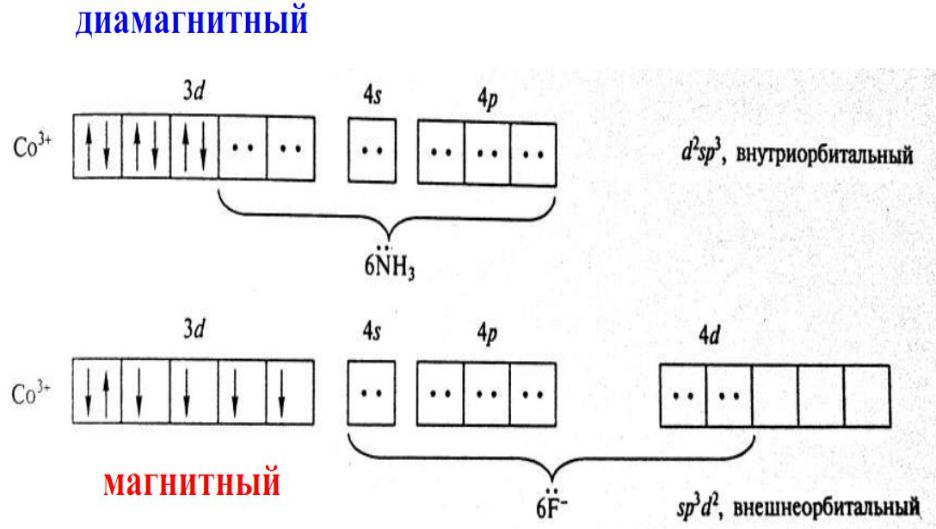
3+ |
3- |
Строение ионов [Co(NH3)6] и [CoF6] по методу валентных связей

Геометрическая конфигурация комплексов
Тип
гибридизации
sp sp2 sp3, sd3
sp2d sp3dz2,dsp3
sp3d(x2 y2), d(x2 y2)sp3
sp3d2, d2sp3 sp3d3
КЧ Геометрическ ая форма
2линейная
3треугольная
4тетраэдричес
кая
4квадрат
5Тригональная
бипирамида
5квадратная
пирамида
6 |
октаэдр |
7 |
пентагональн |
|
ая |
|
бипирамида |
Примеры
[Ag(CN)2] , [Cu(NH3)2]+ [HgI3]
[Be(OH)4]2 , [MnCl4]2 [Ni(CN)4]2 , [PtCl4]2 [Fe(CO)5] [MnCl5]3 , [Ni(CN)5]3
[Al(H2O)6]3+, [Fe(CN)6]3 [V(CN)7]4 , [ZrF7]3
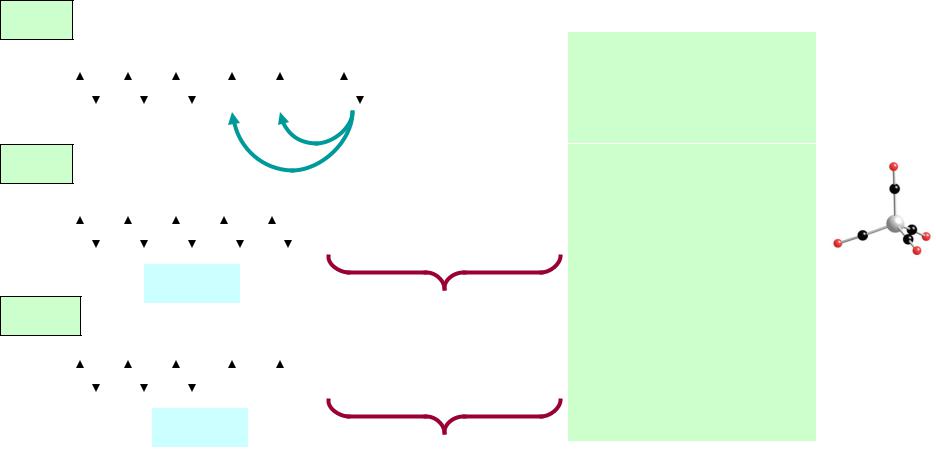
•
Ni0
Ni*
Ni+II
Для атомов комплексообразователей:
E(n 1)d Ens Enp End
Пример: комплексы никеля. Ni0 [Ar] 3d 84s 24p 0
|
|
|
|
|
|
3d 8 |
|
4s 2 |
4p 0 |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3d 10 |
|
4s o |
4p 0 |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
КЧ 4 |
|
|
|
|
sp3-гибр. |
||||||||
|
|
|
|
|
|
3d 8 |
|
4s o |
|
|||||||||
|
|
|
|
|
|
|
4p 0 |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
КЧ 4 |
sp3-гибр. |
|
Атом Ni0 парамагнитен
[Ni(CO)4]
устойчивый,
диамагнитный,
тетраэдрический
[NiBr4]2–
неустойчивый,
парамагнитный,
тетраэдрический
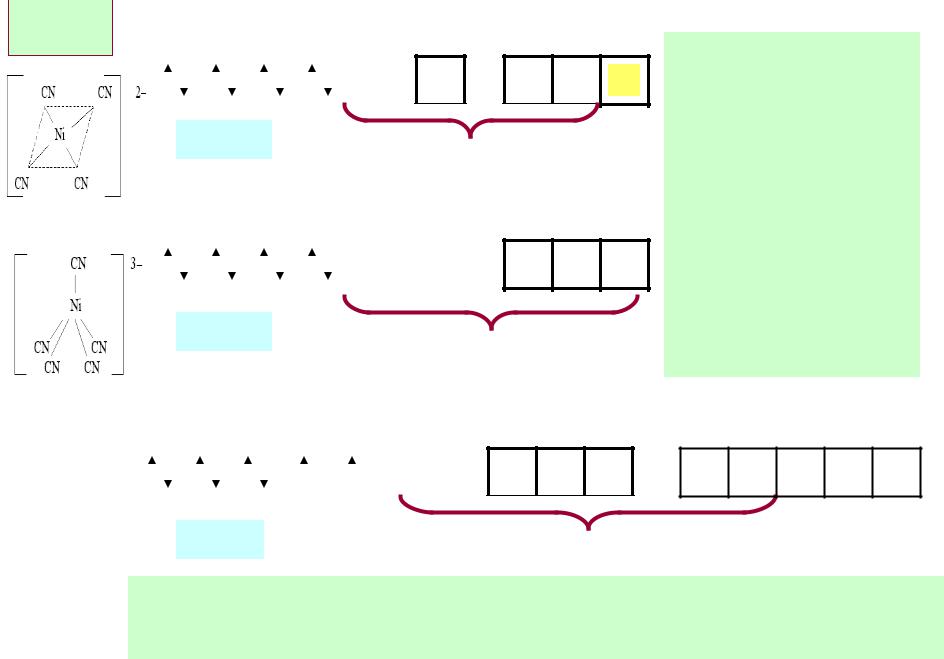
Ni+II |
3d 8 |
4s o |
Ni+II |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
КЧ 4 |
|||||||||||
|
|
|
|
|
|
3d 8 |
|
4s o |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
КЧ 5
|
|
|
|
|
|
3d 8 |
|
4s o |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
КЧ 6
4p 0
dsp2-
гибридизация
4p 0
dsp3-
гибридизация
4p 0
[Ni(CN)4]2–
внутриорбитальный,
диамагнитный, плоско квадратный
[Ni(CN)5]3–
внутриорбитальный,
диамагнитный,
квадратная
пирамида
4d 0
sp3d 2-гибридизация
[Ni(H2O)6]2+, [Ni(NO2)6]4– : внешнеорбитальные, парамагнитные, октаэдр
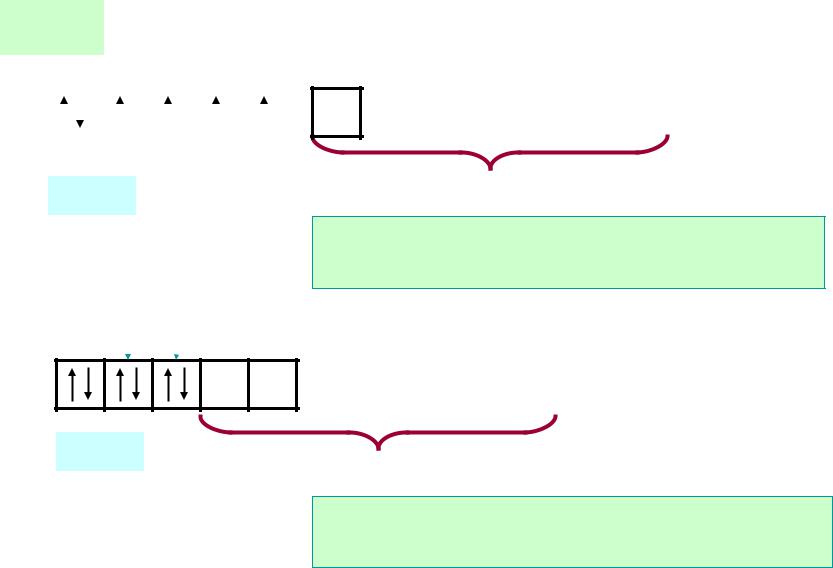
Fe+II |
|
|
3d 6 |
4s o |
4p 0 |
|
|
4d 0 |
|
Fe+II |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
КЧ 6
3d 6 
КЧ 6
sp3d 2-гибридизация
[FeF6]4– внешнеорбитальный, парамагнитный, октаэдр
4s o |
|
4p 0 |
|
|
4d 0 |
|||||
|
|
|
|
|
|
|
|
|
|
|
d 2sp3-гибридизация
[Fe(CN)6]4– внутриорбитальный, диамагнитный, октаэдр


Основные положения теории кристаллического поля (ТКП)
•Связь комплексообразователя (центрального атома) M с лигандами L считается чисто ионной.
•Лиганды L – точечные заряды находятся на максимальном расстоянии друг от друга в вершинах правильных полиэдров.
•Взаимодействие лигандов L между собой не рассматриваются.
•Учитывается влияние электростатического поля лигандов на энергетические подуровни центрального атома: чем ближе d-электроны к лиганду, тем сильнее между ними электростатическое отталкивание, и тем выше энергия d-орбитали
•Взаимодействие комплексообразователя с лигандами рассматривается с учетом особенностей (формы и ориентации в пространстве) d- орбиталей комплексообразователя и распределения электронов на них
