
50
лака» идет медленно, при нагревании окраска появляется быстрее. Обнаружению Al3+ с алюминоном мешают катионы Fe2+, Cr3+, Ca2+, Pb2+,
Mn2+ и некоторые другие. Ионы Fe2+ образуют коричневое соединение, Cr3+, Ca2+ и Pb2+ также как и Al3+ — красного цвета. Мешающие ионы необходимо устранить групповыми реагентами; Ca2+ удаляют из раствора кипячением с (NH4)2CO3 и NH4OH. Для устранения Cr3+ его полностью окисляют до хроматиона, ионы CrO42- открытию Al3+ с алюминоном не мешают.
Обнаружение цинка реакцией с тетрароданогидраргиратом(II)
аммония ((NH4)2[Hg(SCN)4]) основано на соосаждении с солью кобальта (II): и
Zn2+ и Co2+ образуют осадки:
[Hg(SCN)4]2- + Zn2+ → Zn[Hg(SCN)4]↓
белый
[Hg(SCN)4]2- + Co2+ → Co[Hg(SCN)4]↓
синий
Из концентрированных растворов солей кобальта осадок образуется быстро, из очень разбавленных растворов (0,02%) он не должен выпасть даже при перемешивании стеклянной палочкой, так как раствор ненасыщенный. Добавление к нему раствора соли цинка вызывает моментальное выпадение голубого осадка, представляющего собой смешанные кристаллы. Образующийся белый осадок Zn[Hg(SCN)4] ускоряет, как затравка, выпадение синего осадка Co[Hg(SCN)4] и получение смешанных кристаллов.
Обнаружению Zn2+ этой реакцией мешают большие количества соли Co2+, присутствие Fe2+, Fe3+, Ni2+, Cu2+, которые также дают окрашенные осадки с тетрароданогидраргиратом (II) аммония. Их предварительно удаляют, осаждая в виде гидроксидов действием раствора NaOH и перекиси водорода.
Если анализируемый раствор имеет щелочную среду, его подкисляют до рН≈5. К 2-3 каплям (NH4)2[Hg(SCN)4] прибавляют 1 каплю раствора CoCl2 (0,02%) и потирают стеклянной палочкой о стенки пробирки. Следует убедиться, что осадок не образуется. После чего добавляют 1 каплю исследуемого раствора и вновь потирают стеклянной палочкой о стенки пробирки. В присутствии иона Zn2+ быстро выпадет голубой осадок, состоящий из голубого Co[Hg(SCN)4] и белого Zn[Hg(SCN)4].
Контрольные вопросы
1. Какие свойства проявляют амфотерные гидроксиды?
2.Особенности реакции обнаружения Cr3+.
3.Особенности реакции обнаружения Al3+.
4.Особенности реакции обнаружения Zn2+.
Список рекомендуемой литературы
1.Харитонов Ю.Я. Аналитическая химия (аналитика): учебник для вузов.
В2 кн. Кн. 1. Общие теоретические основы. Качественный анализ. – М.:
Высшая школа, 2001. – С. 372-377, 380-383.
2.Основы аналитической химии. Практическое руководство /под ред. акад. Ю.А. Золотова — М.: Высшая школа, 2001. — С. 36-42, 47-49.
51
А.Т.Чанышева, О.Б.Чалова
Лекция 18. Групповые реакции катионов IV аналитической группы. Избирательное растворение
Ключевые слова: IV аналитическая группа, гидроксид, рН начала осаждения, рН полного осаждения, избирательное растворение.
Вчетвёртой гидроксидной группе катионов изучаются ионы Fe2+, Fe3+, Mn2+, Mg2+, Bi3+. Групповыми реагентами являются растворы аммиака или щёлочи, которые осаждают эти ионы в виде гидроксидов, нерастворимых в избытке реактивов. Все гидроксиды IV аналитической группы имеют
основные свойства: Mg(OH)2, Мn(ОН)2, Fe(OH)2 — основания средней силы, Вi(ОН)3 , Fe(OH)3 — очень слабые основания.
Входе анализа катионов IV аналитической группы ионы Fe2+, Fe3+, Mn2+, Bi3+открываются дробно, а Mg2+ — после его дробного избирательного растворения из осадка гидроксидов с дальнейшим отделением и обнаружением.
Осаждение трудно растворимых гидроксидов катионов IV
аналитической группы. Осаждающим ионом является ион ОН−
Men+ + nOH- → Me(OH)n↓
От концентрации ионов ОН− зависит, выпадет ли осадок гидроксида и будет ли осаждение практически полным. Чем более растворим гидроксид, тем большая концентрация ионов ОН− необходима для превышения величины ПР гидроксида, тем большая величина рН потребуется для начала его осаждения. Концентрация ионов ОН− тем больше, чем больше рН раствора.
Осадок гидроксида образуется, если ПК ≥ ПР. Исходя из величины ПР, можно приблизительно вычислить, при каком рН начинается и заканчивается осаждение гидроксида. Вычислим рН начала осаждения и рН полного осаждения для гидроксида магния (ПРMg(OH)2=5·10-12). Если концентрация иона Mg2+ в растворе 1·10-2моль/л, то из уравнения
ПРMg(OH)2 = [Mg2+]·[OH-]2 =5·10-12
можно вычислить концентрацию ионов ОН−, при которой достигается величина ПР и начинается осаждение Mg(OH)2. Она равна
[OH-](начала осаждения) = |
|
ПРMg(OH ) |
2 |
|
|
|
5 10 12 |
|
= 2,2·10−5 моль∕л |
|
= |
|
|
|
|||||
[Mg2 ] |
|
|
0.01 |
|
|||||
Следовательно: рОН = −lg 2,2·10−5 =4,7, а рН(начала осаждения)=14−рОН=14−4,7=9,3.
Осаждение Mg(OH)2 из 0,01 М раствора его соли начинается при рН=9,3. Полным осаждением какого-либо иона можно считать, если
концентрация его в растворе понижается до 10-6 моль/л. Учитывая это, получим
[OH-](полного осаждения)= |
|
ПРMg(OH ) |
2 |
|
|
|
5 10 12 |
|
= 2,2·10−3 моль∕л |
[Mg2 ] |
|
= |
|
10 6 |
|
||||
Следовательно, рОН=2,7 и рН(полного осаждения)=11,3.
Если рН≥11,3, то осаждение Mg2+ будет полным. Наоборот, при рН<11,3
52
— неполным, а при рН<9,3 оно не будет происходить.
Произведя подобные вычисления для менее растворимого Fе(OH)3 (ПР=3,8·10-38), найдем, что осаждение Fе(OH)3 из 0,01М раствора соли железа (III) начинается при рН=2,3 и становится практически полным при рН≥3,5.
В таблице приводятся результаты аналогичных вычислений рН для малорастворимых гидроксидов IV аналитической группы.
|
|
рН начала осаждения при |
рН полного |
||
|
|
концентрации иона, равной |
|||
Гидроксид |
ПР |
осаждения при |
|||
|
|
||||
|
|
1 М |
0,01 М |
[Me2+] = 10-6M |
|
Mg(OH)2 |
5,0·10−12 |
9,4 |
10,4 |
11,3 |
|
Мn(ОН)2 |
4,0·10−14 |
7,8 |
8,8 |
10,4 |
|
Fe(OH)2 |
4,8·10−16 |
6,5 |
7,5 |
9,7 |
|
Вi(ОН)3 |
4,3·10−31 |
3,8 |
4,5 |
5,8 |
|
Fe(OH)3 |
3,8·10−38 |
1,5 |
2,3 |
3,5 |
|
Близкими интервалами значений рН начала и полного осаждения характеризуются гидроксиды Mg(OH)2, Мn(ОН)2, Fe(OH)2, тогда как гидроксиды Вi(ОН)3 , Fe(OH)3 осаждаются полностью даже в кислой среде. Таким образом, контролируя и поддерживая рН можно разделить эти две группы гидроксидов.
Рассмотрим осаждение гидроксидов действием раствора аммиака. Так как
рН 0,1 М раствора NH4OH равен 11,3, то его избыток должен осаждать ионы Mg2+, например
MgCl2 + 2NH4OH → Mg(OH)2 + 2NH4Cl
В результате реакции образуется соль аммония. Для полученной аммиачной (NH4OH+NH4Cl) буферной смеси рН можно вычислить по формуле
рН=14−рК(осн.)+lg(C(осн.)/С(соли)) = 14−4,75+lg(0,1/0,1)= 9,25.
Следовательно при действии аммиачной ([NH4OH]:[NH4Cl] = 1:1) буферной смеси осадок Mg(OH)2 не выпадает, осадки Мn(ОН)2, Fe(OH)2 растворяются частично. Таким образом, для избирательного растворения Mg(OH)2 необходимо устранить мешающие соединения Мn(ОН)2, Fe(OH)2. Для этого их окисляют перекисью водорода до соединений MnO2 и Fe(OH)3:
Мn(ОН)2 + H2O2 → MnO2↓ + 2H2O 2Fe(OH)2 + H2O2 → 2Fe(OH)3↓
Осадки MnO2 и Fe(OH)3 характеризуются очень низкой растворимостью и поэтому не растворяются в аммиачной буферной смеси.
Различным отношением ионов IV аналитической группы к действию аммиачного буферного раствора и соли аммония пользуются для разделения ионов в ходе систематического анализа. Некоторые гидроксиды (Mg(OH)2, Мn(ОН)2, Fe(OH)2) растворяются не только в кислотах, но и в солях аммония, например в насыщенном растворе NH4Cl:
Mg(OH) 2↓ + 2NH4Cl |
|
|
MgCl2 + 2NH4OH |
|
|
|
|||
Mg(OH) 2↓ + 2NH4+ |
|
|
|
Mg2+ + 2NH4OH. |
|
|
|
||

53
Константа равновесия реакции рассчитывается по соотношению
Кравн = |
[Mg 2 ] |
[NH 4OH ]2 |
= |
[Mg 2 ] [NH 4OH ]2 [OH ]2 |
= |
ПРMg (OH )2 |
|||||||
[NH 4 |
|
]2 |
|
[NH 4 ]2 |
[OH ]2 |
(К NH 4OH )2 |
|
||||||
Кравн = |
|
5 10 12 |
|
|
= 1,58·10-2 |
|
|
|
|
|
|||
|
(1,78 10 |
5 |
) |
2 |
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
||
Константа равновесия незначительно меньше единицы, поэтому избыток |
|||||||||||||
соли аммония смещает равновесие вправо. |
|
|
|
|
|||||||||
Гидроксиды Вi(ОН)3, Fe(OH)3 |
и MnO2 |
в насыщенном растворе NH4Cl не |
|||||||||||
растворяются, так как характеризуются очень малыми значениями ПР и
следовательно Кравн << 1, например: |
|
|
|
|||||||||||
Fe(OH) 3↓ + 3NH4+ |
|
|
|
Fe3+ |
+ 3NH4OH. |
|
|
|||||||
|
|
|
|
|
||||||||||
Кравн = |
[Fe3 |
] [NH 4OH ]3 |
= |
[Fe3 |
] [NH 4OH ]3 [OH ]3 |
= |
ПРFe(OH )3 |
|||||||
|
[NH 4 |
|
]3 |
|
|
|
[NH 4 ]3 [OH ]3 |
(К NH 4OH )3 |
||||||
Кравн = |
3,8 |
10 |
38 |
|
|
= 5,64·10-23 << 1 |
|
|
||||||
(1,78 |
10 |
5 |
) |
3 |
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||
К5-6 каплям анализируемого раствора ионов IV аналитической группы
добавляют раствор аммиака до щелочной реакции, затем 3-4 капли перекиси водорода, перемешивают, кипятят около 10 минут до полного окисления Fe2+ и Mn2+, и разложения перекиси, после чего центрифугируют, раствор сливают. Перекись водорода необходимо разложить до прекращения выделения газа, образование которого в ходе центрифугирования препятствует отделению осадка.
Кполученному осадку Mg(OH)2, Вi(ОН)3, MnO2 и Fe(OH)3 добавляют кристаллический хлорид аммония, несколько капель воды, перемешивают и кипятят около 6 минут. В раствор переходят только ионы магния. Центрифугируют, затем в центрифугате открывают магний реакцией с гидрофосфатом натрия. Появление белого осадка указывает на наличие иона магния.
Контрольные вопросы
1.Свойства гидроксидов IV аналитической группы.
2.Расчет рН начала осаждения гидроксида.
3.Расчет рН полного осаждения гидроксида.
4.Для чего и как проводят окисление Fe2+ и Mn2+?
5.Как проводится отделение Mg2+ из смеси гидроксидов IV группы?
Список рекомендуемой литературы
1.Харитонов Ю.Я. Аналитическая химия (аналитика): учебник для вузов.
В2 кн. Кн. 1. Общие теоретические основы. Качественный анализ. – М.: Высшая школа, 2001. – С. 333-335.
2.Жебентяев А.И., Жерносек А.К., Талуть И.Е. Аналитическая химия. Химические методы анализа: учеб. пособие. — 2-е изд., стер. — М.: ИНФРА-М, 2012. – С. 395-397.*

54
А.Т. Чанышева
Лекция 19. Анализ смеси катионов IV аналитической группы. Реакции обнаружения
Ключевые слова: IV аналитическая группа, гидролиз висмута (III), реакции обнаружения катионов железа (II), железа (III), марганца (II), висмута (III), магния.
Все катионы IV аналитической группы в водном растворе подвергаются
гидролизу, особенно сильно гидролизуются Fe3+, Bi3+ -ионы. Среда в растворах солей Fe3+, Bi3+ сильно кислая, в растворах солей Fe2+, Mn2+, Mg2+ — кислая.
Гидролиз солей висмута (III) усиливается при разбавлении и может протекать с образованием осадка, например:
1 |
стадия: Bi3+ + H2O |
|
|
|
|
BiOH2+ + H+ |
|||||||
|
|
|
|
||||||||||
2 |
стадия: BiOH2+ + H2O |
|
|
|
Bi(OH)2+ + H+ |
||||||||
|
|
|
|||||||||||
Гидроксокатионы относительно легко теряют воду с образованием |
|||||||||||||
оксокатионов: Bi(OH)2+ |
|
|
|
BiO+ + H2O |
|||||||||
|
|
||||||||||||
Катион висмутила (III) образует осадок: |
|||||||||||||
BiO+ + Cl- |
|
|
BiOCl↓ |
||||||||||
|
|||||||||||||
Суммарное уравнение реакции: |
|||||||||||||
Bi3+ + H2O + Cl- |
|
|
|
|
|
|
BiOCl↓ + 2H+ |
||||||
|
|
|
|
|
|
||||||||
При разбавлении равновесие смещается в сторону образования осадка BiOCl, в избытке кислоты осадок растворяется.
В основном анализ смеси катионов IV аналитической группы можно провести дробным методом.
Обнаружение катионов Bi3+. Если в смеси присутствует осадок, вероятно BiOCl, то смесь центрифугируют и растворяют осадок в соляной кислоте. Катион Bi3+ открывают двумя реакциями обнаружения.
Восстановление оловом (II) в щелочной среде до металлического висмута. К 2 каплям свежеприготовленного раствора SnCl2 прибавляют по каплям концентрированный раствор NaOH до полного растворения осадка гидроксида олова (II):
SnCl2 + 4NaOH Na2[Sn(OH)4] + 2NaCl
Затем к полученному раствору тетрагидроксостанната (II) прибавляют 1 каплю анализируемого раствора. В присутствии висмута(III) осаждается мелкодисперсный осадок чёрного цвета металлического висмута, нерастворимый в соляной кислоте.
2Bi(NO)3 + 6NaOH +3Na2[Sn(OH)4] |
2Bi0 + 3Na2[Sn(OH)6] + 6NaNO3; |
Реакция с иодидом калия. При |
действии соли Bi3+ на раствор KI |
образуется чёрный осадок BiI3, который растворим в избытке реагента KI с образованием тетрайодовисмутата(III) — комплексных ионов оранжевого
цвета: Bi3+ + 3I- |
BiI3 + I- |
[BiI4]- |
|
Чёрный |
оранжевый |
При сильном разбавлении вместо BiI3 выпадает оранжевый осадок основной соли висмута BiOI.
выпадает оранжевый осадок основной соли висмута BiOI.

55
Реакции обнаружения в виде [BiI4]- мешают катионы Cu2+, Fe3+, которые окисляют йодид-ионы до йода, и они должны быть предварительно отделены.
2Fe3+ + 2I- 2Fe2+ + I2
бурый
Обнаружение катионов Fe2+. Ионы Fe2+ на воздухе окисляются до Fe3+, поэтому дробный анализ начинают с открытия Fe2+. Особенно быстро окисление протекает в щелочной среде:
4Fe(OH)2 + O2 + H2O → 4Fe(OH)3
В отдельной пробе анализируемого раствора открывают Fe2+ гексаницианоферратом (III) калия. Реакция протекает в кислой среде (рН ≈ 2-3) с образованием темно-синего осадка «турнбулевой сини». В щелочной среде осадок разрушается. Первоначально осуществляется окислительно-
восстановительный процесс:
Fe2+ + [FeIII(CN)6]3- → Fe3+ + [FeII(CN)6]4-
Далее протекает ионно-обменная реакция образования осадка:
4Fe3+ + 3[FeII(CN)6]4- → Fe4[FeII(CN)6]3↓
Если концентрация ионов Fe2+ незначительна, образуется синий раствор. Состав осадка может быть описан формулами: Fe4[FeII(CN)6]3 (нерастворимая
форма) и KFe[Fe(CN)6] (коллоидный раствор).
Реакции мешают ионы Mn2+, Zn2+, Co2+, Ni2+, которые образуют с данным реактивом осадки, окрашенные в бурые или жёлтые цвета. В присутствии посторонних ионов образуется смесь осадков. Если осадок не чисто синий, то надо встряхнуть пробирку. В присутствии Fe2+ на стенках пробирки остаются
отдельные частицы синего осадка. Упрощенно уравнение можно составить:
FeSO4 + K3[Fe(CN)6] KFeIII[FeII(CN)6] + K2SO4
Обнаружение катионов Fe3+ гексацианоферратом(II) калия протекает в кислой среде (рН ≈ 2-3) с образованием «берлинской лазури». По составу,
структуре |
и свойствам осадок |
«турнбулевой |
сини» идентичен осадку |
|
«берлинской лазури». |
|
|
|
|
4Fe3+ |
+ 3[FeII(CN)6]4- → Fe4[FeII(CN)6]3↓ |
|
||
Обнаружение катионов Fe3+ |
роданидом калия или аммония |
|||
В отдельной пробе открывают ион Fe3+ избытком роданида (тиоцианата) |
||||
калия. В присутствии |
ионов Fe3+ образуются |
комплексные соединения, |
||
окрашенные в интенсивный красный цвет: |
|
|||
FeCl3 |
+ 6KSCN |
K3[Fe(SCN)6] + 3KCl |
|
|
|
|
Кроваво-красное |
|
|
Реакцию проводят в кислой среде (рН ≈ 3). Роданидные комплексы железа(III) разрушаются при действии фторидов (тартратов, оксалатов, фосфатов) в результате образования более устойчивых бесцветных комплексов. Мешают многие вещества, например восстановители и окислители.
Обнаружение катионов Mn2+ капельной реакцией с бензидином. В
отдельной пробе открывают ион Mn2+: на фильтровальную бумагу наносят каплю анализируемого раствора, каплю 2н NaOH и 2 минуты выдерживают на воздухе. Образующийся Mn(OH)2 окисляется кислородом воздуха, пятно на

56
бумаге буреет: 2Mn(OH)2 + O2 2MnO(OH)2 .
Затем в центр пятна наносят каплю раствора уксусно-кислого бензидина. Соединение MnO(OH)2 окисляет бензидин. В результате пятно синеет, что свидетельствует о присутствии в исходной смеси катиона Mn2+:
C12H8(NH2)2 + MnO(OH)2 + 2CH3COOH C12H8(NH)2 + Mn(CH3COO)2 +3H2O.
Мешают открытию Mn2+ реакцией с бензидином ионы Co2+ (окисляются на воздухе до Co3+) и другие возможные окислители. В присутствии Co2+ щелочную среду создают раствором аммиака с хлоридом аммония, ионы Co2+ связываются в растворимый аммиакатный комплекс, который перемещается из центра на периферию пятна.
Обнаружение катионов Mg2+ с гидрофосфатом натрия Na2HPO4.
Чтобы открыть ион магния, его нужно отделить от всех других ионов (см. лекцию 18). Гидрофосфат натрия образует с солями магния в аммиачном буферном растворе (рН≈9) белый кристаллический осадок ортофосфата магнияаммония.
Mg2+ + HPO42- + NH4OH MgNH4PO4 + H2O
Кристаллизацию следует проводить медленно из первоначально подкисленного раствора и завершая ее после добавления Na2HPO4 и NH4OH при рН≈9. Образуются кристаллы характерной формы в виде звёздочек. Осадок с раствором переносят на предметное стекло и рассматривают под микроскопом.
Форма кристаллов ортофосфата магния-аммония
Если рН 10, то вместо MgNH4PO4 выпадет малохарактерный осадок Mg3(PO4)2 белого цвета.
выпадет малохарактерный осадок Mg3(PO4)2 белого цвета.
Контрольные вопросы
1.Как протекает гидролиз соли Bi3+?
2.Реакции обнаружения Bi3+.
3. Реакции обнаружения Fe2+ Fe3+.
4.Реакции обнаружения Mn2+.
5.Реакции обнаружения Mg2+.
Список рекомендуемой литературы
1.Харитонов Ю.Я. Аналитическая химия (аналитика): учебник для вузов.
В2 кн. Кн. 1. Общие теоретические основы. Качественный анализ. – М.: Высшая школа, 2001. – С. 384-401.
2.Основы аналитической химии. Практическое руководство /под ред. акад. Ю.А. Золотова — М.: Высшая школа, 2001. — С. 23-25, 57-62.

57
А.Т. Чанышева, О.Б. Чалова
Лекция 20. Анализ смеси катионов V аналитической группы
Ключевые слова: V аналитическая группа, аммиакатные комплексы константа нестойкости, маскирование ионов, реакции обнаружения меди(II), кобальта(II), никеля(II).
К V аналитической аммиакатной группе катионов относятся ионы Сu2+, Ni2+, Co2+. Групповым реагентом является избыток раствора аммиака. При этом образуются растворимые в воде аммиакатные комплексы: [Cu(NH3)4]2+, [Ni(NH3)6]2+, [Co(NH3)6]2+. При действии недостатка раствора аммиака первоначально образуются осадки гидроксидов Сu2+, Ni2+, Co2+:
Me2+ + 2NH4OH → Me(OH)2↓ + 2NH4+
В избытке раствора аммиака гидроксиды Сu2+, Ni2+, Co2+ растворяются:
Me(OH)2↓ + 6NH3 → [Me(NH3)6]2+ + 2OH-
Константу равновесия этой реакции можно рассчитать по соотношению
Кравн*= |
[[Me(NH 3 )6 ]2 ] [OH ]2 |
= |
[[Me(NH 3 )6 ]2 ] [OH ]2 [Me2 ] |
= |
|
ПРMe(OH )2 |
|
|
|||||||||
|
[NH 3 ]6 |
|
|
[NH 3 ]6 [Me2 ] |
|
|
К |
нест[ Me( NH 3 )6 ] |
2 |
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
||||||||
Гидроксид |
ПРMe(OH)2 |
|
|
Комплекс |
|
Кнест[Me(NH3)6]2+ |
Кравн * |
||||||||||
Формула |
окраска |
формула |
|
окраска |
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||
Cu(OH)2 |
голубая |
2,2·10-20 |
[Cu(NH3)4]2+ |
|
сине- |
|
9,33·10-13 |
|
|
2,36·10-8 |
|||||||
|
|
|
|
|
|
|
|
фиолетовая |
|
|
|
|
|
|
|
|
|
Ni(OH)2 |
зеленая |
2,0·10-15 |
[Ni(NH3)6]2+ |
|
синяя |
|
1,23·10-8 |
|
|
|
1,63·10-7 |
||||||
Co(OH)2 |
розовая |
6,3·10-15 |
[Co(NH3)6]2+ |
|
желтая |
|
8,81·10-6 |
|
|
|
7,15·10-9 |
||||||
*без учета константы равновесия растворения аммиака в воде
Константы равновесия гораздо меньше единицы, поэтому равновесия можно сместить в сторону образования аммиакатных комплексов только действием избытка концентрированного раствора аммиака. Таким способом катионы V аналитической группы Сu2+, Ni2+, Co2+ отделяются от катионов IV и III групп, за исключением Zn2+, который также образует аммиакатный комплекс. Характерной является окраска образующихся гидроксидов и аммиакатных комплексов, приведенная в таблице.
Соединения Сu2+, Ni2+ на воздухе устойчивы, соединения Co2+ в щелочной среде окисляются кислородом с образованием бурого осадка Co(OH)3, а в среде аммиака — темно-вишневого гексаминкобальта(III) [Co(NH3)6]3+, который устойчив, так как характеризуется очень малой
константой нестойкости Кнест[Co(NH3)6]3+ =6,2·10-36.
Катионы пятой группы при выполнении определенных условий можно открывать дробным методом.
Обнаружение иона никеля (II) с реактивом Чугаева – диметилглиоксимом — проводят капельной реакцией на фильтровальной бумаге. С ионом Ni2+ в аммиачной среде (рН 6-9) образуется характерный аломалиновый осадок внутрикомплексной соли.
На фильтровальную бумагу последовательно наносят по капле раствора
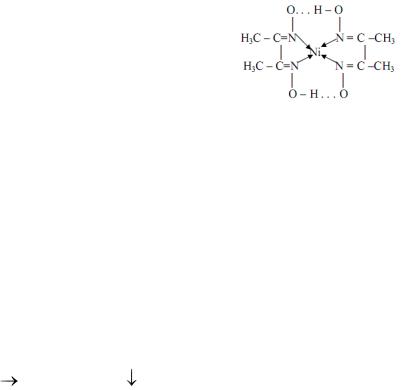
58
гидрофосфата натрия, анализируемого раствора и еще одну каплю раствора гидрофосфата натрия, каплю реактива Чугаева — на периферию пятна. Фильтровальную бумагу с реактивами помещают в пары аммиака над отверстием склянки с концентрированным раствором аммиака.
Роль Na2HPO4 заключается в том, что он связывает все присутствующие катионы в труднорастворимые фосфаты (Сu3(PO4)2, FePO4, Ni3(PO4)2), которые
остаются в центре пятна.
3Me2+ + 4HPO42- → Me3(PO4)2↓ + 2H2PO4-
В парах аммиака более растворимый Ni3(PO4)2 растворяется с образованием комплекса [Ni(NH3)6]2+, который перемещается на периферию пятна, где и открывается диметилглиоксимом по появлению ало-малинового
окрашивания.
Ni3(PO4)2↓ + 18NH3 → 3[Ni(NH3)6]2+ + 2PO43-
2 + [Ni(NH3)6]2+ → 4NH3 + 2NH4+ +
+ [Ni(NH3)6]2+ → 4NH3 + 2NH4+ +
Равновесие смещено в сторону образования более устойчивого хелатного комплекса бис(диметилглиоксимато)никеля(II). В сильнокислой среде (рН ≤ 3) комплекс разрушается, в избытке аммиака осадок заметно растворим.
Открытию никеля с диметилглиоксимом мешают ионы Cu2+, Fe2+, Fe3+. Диметилглиоксим с Fe2+ образует растворимое соединение красного цвета, с ионами Cu2+ — растворимое соединение бурого цвета, ионы Fe3+ образуют бурый осадок. Ионы Cu2+, Fe2+, Fe3+ должны быть отделены от ионов Ni2+, поэтому диметилглиоксим следует наносить только на край, периферию, но не в центр пятна.
Обнаружение иона меди (II) с гексацианоферратом (II) калия
K4[Fe(CN)6]. В присутствии меди (II) с K4[Fe(CN)6] выпадает красно -
коричневый осадок гексацианоферрата (II) меди (II): 2Сu2+ + [Fe(CN)6]4- Cu2[Fe(CN)6] .
Реакцию следует проводить в нейтральной или слабокислой среде (рН≤7). В избытке аммиака осадок Cu2[Fe(CN)6] растворим в результате образования аммиакатного комплекса, а в сильнощелочной среде — разрушается с выпадением осадка Cu(OH)2. Мешают катионы Fe3+, Co2+, Ni2+, образующие окрашенные осадки гексацианоферратов (II).
Обнаружение иона кобальта (II) роданидом калия KSCN. Соль кобальта
(II) при рН≈4-5 с сухим роданидом калия или аммония даёт неустойчивый в
воде комплекс синего цвета:
Co2+ + 4SCN- → [Co(SCN)4]2-.
синий
Образующийся комплекс более устойчив в органическом растворителе — изоамиловом спирте: к 2 каплям соли кобальта (II) добавляют 3-4 капли изоамилового спирта и несколько кристалликов роданида калия, пробирку

59
встряхивают и дают расслоиться жидкости. Верхний (органический) слой окрашивается в синий цвет.
Реакцию можно применять для дробного обнаружения кобальта в смеси с другими катионами. Обнаружению Сo2+ мешают ионы Bi3+, Fe3+ и Cu2+. Ион
Bi3+ с роданидом образует окрашенный в желтый цвет комплекс [Bi(SCN)4]-. Bi3+ + 4SCN- → [Bi(SCN)4]-
желтый
Однако желтый комплекс [Bi(SCN)4]- не извлекается изоамиловым спиртом. При совместном присутствии Co2+ и Bi3+ нижний водный слой окрашивается в желтый цвет, а верхний слой изоамилового спирта — в синий.
При взаимодействии раствора содержащего одновременно ионы Fe3+, Cu2+; Co2+, с роданидом калия или аммония образуются интенсивно окрашенные соединения, которые скрывают голубую окраску комплекса
[Co(SCN)4]2-:
Fe3+ + 6SCN- → [Fe(SCN)6]3-
кроваво-красное
Cu2+ + 2SCN- → Cu(SCN)2↓
черный
Cu(SCN)2↓ + 2SCN- → [Cu(SCN)4]2-
желто-бурое
Для обнаружения Co2+ прибегают к маскировке мешающих ионов. Роданид железа можно замаскировать прибавлением NaF или NH4F, а роданид меди обесцветить восстановлением сухой солью Na2SO3. После прибавления к раствору KSCN (или NH4SCN) в присутствии Fe3+ он приобретает кровавокрасную окраску. В раствор прибавляют несколько кристаллов NH4F (или NaF),
до обесцвечивания роданидного комплекса Fe3+
+ 6F- → [FeF6]3- + 6SCN-
Кроваво-красный |
бесцветный |
||
Затем добавляют Na2SO3 |
для восстановления соединений Cu2+ в Cu+, и |
||
изменения черной окраски Cu(SCN)2 |
в белый цвет осадка CuSCN. |
||
2Cu(SCN)2 |
+ Na2SO3 + H2O |
2CuSCN + Na2SO4 + 2HSCN |
|
чёрный |
сухой |
|
белый |
После чего можно наблюдать остающееся синее окрашивание комплексного иона [Co(SCN)4]2-.
Контрольные вопросы
1.Действие группового реагента на катионы V аналитической группы.
2.Особенности реакции обнаружения Ni2+.
3.Особенности реакции обнаружения Cu2+.
4.Особенности реакции обнаружения Co2+.
Список рекомендуемой литературы
1.Харитонов Ю.Я. Аналитическая химия (аналитика): учебник для вузов.
В2 кн. Кн. 1. Общие теоретические основы. Качественный анализ. – М.: Высшая школа, 2001. – С. 402-417.
2.Основы аналитической химии. Практическое руководство /под ред. акад. Ю.А. Золотова — М.: Высшая школа, 2001. — С. 62-67.
