
- •Раздел 2. Кинетика простой необратимой реакции
- •Раздел 3. Кинетика реакции n-го порядка
- •Лекция 3. Кинетика обратимой реакции
- •Раздел 1. Кинетическая модель обратимой реакции в общем виде
- •Раздел 2. Кинетика обратимой реакции а r
- •Лекция 4. Кинетика параллельной реакции
- •Раздел 1. Кинетическая модель параллельной реакции в общем виде
- •Раздел 2. Кинетика параллельной реакции а s
- •Раздел 3. Селективность параллельной реакции а
Лекция 3. Кинетика обратимой реакции
Раздел 1. Кинетическая модель обратимой реакции в общем виде
Рассмотрим обратимую гомогенную реакцию:
νАА + νВВ νRR + νSS
Скорость изменения количества любого j–го компонента Wj, участвующего в обратимой реакции, выражается соотношением:
![]()
где νj – стехиометрический коэффициент при j–м компоненте («+» для продукта реакции, «–» для исходного вещества). Скорость обратимой реакции, определяемая по ЗДМ, равна разности скоростей прямой и обратимой реакций:
![]()
![]() –скорость прямой
реакции,
–скорость прямой
реакции,
![]() –скорость обратной
реакции.
–скорость обратной
реакции.
![]()
где E+, E– – энергия активации прямой и обратной реакций; k+, k– – константы скорости прямой и обратной реакций.
Тогда для обратимой реакции:
 (3.1)
(3.1)
Уравнения (3.1) образуют систему уравнений кинетической модели обратимой реакции.
Решим эту систему для гомогенной обратимой реакции типа А R.
Раздел 2. Кинетика обратимой реакции а r
Зададимся начальными условиями:
T,V = const;
С А
= САо
при τ
= 0
А
= САо
при τ
= 0
СR = СRо =0
Если V = const, то скорость реакции:
![]() (3.2)
(3.2)
![]() (3.3)
(3.3)
Составим кинетическую модель рассматриваемой реакции:
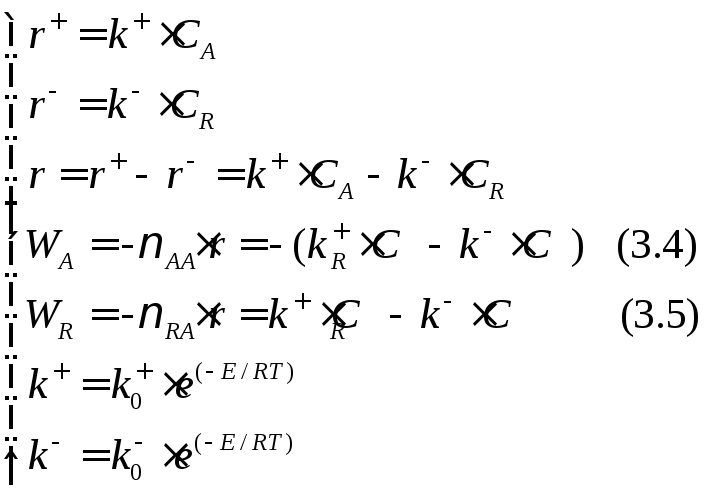
Сопоставим выражения (3.2) и (3.4), (3.3) и (3.5):
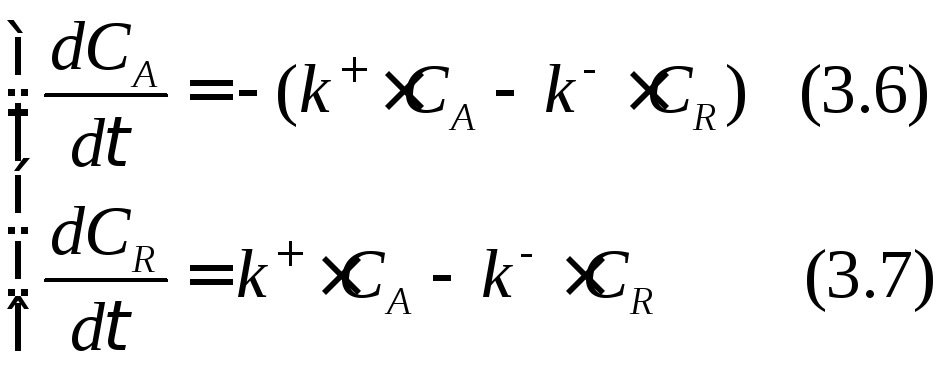
Определим изменение концентрации реагента А в ходе реакции.
Так как для нашей реакции νА= νR=1, то САо = СА + СR. Тогда СR = САо – СА. Подставим это выражение в уравнение (3.6):
![]()
![]() (3.7)
(3.7)
В состоянии
равновесия
![]() и тогда выражение (3.7) примет вид:
и тогда выражение (3.7) примет вид:
![]() (3.8)
(3.8)
где С*А – равновесная концентрация реагента А. Она является постоянной величиной для данной реакции при заданной температуре и давлении.
Подставим выражение (3.8) в (3.7):
![]()
![]()
Разделим переменные, интегрируем от САо до СА и от 0 до τ :

![]()

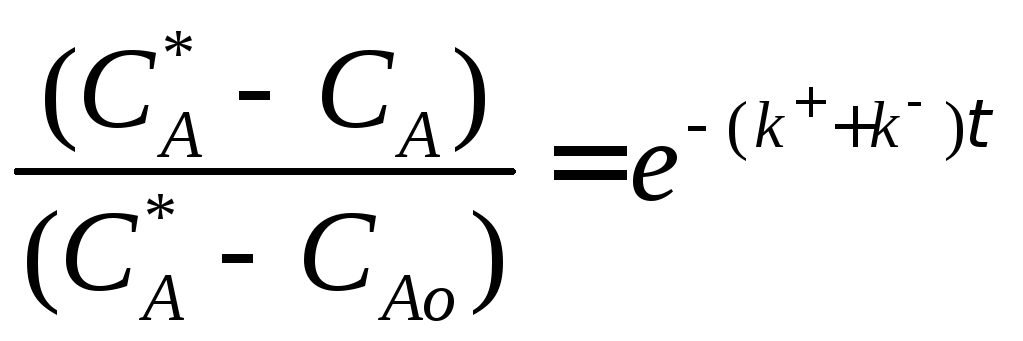
![]() (3.9)
(3.9)
Выражение (3.9) представляет искомую зависимость СА = f(τ).
Изменение концентрации вещества R можно получить из уравнения материального баланса:
![]() (3.10)
(3.10)
Выражение (3.9) представляет искомую зависимость СR = f(τ).
Получим
зависимость степени превращения для
данной обратимой реакции.
Вспомним, что
![]() .
Тогда:
.
Тогда:
![]() (3.11)
(3.11)
Кроме того,известно,
что
![]() .
Тогда из материального баланса:
.
Тогда из материального баланса:
СR = САо – СА = САо – САо(1– xA) = САо xА (3.12)
Подставим выражения (3.11) и (3.12) в выражение (3.6):
![]()
![]()
![]() (3.13)
(3.13)
В состоянии
равновесия
![]() .
Тогда выражение (3.13) примет вид:
.
Тогда выражение (3.13) примет вид:
![]() (3.14)
(3.14)
где хА* – равновесная степень превращения вещества А. Это величина постоянная для данной реакции при заданной температуре и давлении.
Подставим выражение (3.14) в (3.13)
![]()
![]()
Разделим переменные, интегрируем от 0 до хА и от 0 до τ :

![]()
![]()

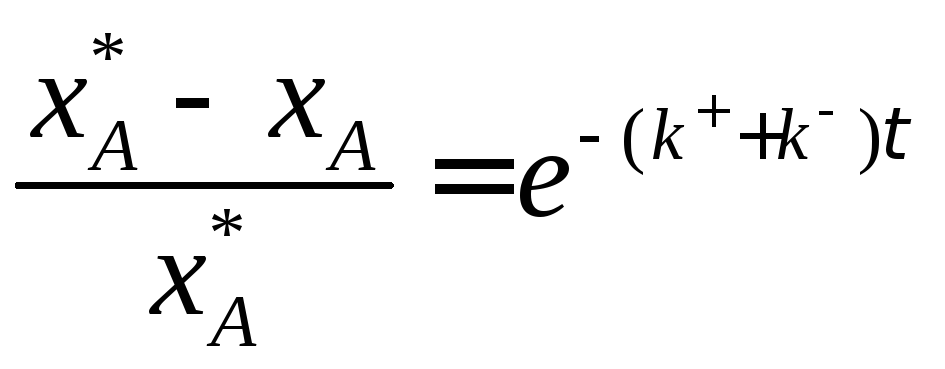
![]() (3.15)
(3.15)
Выражение (3.15) представляет искомую зависимость xА = f(τ).
Изобразим графически зависимости СА, СR, хА = f(τ) для обратимой реакции.
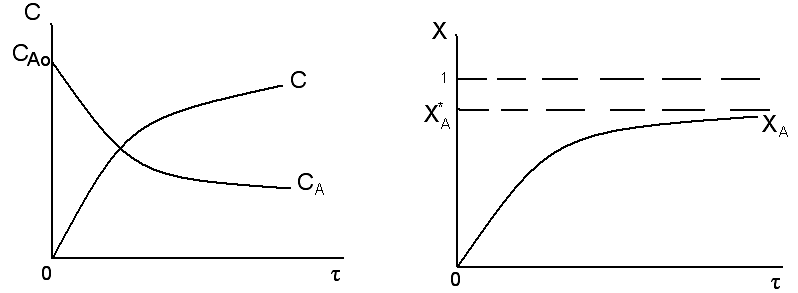 Из представленного
следует, что для рассматриваемой
обратимой реакции, концентрация реагента
А уменьшается в ходе реакции по
экспоненциальной зависимости. Но в
отличие от необратимой реакции
концентрация реагента с течением времени
стремится не к нулю, а к некому равновесному
значению
СА*,
которое отлично от нуля. Концентрация
продукта R экспоненциально возрастает,
но в отличие от необратимой реакции не
достигает большого значения, а стремится
к некому равновесному значению
СR*.
Степень превращения реагента
экспоненциально возрастает и стремится,
в отличие от необратимой реакции к некой
равновесной степени превращения
хА*,
которая всегда меньше единицы.
Из представленного
следует, что для рассматриваемой
обратимой реакции, концентрация реагента
А уменьшается в ходе реакции по
экспоненциальной зависимости. Но в
отличие от необратимой реакции
концентрация реагента с течением времени
стремится не к нулю, а к некому равновесному
значению
СА*,
которое отлично от нуля. Концентрация
продукта R экспоненциально возрастает,
но в отличие от необратимой реакции не
достигает большого значения, а стремится
к некому равновесному значению
СR*.
Степень превращения реагента
экспоненциально возрастает и стремится,
в отличие от необратимой реакции к некой
равновесной степени превращения
хА*,
которая всегда меньше единицы.
