
- •Билет 1.
- •Билет 2.
- •Билет 3.
- •Билет 4.
- •Билет 5.
- •Билет 6.
- •Билет 7.
- •Билет 8.
- •Подгруппа кислорода: строение и свойства атомов, простых веществ, химические свойства серы.
- •Билет 9.
- •Билет 10.
- •Расставьте коэффициенты в схемах реакций методом электронного баланса. Укажите окислитель и восстановитель, процессы окисления и восстановления.
- •Билет 11.
- •Билет 12.
- •Билет 13.
- •Билет 14.
- •Билет 15.
- •Билет 16.
- •Билет 17.
- •Билет 18.
- •Билет 19.
- •Билет 20.
- •Билет 21.
- •Билет 22.
- •Билет 23.
- •Билет 24.
- •Билет 25.
- •3. Расставьте коэффициенты в схемах реакций методом электронного баланса. Укажите окислитель и восстановитель, процессы окисления и восстановления.
- •Билет 26.
Билет 1.
Основные химические понятия (на примере любой химической формулы).
5Н2О
Сложное вещество – состоит из разных химических элементов.
5 (коэффициент) молекул сложного вещества.
Качественный состав сложного вещества – состоит из водорода и кислорода.
Количественный состав 1 молекулы: 2 атома Н и один атом О; 5 молекул: 10 атомов Н и 5 атомов О.
Молярная масса М (Н2О) = 1*2 + 16 = 18 г/моль
Масса 5 молекул m (Н2О) = 5 * 18 = 90 г
Массовая доля водорода в молекуле: w =
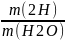 =
=
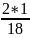 = 0, 3333 (33,33%)
= 0, 3333 (33,33%)
Подгруппа кислорода: строение и свойства атомов, простых веществ, химические свойства серы.
Элементы подгруппы кислорода — кислород О, сера S, селен Se, теллур Те, полонии Ро — имеют общее название «халькогены», что означает «рождающие руды».
Строение и свойства атомов.
Атомы серы, как и атомы кислорода и всех остальных элементов главной подгруппы VI группы Периодической системы Д. И. Менделеева, содержат на внешнем энергетическом уровне 6 электронов, из которых 2 электрона неспаренные.
Простые вещества. Аллотропия кислорода – это простые вещества кислород О2 и озон О3.
Для серы, как и для кислорода, характерна аллотропия. Это ромбическая и пластическая сера.
Химические свойства. Сера может быть и окислителем и восстановителем.
1. По отношению к восстановителям - водороду, металлам сера проявляет окислительные свойства и приобретает степень окисления -2. При обычных условиях сера реагирует со всеми щелочными и щелочноземельными металлами, медью, ртутью, серебром, например:
0 0 +2-2
Hg + S = HgS.
Н2 + S = H2S↑.
2. Однако по сравнению с кислородом и фтором сера является восстановителем, образуя соединения со степенью окисления +4, +6.
Сера горит синеватым пламенем, образуя оксид серы (IV):
S + О2 = SО2.
Это соединение широко известно под названием сернистый газ.
3. Расставьте коэффициенты в схемах реакций методом электронного баланса. Укажите окислитель и восстановитель, процессы окисления и восстановления.
Са + N2 Ca3N2
Сu + Н2SO4(конц) CuSO4+ SO2+ H2O
При подготовке к экзамену решение см. в лабораторном журнале - практическая работа № 2.
Билет 2.
Открытие Д.И. Менделеевым Периодического закона. Периодическая система химических элементов.
Д. И. Менделеев расположил все известные ко времени открытия Периодического закона химические элементы в ряд, по возрастанию их атомных масс и отметил в нем отрезки — периоды, в которых свойства элементов и образованных ими веществ изменялись сходным образом, а именно (в современных терминах):
металлические свойства ослабевали;
неметаллические свойства усиливались;
степень окисления элемента в высших оксидах увеличивалась с +1 до +7;
оксиды от основных через амфотерные сменялись кислотными;
гидроксиды от щелочей через амфотерные гидроксиды сменялись все более сильными кислотами.
На основании этих наблюдений Д. И. Менделеев в 1869 г. сделал вывод — сформулировал Периодический закон:
свойства химических элементов и образованных ими веществ находятся в периодической зависимости от их атомных весов. В современной формулировке атомные массы элементов заменены на заряд ядра.
Подгруппа углерода: строение и свойства атомов углерода, простых веществ, образованных углеродом, химические свойства углерода.
Подгруппа углерода (4 группа А) – углерод, кремний, германий, олово, свинец.
Углерод С — первый элемент главной подгруппы IV группы Периодической системы Д. И. Менделеева. Его атомы содержат на внешнем энергетическом уровне 4 электрона, поэтому они могут принимать четыре электрона, приобретая при этом степень окисления -4, т. е. проявлять окислительные свойства и отдавать свои электроны более электроотрицательным элементам, т. е. проявлять восстановительные свойства, приобретая при этом степень окисления +4.
Углерод — простое вещество. Углерод образует аллотропные модификации — алмаз и графит. Сходное с графитом строение имеют сажа и древесный уголь. Уголь благодаря своей пористой поверхности обладает способностью поглощать газы и растворенные вещества. Такое свойство некоторых веществ называется адсорбцией.
Химические свойства углерода.
Алмаз и графит соединяются с кислородом при очень высокой температуре. Сажа и уголь взаимодействуют с кислородом гораздо легче, сгорая в нем. Но в любом случае результат такого взаимодействия один — образуется углекислый газ:
С + O2 = СO2
С металлами углерод при нагревании образует карбиды, например:
4Аl + 3С = Аl4С3
Докажите с помощью характерной реакции наличие иона карбоната в карбонате натрия.
CO32-+ H+ (любая кислота) CO2 +H2O
Выделяется тяжелый бесцветный газ, который гасит горящую спичку.
