
- •Содержание
- •Вспомогательные материалы по самоподготовке: Правила техники безопасности.
- •Правила работы в химической лаборатории
- •Условные обозначения и формулы для расчетов, применяемые в курсе медицинской химии
- •Лабораторная работа: “Физико-химические методы исследования растворов. Приготовление растворов”.
- •Зависимость показателя преломления (n) и плотности раствора ()
- •2. Выполнить тестовые задания (письменно):
- •3. Ситуационные задачи:
- •3. Задачи для самостоятельного решения (выполнить письменно):
- •4. Тематика рефератов по учебно-исследовательской работе студентов (уирс).
- •Вспомогательные материалы по самоподготовке:
- •Титриметрический анализ делится на:
- •Лабораторная работа №1: «Качественные реакции на отдельные ионы и вещества».
- •Ход работы:
- •2. Ситуационные задачи:
- •3. Выполнить тестовые задания (письменно):
- •4. Задачи для самостоятельного решения (выполнить письменно):
- •Лабораторная работа №1: „Зависимость скорости химической реакции от концентрации реагирующих веществ”.
- •Ход работы:
- •1. Вопросы для обсуждения:
- •Выполнить тестовые задания (письменно):
- •5. Тематика рефератов по учебно-исcледовательской работе студентов (уирс)
- •Ход работы:
- •Лабораторная работа №2: «Окислительно-восстановительное титрование. Йодометрия».
- •Ход работы:
- •1. Вопросы для обсуждения:
- •Ситуационные задачи:
- •Решение:
- •3. Решить самостоятельно:
- •Тематика рефератов по учебно-исследовательской работе студентов (уирс).
- •Лабораторная работа: «Влияние различных факторов на растворимость веществ в воде. Свойства растворов электролитов».
- •1. Влияние температуры на растворимость солей.
- •2. Тепловые эффекты, вызываемые растворением электролитов.
- •3. Осаждение труднорастворимых солей.
- •Биологических жидкостей».
- •1. Вопросы для обсуждения:
- •Ситуационные задачи:
- •3. Задачи для самостоятельного решения (выполнить письменно):
- •4.Тематика рефератов по учебно-исследовательской работе студентов (уирс):
- •Лабораторная работа: «Гидролиз солей. Свойства буферных растворов».
- •1. Вопросы для обсуждения:
- •3. Тематика рефератов по учебно-исследовательской работе студентов (уирс).
- •4. Вспомогательные материалы по самоподготовке:
- •Лабораторная работа №1: «Адсорбция из раствора».
- •Лабораторная работа №2: «Разделение смеси ионов меди и железа с помощью бумажной хроматографии».
- •2. Ситуационные задачи:
- •4. Задания для самостоятельного решения (выполнить письменно):
- •5. Тематика рефератов по учебно-исследовательской работе студентов (уирс).
- •Лабораторная работа: “Получение, очистка и свойства коллоидных растворов”.
- •1. Вопросы для обсуждения:
- •Эталон решения
- •Эталон решения
- •Задания для самостоятельного решения (выполнить письменно):
- •(Трилонометрии)».
- •Ход работы
- •1. Вопросы для обсуждения:
- •2. Выполнить тестовые задания(письменно):
- •3. Задачи для самостоятельного решения (выполнить письменно):
- •Лабораторная работа: «Химические свойства макроэлементов и микроэлементов».
- •Справочные материалы
- •Стандартные термодинамические функции некоторых органических соединений
- •Стандартные термодинамические функции некоторых веществ при 298 к
- •Важнейшие кислотно–основные индикаторы
- •Произведения растворимости некоторых труднорастворимых веществ.
- •Константы ионизации кислот при 25 c
- •Константы ионизации сильных кислот при 25 c
- •Константы ионизации оснований при 25 c
- •Константы нестойкости комплексных ионов в водных растворах при 25с
- •Список рекомендуемой литературы:
2. Ситуационные задачи:
К 250 мл 0,001 М раствора BaCl2 добавили 50 мл 0,1 М Na2SO4 раствора.
а) Написать мицеллярную формулу;
б) Определить, какой из перечисленных электролитов вызовет коагуляцию этого золя с наименьшим порогом коагуляции: KCl, NаBr, LiNO3?
Решение:
а) BaCl2 + Na2SO4 → BaSO4 + 2NaCl
Определяем, какой из растворов находится в избытке:
(BaCl2) = CVр-ра = 0,0010,25 = 2,510-4 моль
(Na2SO4) = CVр-ра = 0,10,05 = 510-3 моль В избытке Na2SO4.
Мицеллярная формула гидрофобного золя:
BaCl2 + Na2SO4 (изб.) → BaSO4 + 2NaCl
мицелла
 |
|
|
|
потенциалопределяющие
ионы
 | |
| |
{[BaSO4] m ∙ n SO42-∙2(n-x) Na+}2x- 2x Na+
| | | | | |
агрегат адсорбционный диффузионный слой
| | слой противоионов противоионов
ядро
| |
гранула
б) Т.к. гранула имеет отрицательный заряд, то по правилу Шульце-Гарди коагуляцию этого золя будут вызывать катионы сильных электролитов. Поэтому наибольшим коагулирующим действием обладает KCl, т.к. при одинаковом заряде +1, имеет наибольший радиус в ряду Li – Na – K.
Пороги коагуляции некоторого золя электролитами KNO3, MgCl2, NaBr равны соответственно 50,0; 0,8; 49,0 ммоль/л. Рассчитать коагулирующую способность электролитов. Как относятся между собой величины коагулирующих способностей этих веществ? Указать коагулирующие ионы. Определить заряд коллоидной частицы?
Решение: Коагулирующее действие () - величина, обратная порогу коагуляции.
![]()
![]()
![]()
MgCl2 обладает наибольшим коагулирующим действием. Согласно правилу Шульце-Гарди: коагуляцию коллоидных растворов вызывают ионы, знак заряда которых противоположен знаку заряда гранулы. Коагулирующее действие тем сильнее, чем выше заряд иона-коагулянта ( = f(z6) – коагулирующее действие иона-коагулянта пропорционально его заряду в шестой степени):
(Na+) ׃ (Na+) ׃ (Mg2+) = 0,0204 ׃ 0,02 ׃ 1,25 = 1 ׃ 1 ׃ 62,5
Так как анионы во всех данных электролитах однозарядны, то ионами-коагулянтами являются катионы, а следовательно, заряд коллоидной частицы – отрицательный.
К 4 л золя гидроксида железа (III) добавили 0,92 мл 10%-ного раствора сульфата магния (плотность 1,1 г/мл), при этом произошло помутнение раствора. Рассчитать порог коагуляции золя сульфат ионами.
Решение:
Определяем массу MgSO4,
вызвавшего коагуляцию, и его количество:
![]()
![]()
ν (SO42-) = ν (MgSO4) = 8,310-4 моль.
Определяем порог коагуляции по формуле:
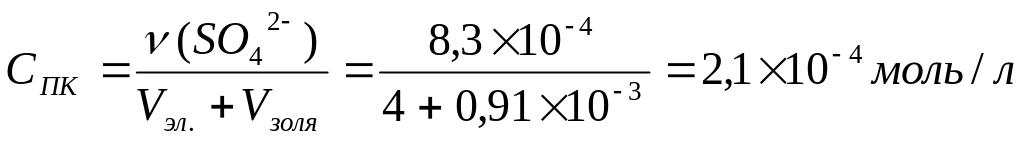
3. Выполнить тестовые задания (письменно):
1 |
|
Золь серы получен при смешивании спиртового раствора серы с избытком воды. Какой метод получения коллоидного раствора был использован? |
|
А |
Химическая конденсация |
|
Б |
Пептизация |
|
В |
Метод замены растворителя |
|
Г |
Механическое диспергирование |
|
|
|
2 |
|
Согласно правила Панетта-Фаянса, на поверхности кристаллического твердого адсорбента из раствора адсорбируется тот ион, который: |
|
А |
Входит в состав кристаллической решетки адсорбента |
|
Б |
Не входит в состав кристаллической решетки адсорбента |
|
В |
Образует с одним из ионов решетки труднорастворимое соединение |
|
Г |
Образует с одним из ионов решетки хорошо растворимое соединение |
|
|
|
3 |
|
Указать ион, формирующий потенциалопределяющий слой мицеллы гидрофобного золя: CuCl2 + K2S (избыток) → |
|
А |
S2- |
|
Б |
K+ |
|
В |
Cu2+ |
|
Г |
Cl- |
|
|
|
4 |
|
Указать ядро мицеллы гидрофобного золя: CaCl2(избыток) + Na2CO3 → |
|
А |
[(CaCO3)m, nCl-] |
|
Б |
[(Na2CO3)m, nCl-] |
|
В |
[(CaCO3)m, nCa2+] |
|
Г |
[(CaCl2)m, nCa2+] |
|
|
|
5 |
|
Указать наиболее эффективный метод очистки водного коллоидного раствора крахмала от примесей BaSO4. |
|
А |
Диализ |
|
Б |
Электродиализ |
|
В |
Ультрафильтрация |
|
Г |
Фильтрация |
|
|
|
6 |
|
Указать наиболее эффективный метод очистки коллоидного раствора белка от примесей глюкозы. |
|
А |
Диализ |
|
Б |
Электродиализ |
|
В |
Ультрафильтрация |
|
Г |
Фильтрация |
|
|
|
7 |
|
Указать наиболее эффективный метод очистки коллоидного раствора белка от примеси (NH4)2SO4. |
|
А |
Диализ; |
|
Б |
Электродиализ; |
|
В |
Ультрафильтрация |
|
Г |
Фильтрация |
|
|
|
8 |
|
Метод очистки крови от токсичных низкомолекулярных веществ: |
|
А |
Фильтрация |
|
Б |
Центрифугирование |
|
В |
Гемодиализ |
|
Г |
Электродиализ |
|
|
|
9 |
|
Образование светящегося конуса при прохождении света через коллоидный раствор (эффект Тиндаля) является результатом |
|
А |
Поглощения света коллоидными частицами |
|
Б |
Рассеяния света молекулами дисперсионной среды |
|
В |
Рассеяния света коллоидными частицами |
|
Г |
Поглощения света молекулами дисперсионной среды |
|
|
|
10 |
|
Какое из свойств коллоидных растворов не относится к молекулярно-кинетическим: |
|
А |
Броуновское движение |
|
Б |
Коагуляция |
|
В |
Осмотическое давление |
|
Г |
Седиментация |
|
|
|
11 |
|
Электрокинетический потенциал – это потенциал возникающий на: |
|
А |
Границе мицеллы и воды |
|
Б |
Границе между диффузным и адсорбционным слоем |
|
В |
Границе между ядром и потенциалопределяющими ионами |
|
Г |
Поверхности электродов, опущенных в раствор коллоида |
|
|
|
12 |
|
Электрофорез – это: |
|
А |
Движение гранул через полупроницаемую мембрану |
|
Б |
Движение дисперсионной среды относительно неподвижной дисперсной фазы |
|
В |
Движение частиц дисперсной фазы в электрическом поле |
|
Г |
Движение мицелл под действием электрического тока |
|
|
|
13 |
|
Электроосмос – это: |
|
А |
Движение частиц дисперсной фазы в электрическом поле |
|
Б |
Движение мицелл под действием электрического тока |
|
В |
Движение гранул через полупроницаемую мембрану |
|
Г |
Движение дисперсионной среды относительно неподвижной дисперсной фазы |
14 |
|
Седиментационная устойчивость коллоидных растворов – это |
|
А |
Способность коллоидных частиц сохранять дисперсность |
|
Б |
Свойство коллоидных частиц не оседать под действием силы тяжести |
|
В |
Устойчивость коллоидных растворов при добавлении ВМС |
|
Г |
Необратимая агрегация дисперсной фазы |
|
|
|
15 |
|
Агрегативная устойчивость коллоидных растворов – это |
|
А |
Необратимая агрегация дисперсной фазы |
|
Б |
Способность коллоидных частиц сохранять дисперсность |
|
В |
Устойчивость коллоидных растворов при добавлении ВМС |
|
Г |
Свойство коллоидных частиц не оседать под действием силы тяжести |
|
|
|
16 |
|
Коагуляция коллоидных частиц - это |
|
А |
Свойство коллоидных частиц не оседать под действием силы тяжести |
|
Б |
Механическое диспергирование дисперсной фазы |
|
В |
Необратимая агрегация дисперсной фазы |
|
Г |
Способность коллоидных частиц сохранять дисперсность |
|
|
|
17 |
|
Минимальная концентрация электролита, при которой начинается коагуляция, называется: |
|
А |
Коагулирующей способностью |
|
Б |
Потенциалом течения |
|
В |
Коллоидной защитой |
|
Г |
Порогом коагуляции |
|
|
|
18 |
|
Какой ион обладает большим коагулирующим действием на коллоидный раствор с отрицательно заряженной гранулой: |
|
А |
Вa2+ |
|
Б |
SO42- |
|
В |
PO43- |
|
Г |
Ca2+ |
|
|
|
19 |
|
Какой ион обладает большим коагулирующим действием на коллоидный раствор с положительно заряженной гранулой: |
|
А |
Na+ |
|
Б |
SO42- |
|
В |
PO43- |
|
Г |
Ca2+ |
|
|
|
20 |
|
Коллоидной защитой называется повышение агрегативной устойчивости золя: |
|
А |
При введении неиндифферентного электролита |
|
Б |
Увеличением степени дисперсности коллоидных частиц |
|
В |
При введении индифферентного электролита |
|
Г |
При введении высокомолекулярного соединения (ВМС) |
