
- •Содержание
- •Вспомогательные материалы по самоподготовке: Правила техники безопасности.
- •Правила работы в химической лаборатории
- •Условные обозначения и формулы для расчетов, применяемые в курсе медицинской химии
- •Лабораторная работа: “Физико-химические методы исследования растворов. Приготовление растворов”.
- •Зависимость показателя преломления (n) и плотности раствора ()
- •2. Выполнить тестовые задания (письменно):
- •3. Ситуационные задачи:
- •3. Задачи для самостоятельного решения (выполнить письменно):
- •4. Тематика рефератов по учебно-исследовательской работе студентов (уирс).
- •Вспомогательные материалы по самоподготовке:
- •Титриметрический анализ делится на:
- •Лабораторная работа №1: «Качественные реакции на отдельные ионы и вещества».
- •Ход работы:
- •2. Ситуационные задачи:
- •3. Выполнить тестовые задания (письменно):
- •4. Задачи для самостоятельного решения (выполнить письменно):
- •Лабораторная работа №1: „Зависимость скорости химической реакции от концентрации реагирующих веществ”.
- •Ход работы:
- •1. Вопросы для обсуждения:
- •Выполнить тестовые задания (письменно):
- •5. Тематика рефератов по учебно-исcледовательской работе студентов (уирс)
- •Ход работы:
- •Лабораторная работа №2: «Окислительно-восстановительное титрование. Йодометрия».
- •Ход работы:
- •1. Вопросы для обсуждения:
- •Ситуационные задачи:
- •Решение:
- •3. Решить самостоятельно:
- •Тематика рефератов по учебно-исследовательской работе студентов (уирс).
- •Лабораторная работа: «Влияние различных факторов на растворимость веществ в воде. Свойства растворов электролитов».
- •1. Влияние температуры на растворимость солей.
- •2. Тепловые эффекты, вызываемые растворением электролитов.
- •3. Осаждение труднорастворимых солей.
- •Биологических жидкостей».
- •1. Вопросы для обсуждения:
- •Ситуационные задачи:
- •3. Задачи для самостоятельного решения (выполнить письменно):
- •4.Тематика рефератов по учебно-исследовательской работе студентов (уирс):
- •Лабораторная работа: «Гидролиз солей. Свойства буферных растворов».
- •1. Вопросы для обсуждения:
- •3. Тематика рефератов по учебно-исследовательской работе студентов (уирс).
- •4. Вспомогательные материалы по самоподготовке:
- •Лабораторная работа №1: «Адсорбция из раствора».
- •Лабораторная работа №2: «Разделение смеси ионов меди и железа с помощью бумажной хроматографии».
- •2. Ситуационные задачи:
- •4. Задания для самостоятельного решения (выполнить письменно):
- •5. Тематика рефератов по учебно-исследовательской работе студентов (уирс).
- •Лабораторная работа: “Получение, очистка и свойства коллоидных растворов”.
- •1. Вопросы для обсуждения:
- •Эталон решения
- •Эталон решения
- •Задания для самостоятельного решения (выполнить письменно):
- •(Трилонометрии)».
- •Ход работы
- •1. Вопросы для обсуждения:
- •2. Выполнить тестовые задания(письменно):
- •3. Задачи для самостоятельного решения (выполнить письменно):
- •Лабораторная работа: «Химические свойства макроэлементов и микроэлементов».
- •Справочные материалы
- •Стандартные термодинамические функции некоторых органических соединений
- •Стандартные термодинамические функции некоторых веществ при 298 к
- •Важнейшие кислотно–основные индикаторы
- •Произведения растворимости некоторых труднорастворимых веществ.
- •Константы ионизации кислот при 25 c
- •Константы ионизации сильных кислот при 25 c
- •Константы ионизации оснований при 25 c
- •Константы нестойкости комплексных ионов в водных растворах при 25с
- •Список рекомендуемой литературы:
Лабораторная работа №1: «Адсорбция из раствора».
Ход работы:
Внести на кончике стеклянного шпателя несколько кристалликов фуксина в 2 химических стаканах (50-100 мл).
Добавить в каждый стакан по 10 мл дистиллированной воды.
Полученный раствор в первом стакане оставить для сравнения, а раствор во 2 стакане отфильтровать.
В отфильтрованный раствор второго стакана добавить примерно 2 г активированного угля, интенсивно перемешать, оставить на 5 мин.
Раствор с активированным углем отфильтровать.
Сделать вывод.
Лабораторная работа №2: «Разделение смеси ионов меди и железа с помощью бумажной хроматографии».
Ход работы:
Из хроматографической бумаги вырезать полоску шириной 2-3 см и длиной 8-10 см. На расстоянии 1 см от нижнего края провести карандашом тонкую линию (старт), а на расстоянии 6 см от старта 2-ю линию (линия фронта). В центре линии старта с помощью капилляра нанести раствор, содержащий смесь катионов меди и железа. Диаметр пятна не должен превышать 3-4 мм. Рядом нанести растворы “свидетелей”, раствор CuCl2 и раствор FeCl3. Бумагу высушить на воздухе. Подготовленную полоску хроматографической бумаги опустить в стакан с дистиллированной водой и закрепить. Слой воды в стакане должен быть равным 0,5 см, глубина погружения полоски бумаги 2-3 мм. После пропитывания водой бумаги до линии фронта, полоску вынуть из стакана и высушить на воздухе. Для обнаружения разделенных зон катионов, полоску смочить раствором К4[Fe(CN)6] в чашке Петри. Хроматограмму высушить. Отметить число зон. Измерить расстояние от линии старта до центра каждой зоны Lcu2+ и LFe3+ .
Для каждой зоны
рассчитать значение Rf
, как отношение расстояния от линии
старта до ее центра к расстоянию от
линии старта до линии фронта (L):
![]() ,
,
![]()
1

1 - фильтровальная бумага 2 - линия фронта 3 - линия старта
Рис. 1 Хроматографическое разделение смеси ионов меди и железа методом распределительной хроматографии на бумаге.

 1
1
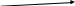 2
2
 3
3
Рис. 2 Камера для хроматографирования на бумаге.
1 – стеклянные зажимы
2 – хроматографическая бумага с нанесенными «точками» солей и смеси солей
3 – стакан с водой
Занятие № 9 Тема: «Коллоидные растворы: получение, очистка и свойства. Коагуляция коллоидных растворов. Коллоидная защита».
1. Вопросы для обсуждения:
Классификация дисперсных систем.
Методы получения и очистки коллоидных растворов. Гемодиализ, применение в медицине.
Строение мицеллы гидрофобного коллоидного раствора. Виды потенциалов: термодинамический () и электрокинетический ().
Свойства коллоидных растворов:
а) оптические свойства (светорассеяние, поглощение света). Эффект Тиндаля;
б) молекулярно-кинетические свойства (броуновское движение, диффузия, осмос, седиментация);
в) электрокинетические свойства (электрофорез, электроосмос, потенциалы течения и оседания).
Виды устойчивости и факторы устойчивости коллоидных растворов. Коагуляция. Правило Шульце-Гарди.
Применение коллоидных растворов в медицине. Коллоидная защита.
Высокомолекулярные соединения. Биополимеры. Классификация и особенности строения и свойств ВМС.
Грубо- и коллоиднодисперсные системы. Эмульсии. Полуколлоиды. Мыла. Порошки. Суспензии. Гели, их структура, свойства.
