- •Зайцев ю.В., Мирошниченко а.Ю., Холодный д.С. Материалы и элементы электронной техники (физика процессов, строение и электрические характеристики)
- •Введение
- •1. Структура и строение материалов
- •1.1. Основные кристаллические структуры
- •1.2. Структуры бинарных соединений типа ав
- •1.3. Эффективные радиусы ионов и атомов
- •1.4. Геометрические пределы устойчивости структур с различными координационными числами
- •2. Процессы поляризации, диэлектрические потери
- •2.1. Комплексная диэлектрическая проницаемость
- •2.2. Уравнение электрического поля для изотропной среды
- •2.3. Электронная поляризация
- •2.4. Атомная и ионная поляризация
- •2.5. Ориентационная поляризация
- •2.6. Комплексная диэлектрическая проницаемость и уравнения Максвелла
- •2.7. Релаксационные потери
- •2.8. Физическая сущность диэлектрических потерь
- •3. Виды поляризация диэлектриков и диэлектрические потери
- •3.1. Виды поляризации
- •3.2. Простейшие схемы замещения диэлектриков с потерями
- •3.4. Тепловые виды поляризации
- •Зависимость от температуры параметров, описывающих тепловую поляризацию
- •Диаграмма коул-коула
- •3.4. Механизмы упругой поляризации.
- •3.5. Решеточное поглощение и отражение
- •4. Представление диэлектриков с помощью эквивалентных схем
- •4.1. Двух- и трех- элементные эквивалентные схемы
- •Входные характеристики
- •4.3. Схемы замещения реальных элементов электрических цепей
- •4.4. Поверхностная и объёмная поляризация
- •4.4. Измерение ε и tgδ
- •5. Классическая теория проводимости металлов
- •5.1. Основные предположения проводимости по теории Друде
- •5.2. Статическая электропроводность металла
- •6. Теория электропроводности Зоммерфельда
- •6.1. Распределения Максвелла − Больцмана и Ферми − Дирака
- •6.2. Свойства электронного газа в основном состоянии
- •6.2.1. Электрон как волна
- •6.2.2. Математическое описание волн
- •6.2.3. Уравнение Шредингера и волновая функция
- •7. Электропроводность диэлектриков и полупроводников
- •7.1. Электропроводность диэлектрических и полупроводниковых материалов
- •7.2. Диэлектрические керамические материалы
- •7.2.1. Алюминия оксид
- •7.2.2. Нанокристаллические материалы
- •7.2.3. Применение наноразмерных сегнетоэлектрических материалов
- •7.2.4. Пористая пьезокерамика
- •7.3. Полупроводниковые материалы
- •7.3.1. Типы полупроводников
- •7.4.2. Методы роста
- •7.5. Ионная проводимость
- •7.5.1. Диффузия ионов в электрическом поле
- •7.6. Зонная теория твердого тела
- •7.6.1. Стационарное уравнение Шредингера
- •7.6.2. Электрон в бесконечно глубокой потенциальной яме
- •7.6.3. Структула энергетических зон
- •7.6.4. Адиабатическое приближение и валентная аппроксимация
- •7.6.5. Одноэлектронное приближение
- •7.6.6. Трансляционная симметрия зон Бриллюэна
- •7.7. Колебания кристаллической решетки. Фононы
- •7.8. Теплоемкость твердых тел
- •8. Плёночные резисторы и конденсаторы
- •8.1.Конструкции и основные характеристики резисторов
- •8.2.Основные характеристики резисторов
- •8.3. Обозначения и маркировка резисторов
- •8.4. Специальные виды резисторов.
- •8.5. Конденсаторы
- •8.5.1. Конденсаторы с оксидным диэлектриком
- •8.5.2. Конденсаторы с органическим диэлектриком
- •8.6. Области использования конденсаторов
- •9. Коррозионная стойкость металлов
- •9.1. Виды коррозионных процессов
- •9.2. Физика процессов коррозии металлов
- •9.3. Образование продуктов окисления на поверхности металла
- •9.4. Основные стадии коррозии металлов
- •9.5. Адсорбция газов на поверхности металлов
- •9.6. Адсорбция кислорода на поверхности металла и образование оксида
- •9.7. Плёнки на поверхности металлов
- •9.8. Кинетика газовой коррозии металлов
- •9.9. Линейный закон роста плёнок
- •9.10. Параболический закон роста пленок
- •9.11. Сложные законы роста пленок
- •9.12. Оксидные пленки на поверхности металла
- •9.13. Механизм химической коррозии
- •9.14. Влияние внутренних и внешних факторов на скорость газовой коррозии
- •9.14.1. Влияние состава плёнки
- •9.14.2. Влияние температуры
- •9.14.3. Влияние давления и состава газа
- •9.15. Теории жаростойкого легирования
- •10. Металлические сплавы
- •10.1. Образование сплавов
- •10.2. Строение сплавов
- •10.3. Твердые растворы
- •10.4. Строение и свойства железоуглеродистых сплавов
- •10.5. Строение и свойства железа
- •10.6. Компоненты и фазы в сплавах системы (железо−углерод)
- •11. Магнитные материалы
- •11.1. Магнитные свойства твердых тел
- •11.1.1. Диамагнетики
- •11.1.2. Парамагнетизм
- •11.1.3. Ферромагнетики. Антиферромагнетики
- •1 ‒ Распределение в изолированных атомах; 2 ‒ распределение при обобществлении электронов.
- •11.2. Доменная структура
- •11.3. Намагничивание
- •11.4. Магнитострикция и термострикция
- •11.5. Ферримагнетизм. Ферриты
- •11.6. Процесс намагничивания.
- •11.6.1 Движение доменной стенки
- •11.6.2. Взаимодействие намагниченности с магнитным полем
- •11.6.3. Динамические эффекты процесса намагничивания
- •11.6.4. Перминвар - эффект
- •11.6.5. Магнитное последействие
- •11.7. Частотная зависимость магнитной проницаемости
- •Литература
1. Структура и строение материалов
1.1. Основные кристаллические структуры
Электрофизические, теплофизические и физико − механические свойства твердых тел в значительной степени обусловлены характером сил взаимодействия между атомами. В соответствии с природой этих сил различают молекулярные, атомные, ионные и металлические кристаллы. Все механизмы связи обусловлены силами электрического притяжения и отталкивания, типы и силы связи зависят от конкретного строения электронных оболочек взаимодействующих атомов [4].
Тип кристаллов определяется характером связей; в металлических кристаллах, как правило, реализуется металлическая связь, в ковалентных − ковалентная, ионных − ионная, молекулярных связь между атомами ‒ силами Ван−дер−Ваальса. Металлические кристаллы отличаются от остальных большим количеством свободных электронов, что существенно влияет на все их свойства. Ионные кристаллы являются тугоплавкими диэлектриками. Ковалентные кристаллы − диэлектрики и полупроводники, к ним относятся и органические вещества. Молекулярные кристаллы − летучие вещества, сжиженные газы.
В твердом состоянии энергия взаимодействия частиц, образующих вещество, значительно превышает энергию их теплового движения. Такими частицами являются атомы, ионы или молекулы, которые расположены либо в геометрически правильном порядке, образуя кристаллическое тело, либо хаотически, в беспорядке, образуя аморфное тело.
В кристаллическом теле наблюдается как ближний, так и дальний порядок расположения частиц, т.е. частицы размещаются в пространстве на определенном расстоянии друг от друга в геометрически правильном порядке, образуя кристалл. В кристалле сформирована пространственная кристаллическая решетка. Многократно повторяющимся элементом решетки является элементарная (кристаллографическая) ячейка, вершины которой называют узлами, а расстояние между двумя соседними узлами − периодом или постоянной решетки (рис. 1.1) [5,6].
Каждое вещество имеет кристаллы определенной формы, которая отражает их внутреннее строение. Форма кристаллов определяется величиной периодов а, b, с и осевых углов α, β, γ (см. рис. 1.1, табл. 1.1).

Рис. 1.1. Схематическое строение кристаллической решётки
Раскалываются кристаллы легче по определенным плоскостям, называемым плоскостями спайности.
В зависимости от того, какие частицы (атомы, ионы или молекулы) находятся в узлах решетки, различают следующие типы кристаллических структур: атомные, металлические, ионные и молекулярные. Характерная особенность кристаллических тел − анизотропия их свойств, которая значительно проявляется у монокристаллов.
Монокристалл − это огромное число одинаково ориентированных элементарных ячеек, т.е. это большой одиночный кристалл. В природе некоторые минералы встречаются в виде монокристаллов. Однако большинство кристаллических веществ являются поликристаллическими. Они состоят из множества сросшихся мелких кристаллов, не имеющих одинаковой ориентации (рис. 1.2), и поэтому проявляют изотропность физических свойств.
При кристаллизации, первоначально зародившиеся кристаллы небольшого размера сталкиваются друг с другом и теряют правильную геометрическую форму. Такие кристаллы называют кристаллическими зернами, просто зернами или кристаллитами. Они малы и в обычных металлах их можно увидеть только в микроскоп [4].
Таблица 1.1.
Формы ячеек пространственных решеток семи кристаллографических систем
-
Кристаллическая система






Кубическая
a=b=c,
α=β=γ=90°
Тетрагональная
a=b≠с,
α=β=γ=90°
Ромбическая
(орторомбическая)
a≠b≠с≠а,
α=β=γ=90°
Моноклинная
a≠b≠с≠а
α=γ=90°, β≠90°
Кристаллическая система
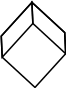



Ромбоэдрическая
(тригональная)
a=b=c,
α=β=γ≠90°
Гексагональная
a=b≠с
α=β=90°, γ=120°
Триклинная
a≠b≠с
α≠β≠γ≠α
Геометрически возможны четырнадцать различных пространственных решеток, которые называются решетками Бравэ, табл. 1.3, образующих шесть кристаллографических систем (или семь сингоний, если ромбоэдрическую систему выделить отдельно).
Таблица 1.2.
Кристаллографические системы и пространственные решетки
№ |
Кристаллическая система |
№ |
Пространственная решетка, Решетка Бравэ |
Соотношение между осевыми углами и осевыми единицами |
1 |
Кубическая |
1 |
Простая |
a=b=c, α=β=γ=90° |
2 |
Объемноцентрированная (ОЦК) |
|||
3 |
Гранецентрированная (ГЦК) |
|||
2 |
Тетрагональная |
4 |
Простая |
a=b≠с, α=β=γ=90° |
5 |
Объемноцентрированная (ОЦК) |
|||
3 |
Ромбическая (орторомбическая) |
6 |
Простая |
a≠b≠с≠а, α=β=γ=90° |
7 |
Базоцентрированная |
|||
8 |
Объемноцентрированная (ОЦК) |
|||
9 |
Гранецентрированная (ГЦК) |
|||
4 |
Гексагональная |
10 |
Простая |
a=b≠с α=β=90°, γ=120° |
11 |
Ромбоэдрическая |
|||
5 |
Моноклинная |
12 |
Простая |
a≠b≠с≠а α=γ=90°, β≠90° |
13 |
Базоцентрированная |
|||
6 |
Триклинная |
14 |
Простая |
a≠b≠с α≠β≠γ≠α |
Таблица 1.3.
Решетки Браве [4,8]
1 |
|
2 |
|
3 |
|
4 |
|
5 |
|
6 |
|
Текстурирование − это некоторая упорядоченность в ориентации кристаллических зерен, достигаемая специальной обработкой (например, прокаткой) поликристаллических материалов. Некоторые вещества находятся в аморфнокристаллическом состоянии, т. е. в них сосуществуют две фазы: аморфная и кристаллическая. Такое строение имеют многие полимеры, ситаллы (стекла специального состава) и др.

Рис. 1.2. Схематическое строение поликристаллического материала
Отметим, что одной из первых
структур, определенных методом
рентгеновского анализа, была структура
меди [7]. Исследования показали, что в
структуре меди решетка Бравэ является
гранецентрированной кубической. Длина
ребра куба
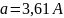 (Ангстрем) (1 А=10─10
м) На одну элементарную ячейку приходится
четыре атома. Поскольку число узлов в
кубической гранецентрированный ячейке
тоже равно четырем, то единственным
возможным расположением атомов меди в
кристаллической структуре будет
расположение их по узлам решетки (рис.
1.3).
(Ангстрем) (1 А=10─10
м) На одну элементарную ячейку приходится
четыре атома. Поскольку число узлов в
кубической гранецентрированный ячейке
тоже равно четырем, то единственным
возможным расположением атомов меди в
кристаллической структуре будет
расположение их по узлам решетки (рис.
1.3).

Рис. 1.3. Структура меди
|
Рис. 1.4. Структура альфа железа
|

Рис. 1.5. Структура магния Mg в виде полной гексагональной ячейки и выделенная в ней примитивная ячейка
Аналогичную структуру имеют
и другие металлы, например
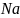 (a
= 4,28 А),
(a
= 4,28 А),
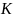 (а = 5,33 А),
(а = 5,33 А),
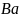 (а = 5,01 А),
(а = 5,01 А),
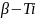 (a
= 3,32 A)
и т.д. Структура
показана на рис.1.4 [7].
(a
= 3,32 A)
и т.д. Структура
показана на рис.1.4 [7].
Третьей важнейшей структурой
будет структура
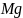 (рис. 1.5). Ячейка магния гексагональная;
а = 3,20А,
с = 5,20А. На каждую ячейку приходится
шесть атомов: три располагаются в
вершинах и в центре базисных граней и
три − в центрах тех трех (из шести)
тригональных призм, на которые можно
мысленно разбить гексагональную ячейку
(рис. 1.5). При
этом «заселенные» и «пустые» призмы
чередуются между собой. Поэтому часто
структуры гексагональных кристаллов
изображают не полной гексагональной
ячейкой, а примитивным параллелепипедом,
составляющим одну треть ее (рис. 1.5).
(рис. 1.5). Ячейка магния гексагональная;
а = 3,20А,
с = 5,20А. На каждую ячейку приходится
шесть атомов: три располагаются в
вершинах и в центре базисных граней и
три − в центрах тех трех (из шести)
тригональных призм, на которые можно
мысленно разбить гексагональную ячейку
(рис. 1.5). При
этом «заселенные» и «пустые» призмы
чередуются между собой. Поэтому часто
структуры гексагональных кристаллов
изображают не полной гексагональной
ячейкой, а примитивным параллелепипедом,
составляющим одну треть ее (рис. 1.5).
Отметим, что выбор начала координат в структуре в известной мере произволен, поэтому структуру магния можно себе представить иначе, если придать исходному атому магния координаты не (000), как показано на рисунке, а (1/з 2/з 1/4), как это обычно принято [7].
Аналогичную структуру имеют
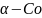 (а = 2,51 А; с =
4,07 А),
(а = 2,51 А; с =
4,07 А),
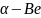 (а = 2,28 А; с=3,58
А) и т.д. Итак, под структурой
кристалла мы понимаем
конкретное пространственное расположение
материальных частиц. Если нас интересуют
не абсолютные межатомные расстояния,
а лишь относительное расположение
атомов или атомных групп в кристаллах,
то мы говорим о структурном
типе. В структурном
типе меди кристаллизуются, кроме золота,
серебро, γ−железо и
многие другие простые
вещества. Все эти структуры одинаковы
с точностью до подобия. Однако это имеет
место только для простейших структур
кристаллов кубической сингонии. В
структурных типах других сингоний
сохранение подобия параллелепипедов
повторяемости не обязательно, а
обязательным является сохранение
симметрии.
(а = 2,28 А; с=3,58
А) и т.д. Итак, под структурой
кристалла мы понимаем
конкретное пространственное расположение
материальных частиц. Если нас интересуют
не абсолютные межатомные расстояния,
а лишь относительное расположение
атомов или атомных групп в кристаллах,
то мы говорим о структурном
типе. В структурном
типе меди кристаллизуются, кроме золота,
серебро, γ−железо и
многие другие простые
вещества. Все эти структуры одинаковы
с точностью до подобия. Однако это имеет
место только для простейших структур
кристаллов кубической сингонии. В
структурных типах других сингоний
сохранение подобия параллелепипедов
повторяемости не обязательно, а
обязательным является сохранение
симметрии.
Остановимся на структурах алмаза и графита − характерных для ряда материалов, широко используемых в электронике. Структура алмаза изображена на рис. 1.6. В таком кристалле атомы расположены в тетраэдрическом окружении.

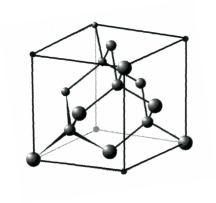
Рис. 1.6 Структура алмаза
В элементарной кубической ячейке алмаза располагаются восемь атомов. Половина из них (4 атома) занимает узлы гранецентрированной кубической решетки (ГЦК), а вторая половина (4 атома) располагается в центрах четырех октантов (из восьми). По каждому координатному направлению «заселенные» октанты равномерно чередуются в структуре с «незаселенными» [7].