
- •Оглавление
- •Введенние
- •1 Способы получения металлорганических соединений
- •2 Органические производные металлов первой группы
- •2.1 Литийорганические соединения
- •2.2 Натрий- и калийорганические соединения
- •3 Органические производные металлов второй группы
- •3.1 Магнийорганические соединения
- •3.2 Цинкорганические соединения
- •3.3 Ртутьорганические соединения
- •4 Органические производные металлов третьей группы
- •4.1 Борорганические соединения
- •4.1.1 Способы получения борорганических соединений
- •4.1.2 Бороновые кислоты
- •4.2 Алюминийорганические соединения
- •5 Органические производные металлов четвёртой группы
- •5.1 Кремнийорганические соединения
- •5.1.1 Углерод и кремний. Физические и химические эффекты, связанные с заменой в органической молекуле углерода кремнием
- •5.1.2 Химические свойства связей атомов кремния и углерода с другими элементами
- •5.1.3 Способы получения органических производных кремния
- •5.1.4 Кремнийорганические полимеры
- •5.1.5 Биологическая активность кремнийорганических соединений
- •5.1.6 Метаболизм кремнийорганических соединений
- •5.2 Оловоорганические соединения
- •5.3 Органические производные свинца
- •6 Органические производные металлов пятой группы
- •6.1 Мышьякорганические соединения
- •Заключение
- •Литература
4.1.2 Бороновые кислоты
В природе борорганические соединения не обнаружены, но они легко получаются из эфиров борной кислоты, которые образуются при этерификации этой кислоты спиртами. Бороновые кислоты и их эфиры малотоксичны для теплокровных, с ними легко работать в лаборатории и в крупномасштабных производствах, а их медленное автоокисление с образованием в конце концов не наносящей вреда живым системам и окружающей среде борной кислоты делает их «зелёными» химическими соединениями.
Атом бора в бороновых кислотах соединён с одним атомом углерода и с двумя гидроксильными группами. В соответствии с этим он находится в состоянии гибридизации sp2 и имеет вакантную р-орбиталь. Это электронное окружение атома бора делает бороновые кислоты слабыми кислотами Льюиса с мягким профилем реакционной способности. Образуя координационные связи с молекулами со свойствами оснований, атом бора приобретает характерную для атома углерода тетраэдрическую структуру. Несмотря на присутствие двух гидроксильных групп, кислотный характер функциональной группы бороновой кислоты обусловлен не диссоциацией по типу оксикислоты (кислоты Бренстеда) с диссоциацией на протон и анион, а по типу кислоты Льюиса в соответствии с уравнением:

Понятно, что отрицательный заряд на боронатном анионе распределён с участием трёх атомов кислорода.
Бороновые кислоты представляют собой кристаллические вещества. Теряя воду они образуют В–О–В-связи и превращаются в олигомерные соединения, например, в циклические шестичленные бороксины:

Однако это практически не сказывается на превращениях бороновых кислот, когда они используются, например, в реакции Сузуки (см. с. 47). На воздухе входящие в состав бороновых кислот органические остатки окисляются, а катализаторами окислительных превращений могут быть ангидриды бороновых кислот. Поэтому их лучше хранить в инертной атмосфере или во влажном состоянии, когда атом бора в результате взаимодействия с молекулой воды переходит в тетракоординированное состояние (см. выше) и не может больше активировать молекулу кислорода. При этом следует отметить, что арилбороновые кислоты значительно более устойчивы к действию кислорода воздуха, чем алкилбороновые кислоты. Лёгкость превращения бороновых кислот в ангидриды осложняет их выделение и идентификацию по температурам плавления. В соответствии с этим чаще всего бороновые кислоты используют в виде их эфиров. Важно также, что бороновые кислоты не диспропорционируют, например, на борную и бориновую кислоты, даже при нагревании.
Связь атома бора с атомом углерода достаточно устойчива к гидролизу. В частности, при кипячении п-толилбороновой кислоты в воде в течение 28 ч не обнаруживается даже следов её гидролитического превращения и только нагревание под давлением при температуре около 150 °С обеспечивает полное разложение толилбороновой кислоты водой на толуол и борную кислоту. Достаточно устойчивы арилбороновые кислоты и к действию сильных кислот. Так, например, 4‑карбоксифенилбороновую кислоту можно нитровать смесью концентрированных серной и азотной кислот с сохранением боруглеродной связи.
Для получения арилбороновых кислот, которые широко используются в реакциях кросс-сочетания для получения бифенильных и винильных соединений, разработано множество способов. Однако чаще всего их синтезируют действием магний- или литийорганических соединений на триэфиры борной кислоты, если, конечно, заместители в ароматическом ядре не мешают получению соответствующего реактива Гриньяра. При добавлении триметилбората к фенилмагнийбромиду при температуре –15 °С выход диметилового эфира фенилбороновой кислоты оказывается очень низким из-за того, что на фенильный остаток замещаются и другие метоксигруппы с образованием эфира дифенилбориновой кислоты и трифенилборана:


С хорошим выходом по диэфиру фенилбороновой кислоты протекает реакция фенилмагнийбромида с трибутилборатом при температуре –70 °С с прибавлением реактива Гриньяра к раствору эфира борной кислоты. В этом случае побочная реакция с замещением второй и третьей алкоксильной группы сводится к минимуму из-за того, что образующаяся в качестве промежуточного продукта триалкоксифенилборатная соль выпадает в осадок и при низкой температуре не диссоциирует на дибутилфенилборонат и алкоголят:

После повышения температуры реакционной массы до температуры окружающей среды её обрабатывают разбавленной минеральной кислотой и выделяют образовавшуюся в результате гидролиза эфира фенилбороновую кислоту. Правда, многие бороновые кислоты растворимы в воде даже при низких значениях рН, поэтому для уменьшения потерь при выделении лучше получать их в виде эфиров, обрабатывая полученную при взаимодействии бората с реактивом Гриньяра реакционную массу безводным хлористым водородом или каким-либо хлорангидридом (например, ацетилхлоридом).
Для получения арилбороновых кислот может быть также использовано протекающее в присутствии оснований при катализе хлоридом палладия с фосфиновыми лигандами взаимодействие ароматических галогенидов или трифлатов с 4,4,4´,4´,5,5,5´,5´-октаметил-2,2´-би-1,3,2-диоксабороланом (бис(пинаколято)дибораном), известное как реакция Мияура:


Реакция протекает при нагревании в таких растворителях, как диоксан, диметилсульфоксид или толуол. Важную роль при этом играет выбор основания, так как в присутствии сильных оснований полученный эфир арилбороновой кислоты может реагировать далее с исходным ароматическим соединением по реакции Сузуки (см. с. 47) с образованием бифенильного производного. Синтезируемые по этой схеме пинаколятные эфиры арилбороновых кислот можно выделять обычными способами, включая хроматографирование на колонке, поскольку они устойчивы на воздухе и достаточно трудно гидролизуются.
Бороновые кислоты очень прочно сорбируются силикагелем, что затрудняет их анализ с помощью тонкослойной хроматографии и очистку хроматографированием на колонке с этим сорбентом. В соответствии с этим для выделения и идентификации их чаще всего переводят в эфиры. Одним из таких эфиров может быть гетероциклический эфир с координационной связью между атомами азота и бора, образующийся при этерификации бороновой кислоты диэтаноламином:

Основная область применения производных бороновых кислот в органическом синтезе представлена в настоящее время превращениями с образованием углерод-углеродных связей по реакции Сузуки (A. Suzuki, 1979 г., Нобелевская премия 2010 г.). Эта реакция представляет собой кросс-сочетание арилгалогенидов или винилгалогенидов с арилбороновыми, винилбороновыми кислотами или же с их производными при действии сильных оснований в присутствии солей палладия с фосфиновыми лигандами, например:
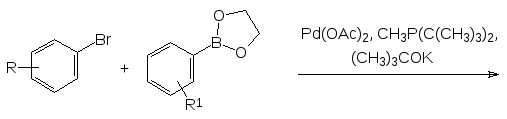

В соответствии с представленной схемой бифенильные соединения получают при комнатной температуре по реакции замещённых бромбензолов с эфирами арилбороновых кислот и третбутилатом калия (молярное отношение 1:1,5:3) в присутствии 5 мольн. % ацетата палладия(II) и 10 мольн. % дитретбутилметилфосфина.
Первоначальный вариант реализации сочетания по реакции Сузуки подвергался самым разным модификациям. В частности, оказалось, что в качестве оснований можно использовать даже гидроксиды щелочных металлов, арилгалогениды можно заменять сульфонатами, а в качестве катализаторов можно использовать соли никеля с небольшими добавками палладия. Упрощённые методики проведения реакции Сузуки можно использовать для получения биологически активных веществ в количествах до нескольких сотен килограммов. В качестве примера можно привести синтез агониста эндотелина CI-1034 на палладиевом катализаторе (Pd-Cat) с гидроксидом калия в качестве основания по схеме:

Эндотелин – это пептидный гормон (в его состав входит 21 аминокислота), вызывающий сокращение гладкой мускулатуры кровеносных сосудов. По представленной выше реакции синтетический агонист эндотелина получают с выходом более 92 %. Такой высокий выход позволяет легко выделять препарат CI‑1034 из реакционной массы без использования хроматографических способов очистки.
В качестве примера реакции Сузуки с участием винильных соединений можно привести получение эфира ненасыщенной карбоновой кислоты с двумя гидроксильными группами, одна из которых защищена устойчивой в основных средах метоксиметильной группой:


Интересно, что максимальный выход в этой реакции достигается при использовании в качестве основания гидроксида таллия.
Ещё один пример использования бороновых кислот в органическом синтезе представлен протекающим по схеме реакции Ульмана синтезом исходного продукта для получения гормонов щитовидной железы:


Реакция ацетилированного эфира дииодтирозина с 4-гидроксифенил-бороновой кислотой с диметилтретбутилсилильной защитой (TBS) гидроксильной группы протекает со стехиометрическим количеством ацетата меди в дихлорметане в присутствии избытка триэтиламина и пиридина при 25 ºС за 18 ч с выходом по целевому продукту около 85 %. В оригинальном варианте реакции Ульмана, протекающей при температуре более 180 ºС, используемый в качестве исходного соединения эфир N‑ацетилдииодтирозина подвергся бы полному осмолению.
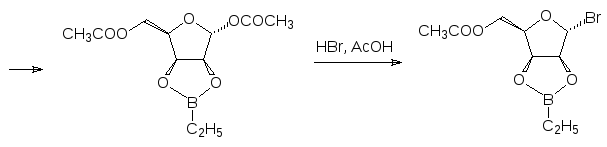
Арилбороновые кислоты могут найти применение в качестве промоторов и катализаторов широкого ряда химических превращений. Они могут использоваться в качестве защитных групп для диолов и диаминов. Так, например, при нагревании D-ликсозы с триэтилбороксином в бензоле образуется этилборат фуранозной формы углевода, который после ацетилирования и замены аномерной ацетоксигруппы на атом брома действием раствора бромистого водорода в уксусной кислоте превращается в используемый для получения соответствующих гликозидов бромид:

В то же время бороновые кислоты могут стать новым перспективным классом биоактивных соединений. Выше отмечалось использование борорганических соединений для нейтронозахватной терапии злокачественных опухолей, но лекарственное применение этого класса элементоорганических соединений этим не ограничивается. Известны бороновые кислоты и их производные с бактерицидной и фунгицидной активностью. Ещё в XIX веке было показано, что фенилбороновая кислота токсична для микроорганизмов и достаточно безвредна для высших животных. Противомикробные свойства простейших арилбороновых кислот интенсивно исследовались в 30-е гг. прошлого столетия. При этом было также показано, что они являются регуляторами роста растений, стимулирующими рост корневой системы. Некоторые бороновые кислоты, а также бензодиаза- и бензодиоксаборольные соединения на их основе оказались стерилизаторами для комнатных мух.
Бороновые кислоты эффективно блокируют сериновые гидролазы, что также может быть использовано в лекарственных целях. В качестве примера можно привести пептидомиметик бортезомиб, в молекуле которого функциональная группа бороновой кислоты заменяет карбоксильную группу в структурном элементе, соответствующем лейцину. Этот препарат поступает в продажу под названием Велкэйд, Неомиб и Бортекад:

Более мягким терапевтическим эффектом отличается структурный аналог бортезомиба деланзомиб:

У деланзомиба менее выражены такие побочные эффекты бортезомиба, как кожные высыпания, слабость, повышение температуры и периферическая нейропатия (болевые ощущения, онемение и покалывание в конечностях).
Бортезомиб стал первым терапевтическим ингибитором протеасом, прошедшим клинические испытания на людях. Протеасомы представляют собой клеточные комплексы, предназначенные для деградации выполнивших свою функцию или поврежденных белков. В некоторых злокачественных опухолях присутствуют белки, которые убивают раковые клетки, но они слишком быстро разрушаются протеасомами. Блокировка активности протеасомальных ферментов бортезомибом используется для лечения рецидивов и рефрактерных форм множественной миеломы.
Получен также структурный аналог простагландина с остатком бороновой кислоты вместо карбоксильной группы:

Однако в виде устойчивого к гидролизу пинаколятного эфира это борорганическое соединение менее активно, чем его прототип с карбоксилатной группой.
