
Виды химической связи
Ковалентная связь – связь возникающая за счет образования общих электронных пар.
В
двухатомных молекулах (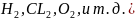 образуется неполярная ковалентная
связь, т.к. общая электронная пара в
одинаковой степени принадлежит обоим
атомам. F
+ F
→ F
F
образуется неполярная ковалентная
связь, т.к. общая электронная пара в
одинаковой степени принадлежит обоим
атомам. F
+ F
→ F
F
Одинарная ковалентная связь - атомы связаны одной общей электронной парой, если двумя, то связь двойная, если тремя то тройная. N + N → N N (число неспареных электронов 8-N = 3, N-номер группы)
Полярная
ковалентная связь
– связь между атомами различных элементов
неметаллов (HCL,
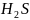 ,
N
,
N )
)
Общие электронные пары в таких соединениях смещены к атомам с большей электроотрицательностью.
Ионная связь – связь возникающая между ионами, за счет электростатического притяжения.
Ионная связь возникает между атомами элементов, резко отличающимися по величине электроотрицательности. Например между типич. металлами и типич. неметаллами (Na CL, Na, F)
Кроме того ионная связь образуется между атомами металла и кислорода в солях кислотосодержащих кислот и в щелочах.
Металлическая связь – связь в металлах между атом-ионами по средством обобществленных электронов.
Атомы металлов на внешнем уровне содержат мало электронов. Эти электроны легко отбрасываются, а атомы превращаются в положительные ионы. Оторвавшиеся электроны перемещаются от одного иона к другому связывая их в единое целое.
Электрод – это металл или др. токопроводящий материал, погруженный в раствор его соли (электролита), а реакция протекающая на нём, называется электродной реакцией. Если металл привести в контакт с раствором соли, то ионы
 ,
гидратируясь, переходят с поверхности
металла в раствор, и дегидратируясь,
обратно, из раствора в металл (под
действием сил кристаллической решётки).
Когда скорости этих процессов становятся
равными, образуется ДЭС (двойной
электро-слой) и возникает электродный
потенциал.
,
гидратируясь, переходят с поверхности
металла в раствор, и дегидратируясь,
обратно, из раствора в металл (под
действием сил кристаллической решётки).
Когда скорости этих процессов становятся
равными, образуется ДЭС (двойной
электро-слой) и возникает электродный
потенциал.
Электродный потенциал (𝞿) -это разность электростатических потенциалов между электролитом и электродом.
Значение электродного потенциала зависит от природы веществ – участников электродного процесса, от концентрации этих веществ, от t и определяется по уравнению Нернста.
Уравнение
Нернста:
 =
= +
+
 ox,
Red
– концентрации окислительной и
восстановительной форм
ox,
Red
– концентрации окислительной и
восстановительной форм
 –число
электронов, принимающих участие в
процессе.
–число
электронов, принимающих участие в
процессе.
– cтандартный электродный потенциал (тбл. величина)
Уравнение
Нернста для металлических электродов:
 +
+
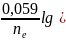
для
окислительно-восстановительных
электродов:

для
водородного электрода:
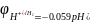
 (условно
принято) – это НВЭ (нормальный водородный
электрод) принят в качестве эталона,
для сравнения электродных потенциалов
различных электрохимич. систем.
(условно
принято) – это НВЭ (нормальный водородный
электрод) принят в качестве эталона,
для сравнения электродных потенциалов
различных электрохимич. систем.
Условие
протекания окислительно-восстановительной
реакции:

Гальванический элемент – прибор, в котором за счет самопроизвольно идущей реакции окисления-восстановления получается электрический ток. Он представляет собой систему из 2-х электродов, соединенных жидкостным мостиком или полупроницаемой перегородкой. Если соединить электроды металлическим проводником, то электроны перетекут от одного электрода (восстановителя) к другому (окислителю) получится электрический ток. Хим. энергия превращается в электрическую. Окислитель - электрод с бОльшим значением потенциала (катод(+)), на катоде идут процессы восстановления.
Восстановитель – электрод с меньшим знач. потенциала (анод(-)), на аноде идут процессы окисления.
Аккумулятор – это обратимый химический источник тока, его можно перезаряжать и использовать многократно.
Например свинцовый аккумулятор (кислотный) - состоит из электродов (положительного и отрицательного)и электролита.
1-й электрод – свинец , 2-й элктрод –диоксид свинца, электролит 30% серной к-ты.
Принцип работы основан на электрохимических реакциях свинца и диоксида свинца, в водном растворе серной кислоты.
Общее
уравнение работы аккумулятора:

Электролиз – окислительно-восстановтительный процесс, протекающий на электродах при прохождении тока через электролит.
В электролитеческую ванну, заполненную электролитом, опускают 2 электрода, и присоединяют к источнику тока. Источник тока перекачивает электроны от одного электрода к другому. Электрод с которого снимаются электроны приобретает + заряд (анод), который получает электроны (-) заряд (катод).
Прцессы, протекающие при электролизе определяются свойствами электролита, растворителя и материала электрода. (Если электролиз протекает в водном растворе, то на катоде им аноде могут восстанавливаться и окисляться молекулы Н2О.
Катод: 2Н2О + 2е = 2 ОН
Анод: А2Н2О – 4е = О2 + 4Н
Если возможно протекание нескольких реакций, то в первую очередь протекает та, которая требует минимальных затрат энегрии.
Инертным называется электрод, материал которого не окисляется в ходе электролиза.
На аноде может окисляться материал самого анода, например, елси анод из Ni, Cu,Cd, Pb и др. Такие аноды называюся растворимыми.
Метод с растворимым анодом используется для рафинирования металлов. Анод выполнен из черного металла.
Электрохимическая поляризация –явление отклонения потенциала элетродной реакции от равновесного. Перенапряжение – величина на которую идет отклонение ɳ (эта).
Возникновение поляризации связано с замедленностью отдельных стадий электрохимического процесса. Особенно велика поляризация при выделении газов О2, Н2. Поляризация электрода зависит от материала электрода, чем выше плотность тока i=I/S (I – ток, проходящий через электрод, S- площадь электрода). Поляризационная кривая – зависимость потенциала электрода от плотности тока.
 –
Величина
поляризации.
–
Величина
поляризации.
11)
Законы
фарадея:
1-й
закон:
Масса
в-ва, образуется при электролизе,
пропорциональна кол-ву электричества,
прошедшего через электролит.
 =
K*Q где: Q- кол-во электричества, Q=I*t,
где: I-cила тока, t-время.
=
K*Q где: Q- кол-во электричества, Q=I*t,
где: I-cила тока, t-время.
K= где: Э- эквивалентная
масса Э
=
где: Э- эквивалентная
масса Э
= где: М
– моль (молярная масса вещества), n –
число электронов, перемещаемых при
окислении или восстановлении, F
– число Фарадея = 26,8 А или 96500 К/моль.
где: М
– моль (молярная масса вещества), n –
число электронов, перемещаемых при
окислении или восстановлении, F
– число Фарадея = 26,8 А или 96500 К/моль.
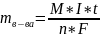


2-й закон: При прохождении через разные электролиты одного и того же количества электричества массы веществ, выделившихся на одноименных электродах пропорциональны их эквивалентным массам.
Применение вэлектрохимических процессов: 1) Принцип г.Э используется в автономных источниках питания. Бывают первичные и вторичные. Первичные – необратимы, не могут вернуться в рабочее состояние посли расхода активного в-ва (батарейки питания). Вторичные – можно регенирировать, пропуская ток в обратном направлении (аккумуляторы).
Электролиз
используется в промышленности:
для получения
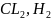 щелочей и др. веществ., для получения
многих металлов – AL, Mg,
Na,
Cd.,
для очистки (рафинирования) Ме, используются
загрязнённые Ме, в качестве анода (Cu,
Ni, Pb) , используется в гальванотехнике.
щелочей и др. веществ., для получения
многих металлов – AL, Mg,
Na,
Cd.,
для очистки (рафинирования) Ме, используются
загрязнённые Ме, в качестве анода (Cu,
Ni, Pb) , используется в гальванотехнике.
Гальваностегия – процесс нанесения на поверхность металлических изделий слоёв других металлов, это делают для защиты от коррозии и для красоты.
Гальванопластика – для получения отпечатков, копий изделий, например для типографических клише.
13) Физические св-ва металлов. Металлический блеск, высокая электропроводность, теплопроводность, ковкость, пластичность. Эти свойства обуславливаются наличием в металлах подвижных электронов и металлической связи.
Различие в природе металлов, их структуре приводит к различию некоторых физ свойств. Щелочные (Li, Na, K, Rb, Cs) при малой плотности упаковки и малом заряде мЯгки, а d- металлы (Cr) очень твердые. Большое различие есть в t плавления, от 28°C (Cs) до 3370°C (W).
12)
Положение металлов в периодической
системе. В
период. системе большинство элементов
– металлы. К металлам относятся все
s,d,f-элементы
(кроме
 и He)
а так же р-элементы. К р-элементам относят
элементы III A гр – AL, Ga,
In,
IV A гр – Ge, Sn,
Pb,
в V
A
гр Sb,
Bi,
и в VI
A
– Ро (полоний).
и He)
а так же р-элементы. К р-элементам относят
элементы III A гр – AL, Ga,
In,
IV A гр – Ge, Sn,
Pb,
в V
A
гр Sb,
Bi,
и в VI
A
– Ро (полоний).
Классификация металлов: 1.По электронной структуре: s,p,d и f – металлы.
2. По восстановительной активности: активные (Li-AL)(по ряду напряжений), средние (AL-H),
не активные (Cu-Au, и т.д…)
Особенности кристаллов металлов: атомы металлов выстраиваются в кристаллические решетки
Виды кристаллических решеток: Объемно центрированная (кубическая), гранецентрированная (кубич.), плотнейшая гексагональная.
Особенности строения атомов: на внешнем энергетическом уровне малое кол-во электронов.
Методы получения металлов: 1. Металлотермия - восстановление руд, с помощью алюминия, магния, и др. металлов

2.Пирометалургия
– востанивление руд с помощью угля, СО,
 при высоких t:
при высоких t:
 +
+ → 2 Fe
+ 3
→ 2 Fe
+ 3 (при температуре)
(при температуре)
б)

3.Электролиз
: а) Сu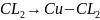 (Сu
– катод, CL
– анод)
(Сu
– катод, CL
– анод)
б)
2NaCL → 2Na
+
 (2Na
– катод,
(2Na
– катод,

4.Гидрометалургический метод – так же часто включает стадию получения металлов электрохимическим восстановлением.
2ZnS
+ 3 (при переработке сульфидных руд, сначала
сульфиды
(при переработке сульфидных руд, сначала
сульфиды
переводят в оксиды при высокой t.)
ZnO
+
 +
+

2Zn + 2
+ 2 (2Zn – катод,
(2Zn – катод,
 )
)
Современные технологии направлены на получение металлов высокой чистоты (зонная плавка, плавка электронными лучами и т.д.)
14) Химические св-ва металлов. По хим. св-вам металлы являются восстановителями и реагируют с окислителями.
В период. системе большинство элементов – металлы. К металлам относятся все s,d,f-элементы (кроме и He) а так же р-элементы. К р-элементам относят элементы III A гр – AL, Ga, In, IV A гр – Ge, Sn, Pb, в V A гр Sb, Bi, и в VI A – Ро (полоний).
Классификация металлов: 1.По электронной структуре: s,p,d и f – металлы.
2. По восстановительной активности: активные (Li-AL)(по ряду напряжений), средние (AL-H),
не активные (Cu-Au, и т.д…)
Восстановительная активность свободных атомов металлов характеризуется энергией ионизации ( ). Чем меньше , тем выше восстановительная актив. металла. В гр. А, (для s и р-металлов) восстановительная актив. растет сверху вниз, а в гр. В (для d-металлов) –уменьшается.
В растворах восстановительная активность атомов металлов характеризуется значением электродного потенциала ( ). Чем отрицательнее , тем выше восст. актив.. Самые активные восстановители – щелочные металлы.
1)
Металлы энергично реагируют с
простыми веществами:
 ,
галогены(фтор, хлор, бром, йод), сера,
водород.
,
галогены(фтор, хлор, бром, йод), сера,
водород.
С кислородом: Большинство металлов окисляются на воздухе, покрываясь оксидной плёнкой, если плёнка плотная, она предохраняет металл от коррозии. все щелочные металлы: Li,Na,К, и т.д. активно реагируют с кислородом, Rb, Cs – самовоспламеняются.
С
хлором:
энергично реагируют (Mg+ =Mg
)
=Mg
)
C серой: менее энергично (при нагревании) (Fe+S→FeS cульфид железа)
С
водородом:
реагируют только щелочные и
щелочно-земельные металлы. (2Li+
=2LiH)
(Ca+ )
)
2)
Реакции
с
водой:
Ме+ ↑
металлы реагируют с
↑
металлы реагируют с
 если
их электродный потенциал ниже чем у
водорода (ниже 0) реагируют вытесняя
.
Например:
если
их электродный потенциал ниже чем у
водорода (ниже 0) реагируют вытесняя
.
Например:
 -2,714в, поэтому 2Na+
-2,714в, поэтому 2Na+
Если на поверхности металла находится оксидная пленка взаимодействие с водой протекает при нагревании.
3) Реакции с растворами солей: металлы реагируют с растворами солей, вытесняя из них менее активный металл:
 (
)
(
)
 Cu
= 0,337 в, ( )
Cu
= 0,337 в, ( )
 /Ni
= - 0,25в
/Ni
= - 0,25в
4)Реакции
с щелочами:
реакции протекают с выделением
,
электродный потенциал должен быть
 ,
металл должени иметь амфотерную природу
своих оксидов и гидрооксдов (это
AL,Zn,Cr,Be
и др.)
,
металл должени иметь амфотерную природу
своих оксидов и гидрооксдов (это
AL,Zn,Cr,Be
и др.)
5) Реакции с кислотами: взаимодействие металлов с кислотами зависит от активности металла, концентрации к-ты и t.
HCL-взаимодействует только с металлами у которых , с выделением водорода, хлорид металла должен быть растворим в воде.
 (разбавленая
серная к-та реагирует с металлами так
же, как соляная: Zn+
(разбавленая
серная к-та реагирует с металлами так
же, как соляная: Zn+
Концентрированная
серная кислота окисляет металлы за счет
сульфат-иона (
)
продукты восстановления зависят от
активности металла.
 к
к
 Mg
+
Mg
+ (активные восстанавливают до
(активные восстанавливают до
 ,
средние до
,
средние до
 ,
малоактивные до
,
малоактивные до
 .
.
Серная к-та пассивирует металлы: Fe, Co, Ni, Cr, AL, Be. (с этими металлами реакция идет только при нагревании).
В реакцию с концентрированной серной кислотой вступает медь
Реакция
с разбавленной азотной кислотой.
Разбавл. азот. к-та более сильный
окислитель чем серная, окисляет
большинство металлов при комнатной t.
Восстанавливается с активными металлами
до
 ,
с металлами средней активности до
,
с металлами средней активности до
 или
или
 ,
с неактивным до –NO.
,
с неактивным до –NO.
Концентрированная азотная к-та восстанавливается с большинством металлов до бурого газа –NO, и еще она пассивирует те же металлы при обычной t. (Fe,Ni,Co,Cr,AL,Be)
Неактивные
d-металлы
не окисляются азотной к-той, их можно
окислить «царской водкой»
 +
+
 .
.
В реакциях металлов с азотной к-той любой концентрации и концентрированной серной к-той водород не выделяется.
